1314-piles 1ª part
Anuncio
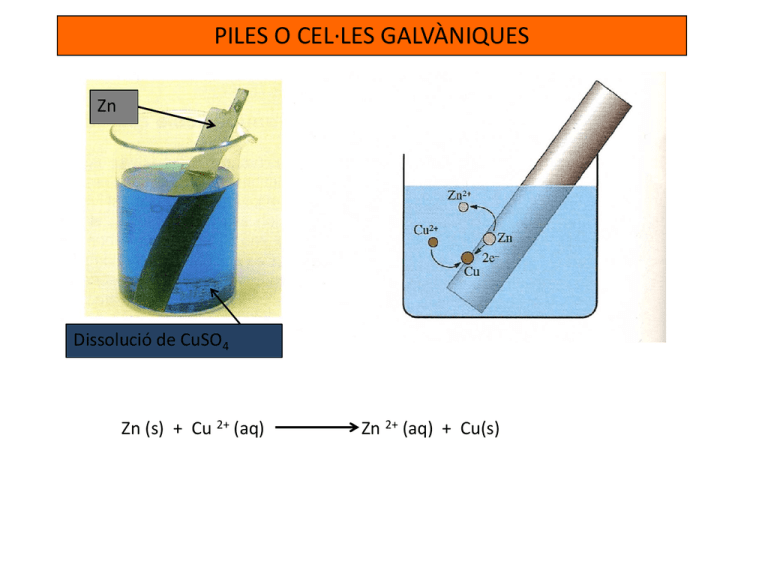
PILES O CEL·LES GALVÀNIQUES Zn Dissolució de CuSO4 Zn (s) + Cu 2+ (aq) Zn 2+ (aq) + Cu(s) PILES O CEL·LES GALVÀNIQUES Pila o cel·la galvànica: és una dispositiu mitjançant el qual es pot obtenir energia elèctrica a partir d’una reacció redox de manera espontània. PILA DANIELL Zn (s) + Cu 2+ (aq) Zn 2+ (aq) + Cu(s) PILES O CEL·LES GALVÀNIQUES PILA DANIELL Zn (s) + Cu 2+ (aq) Zn 2+ (aq) + Cu(s) Parts d’una pila: A) Semireaccions: ÀNODE (Oxidació): Zn Zn 2+ + 2 e- Polaritat (-) CÀTODE (Reducció): Cu2+ 2 eCu Polaritat (+) B) Pont salí C) Electrodes PILES O CEL·LES GALVÀNIQUES PILA DANIELL Zn (s) + Cu 2+ (aq) Zn 2+ (aq) + Cu(s) Parts d’una pila: B) Pont salí: -Què és? És un tub de vidre en forma de U on hi ha una dissolució concentrada d’electròlit inert respecte a la reacció redox. Normalment es tracta de dissolucions de NaCl o NH4NO3. Els extrems del tub estan tapats amb paper de filtre, cotó fluix o alguna altra substància porosa. -Per què serveix? Serveix per mantenir la neutralitat elèctrica de les dissolucions de cada semicel·la. Deixa passar els IONS de la dissolució d’una semipila a l’altra selectivament. Els cations migren al càtode i els anions migren cap a l’ànode. A més tanca el circuit. PILES O CEL·LES GALVÀNIQUES PILA DANIELL Animacions funcionament d’una pila Construcció d’una pila: http://www.chem.iastate.edu/group/Greenbowe/sections/projectf older/flashfiles/electroChem/volticCell.html Pont salí: http://www.chem.iastate.edu/group/Greenbowe/sections/projectf older/animations/CuZncell.html







