1314-PROBLEMES PILES-ELECTROLISI
Anuncio

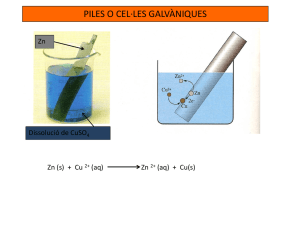
Science and Technology Department QUÍMICA UNITATS 8-9. 2n Batxillerat PILES I ELECTRÒLISI Piles 1. Coneixem els potencials estàndard de reducció, a 298 K, del coure i del zinc: E°(Cu2+ | Cu)=+0,34V E°(Zn2+ | Zn)=–0,76V a) Expliqueu raonadament quina reacció espontània tindrà lloc en una pila formada per aquests dos elèctrodes, en condicions estàndard i a 298 K. Calculeu la força electromotriu (FEM) de la pila en aquestes condicions. [1 punt] b) Volem comprovar experimentalment la força electromotriu d’aquesta pila en condicions estàndard i a 298 K. Expliqueu com la muntaríeu al laboratori per a fer-ne la comprovació, i indiqueu el material i els reactius que utilitzaríeu. [1 punt] 2. Al laboratori disposem d’una solució aquosa de Zn 2+ 1,0 M, d’una solució aquosa de Cu2+ 1,0 M i de ferro i alumini sòlids. a) Quina reacció faríeu per a obtenir zinc sòlid? Justifiqueu la resposta. [1 punt] b) Escriviu l’equació de la reacció entre la solució aquosa de Cu2+ i l’alumini sòlid i calculeu l’energia lliure estàndard d’aquesta reacció. [1 punt] DADES: Considereu que les reaccions es produeixen a 25 °C. / F= 9,65·104C·mol–1. 3. La reacció redox que s’indica a continuació té lloc espontàniament: Zn(s) + 2 AgNO3 (aq) 2 Ag (s) + Zn(NO3)2 (aq) a) Expliqueu com es pot construir una pila basada en la reacció anterior. b) Indiqueu les reaccions que tenen lloc en cadascun dels elèctrodes (ànode i càtode). c) Calculeu la força electromotriu estàndard de la pila. d) Calculeu la massa de Zn que haurà reaccionat quan la pila hagi fet circular una càrrega de 19300 C. Dades: masses atòmiques: Zn=65,4. 1 F = 96500 C·mol-1 Eº (Zn2+/Zn) = -0,76 V; Eº (Ag+/Ag) = 0,80 V Science and Technology Department 4. Es disposa de làmines de coure, ferro, zinc i plata, sals d’aquests elements i material divers de laboratori. a) Indiqueu quina seria la pila amb un potencial estàndard més elevat que podríeu preparar. Indiqueu el càtode, l’ànode i el sentit en què circulen els electrons pel circuit extern. b) Expliqueu com prepararíeu aquesta pila al laboratori i feu-ne un esquema. Dades: Potencials estàndard: Eº (Zn2+/Zn) = -0,76 V; Eº (Cu2+/Cu) = 0,34 V, Eº (Ag+/Ag) = 0,80 V, Eº (Fe2+/Fe) = -0,41 V 5. Una pila galvànica està formada per les semipiles Sn 2+ (aq)/Sn (s) i Fe3+ 2+ (aq)/Fe (aq), a concentració estàndard. a) Indiqueu raonadament la reacció que té lloc en aquesta pila i doneu-ne la notació. b) Calculeu la força electromotriu de la pila i la variació d’energia lliure de Gibbs estàndard de la reacció. Dades: Potencials estàndard de reducció: Eº (Sn2+/Sn) = -0,14 V; Eº (Fe3+/Fe2+) = 0,77 V. 1 F = 9,65·104 C/mol 6. Es disposa d’una pila galvànica Cr / Cr(NO3)3(aq) (1M) // AgNO3(aq) (1 M) / Ag De fem igual a 1,54 V. a) Indiqueu l’ànode i el càtode, escriviu les semireaccions corresponents i indiqueu quin elèctrode disminuirà de massa en funcionar la pila. b) Calculeu el potencial estàndard de reducció del metall que s’oxida. c) Justifiqueu si és possible cromar (recobrir de crom) un objecte de plata submergint-lo en una solució que contingui ió crom (III) a la concentració d’1 mol/L. Dades: Potencial estàndard de reducció: Eº(Ag+/Ag)=0,8 V 7. Per al muntatge d’una pila, tenim a la nostra disposició barretes de coure i de plata i dissolucions 1 M de nitrat de coure (II) i de nitrat de plata. a) Feu un esquema de la pila que podríem construir, indicant l’ànode, el càtode, les reaccions que tenen lloc a cada elèctrode, la reacció global i el sentit de circulació dels electrons. b) Determineu la força electromotriu estàndard de la pila c) Calculeu la variació d’energia de Gibbs estàndard per a la reacció que es produeix. Dades: Eº (Cu2+/Cu) = 0,34 V, Eº (Ag+/Ag) = 0,80 V, 1 F = 9,65·104 C/mol 8. Justifiqueu si es produirà reacció en cadascun dels casos següents. En cas afirmatiu, cal escriure la reacció i en cas contrari explicar per què no es produeix. La concentració de totes les solucions és 1 mol·L-1. a) Introduïm un tros de cadmi en una solució de sulfat de zinc. Science and Technology Department b) Introduïm un tros de zinc en una solució de sulfat de cadmi. c) Mesclem una solució de sulfat de zinc amb una de sulfat de cadmi. d) Introduïm un tros de cadmi en una solució d’àcid clorhídric. Dades: Potencials de reducció a 25 ºC: Eº (Zn2+/Zn) = -0,76 V; Eº (Cd2+/Cd) = -0,40 V. 9. Es disposa d’una làmina de ferro i d’una de coure i de solucions d’1 mol/L de sulfat de coure(II) i de sulfat de ferro(II). a) Expliqueu què més necessitaríeu i com construiríeu una pila voltaica amb aquestes substàncies b) Identifiqueu l’ànode i el càtode, escriviu les semireaccions i la reacció global i indiqueu el camí seguit pels electrons en el circuit exterior. c) Què caldria fer per tal que es produís en aquesta pila la reacció contrària a la que heu escrit? Dades: Potencials de reducció a 25 ºC: Eº (Cu2+/Cu) = 0,34 V; Eº (Fe2+/Fe) = -0,44 V. 10. Al laboratori es fa el muntatge d’una pila amb una làmina de cobalt submergida en una solució 1 M de nitrat de cobalt (II) i un elèctrode estàndard de clor (en una solució 1 M de KCl). La força electromotriu estàndard d’aquesta pila a 25 ºC és 1,64 V. a) Identifiqueu quin elèctrode és l’ànode i quin és el càtode i escriviu les reaccions que tenen lloc en aquests. b) Indiqueu i justifiqueu quin és el sentit dels moviment dels electrons pel circuit. c) Trobeu el potencial estàndard de reducció del parell Co2+/Co. Dades: Potencials de reducció a 25 ºC: Eº (Cl2/Cl-) = 1,36 V. 11. a) Expliqueu com construiríeu la pila següent: Pt / Fe3+ (1 M), Fe2+ (1M) // Ag+ (1 M) / Ag b) Escriviu les equacions dels processos anòdic i catòdic. c) Calculeu l’augment de massa del càtode quan la pila hagi generat 19300 C. Dades: Potencials estàndard de reducció: Eº (Ag+/Ag) = 0,80 V; Eº (Fe3+/Fe2+) = 0,77 V; Constant de Faraday, F = 9,65·104 C/mol; Massa atòmica: Ag=108. 12. Disposem de dissolució de nitrat de coure (II) 1 M i dissolució de sulfat d’estany (II) 1 M, com també de barretes de coure i estany i material divers de laboratori. a) Expliqueu com construiríeu una pila amb aquests components. Dibuixeu un esquema de la pila i anomeneu el material emprat. b) Indiqueu l’ànode i el càtode i les reaccions que hi tenen lloc. c) Indiqueu el sentit de circulació dels electrons i trobeu la força electromotriu de la pila Dades: Eº (Cu2+/Cu) = 0,34 V; Eº (Sn2+/Sn) = -0,14 V. Science and Technology Department 13. En el laboratori disposem de magnesi, alumini, or i àcid nítric. a) Quines espècies escollires per construir una pila amb el potencial més alt? b) Indica les semireaccions que es produiran a cada elèctrode, el sentit dels electrons i la reacció global de la pila. Dades: Eº (Mg2+/Mg) = -2,34 V; Eº (Al3+/Al) = -1,66 V; Eº (Au3+/Au) = 1,50 V; Eº (NO3-/NO) = 0,96 V. 14. D’acord amb els potencials estàndard de reducció següents, indica: Eº (Cl2/Cl-) = 1,36 V; Eº (Br2/Br-) = 1,06 V; Eº (I2/I-) = 0,54 V. a) Quina és l’espècie més oxidant? b) La reacció entre l’ió clorur i el iode molecular és espontània? c) La reacció entre el clor molecular i l’ió bromur és espontània? d) Indica les semireaccions i les reaccions globals possibles. 15. Tenint en compte el potencial Eº (Ni2+/Ni) = -0,25 V i la força electromotriu de les piles següents: Cd(s)/Cd2+(aq) (1M) // Ni2+(aq) (1M) / Ni(s) Eºpila=0,15 V Cd(s)/Cd2+(aq) (1M) // S2O82-(aq) (1M) / SO42-(aq) (1M) (Pt) Eºpila=2,41 V a) Dedueix Eº(S2O82-/ SO42-). b) Escriu les semireaccions de les piles. 16. Explica què pot passar quan en una dissolució de sulfat de ferro (II) s’introdueix una làmina de: a) Níquel. b) Zinc. c) Alumini. d) Plata. Dades: Eº (Fe2+/Fe) = -0,44 V; Eº (Fe3+/Fe2+) = 0,77 V; Eº (Ni2+/Ni) = -0,25 V; Eº (Zn2+/Zn) = -0,76 V; Eº (Al3+/Al) = -1,66 V; Eº (Ag+/Ag) = 0,8 V; 17. Si Eº (Hg2+/Hg) = 0,85 V; Eº (Cu2+/Cu) = 0,34 V: a) Indica quin és el càtode i quin és l’ànode i el sentit en què es mouen els electrons pel circuit exterior. b) Fes un diagrama de la pila. c) Calcula’n la FEM. d) Calcula l’energia lliure de Gibbs de la reacció. Science and Technology Department 18. Per a una pila la notació de la qual és: Cd / Cd2+ (1M) // S2O82- (1M), SO42- (1 M) (Pt) a) Dibuixa el muntatge que faries i indica el material i els reactius que empraries per construir la pila. b) Calcula la força electromotriu de la pila. c) Calcula la disminució de massa de l’ànode quan la pila hagi subministrat un corrent de 0,05 A durant 1/2 h. Dades: Eº(S2O82-/ SO42-)=2,01 V; Eº (Cd2+/Cd) = -0,40 V. 19. Al laboratori, disposem de plata, iode, ferro i fluor. Segons els potencials estàndard de reducció, quins dels compostos següents podem preparar mitjançant una reacció redox espontània? Justifica les respostes. a) AgI b) FeI3 c)AgF Dades: Eº (Ag+/Ag) = 0,80 V Eº (I2/I-) = 0,54 V.Eº (Fe3+/Fe2+) = 0,77 V; Eº (F2/F-) = 2,87 V. 20. La pila de combustible d’electròlit polimèric que es mostra en la figura és una pila de combustible típica. El funcionament consisteix a introduir en la cel·la hidrogen i oxigen gasosos de manera continuada, alhora que s’elimina el producte de la reacció (aigua). Així, es pot generar energia elèctrica mentre es manté el subministrament de reactius. Aquesta pila està formada per dos elèctrodes recoberts de platí, que actua com a catalitzador, separats per una membrana polimèrica que conté un electròlit i que hi permet el pas de H+. Science and Technology Department a) Escriviu les semireaccions anòdica i catòdica, i la reacció global de la pila de combustible d’electròlit polimèric. Indiqueu la polaritat dels elèctrodes.[1 punt] b) La quantitat teòrica màxima d’energia elèctrica disponible en una pila electroquímica és la variació d’energia lliure (ΔG°), mentre que la quantitat màxima d’energia alliberada quan es crema un combustible és la seva variació d’entalpia (ΔH°). Per a avaluar una pila de combustible s’utilitza el paràmetre del valor d’eficiència (ε), que es defineix ε =ΔG°/ΔH°. Calculeu la força electromotriu (FEM) i l’eficiència (ε) de la pila de combustible d’electròlit polimèric, en condicions estàndard i a 298 K. [1 punt] DADES: Constant de Faraday, F=9,65×104 C·mol–1. Entalpia estàndard de formació de l’aigua líquida a 298 K: ΔHf°=–285,8 kJmol–1. Potencial estàndard de reducció a 298 K: E°(H+| H2)=0,00V; E°(O2|H2O)=1,23V. Science and Technology Department 21. 22. Science and Technology Department 23. Electròlisi 24. Tot i que els coberts de plata s’enfosqueixen per la reacció amb els compostos sulfurats que contenen els aliments, és corrent recobrir de plata coberts fabricats amb altres metalls més barats. Volem recobrir de plata una cullera mitjançant el procés electrolític d’una solució aquosa d’una sal de plata. a) Justifiqueu si la cullera ha d’actuar com a ànode o com a càtode de la cel·la electrolítica. Feu un dibuix esquemàtic d’aquest procés electrolític: indiqueu-hi el nom i la polaritat dels elèctrodes i la reacció que tindrà lloc a l’elèctrode on hi ha la cullera. [1 punt] b) Determineu quantes hores calen per a dur-ne a terme el recobriment, si la cullera té una superfície de 20cm2, el gruix del recobriment ha de ser de 0,010 cm i pel bany utilitzat hi passa un corrent de 0,020 A. [1 punt] DADES: Densitat de la plata = 10,5 g cm–3. Massa atòmica relativa de la plata = 107,87. Constant de Faraday, F=9,65×104 Cmol–1. Science and Technology Department 25. Mitjançant el procés d’electròlisi de l’aigua es poden obtenir hidrogen i oxigen gasosos. a) Indiqueu el material que necessitaríeu per a dur a terme aquest procés al laboratori i feu un esquema del muntatge experimental. Escriviu les equacions de les semireaccions que tenen lloc en cadascun dels elèctrodes. [1 punt] b) Determineu el volum d’hidrogen, mesurat a 1,0 atm i 25 °C, que s’obtindrà en efectuar l’electròlisi de l’aigua durant mitja hora amb una intensitat de corrent de 2,0 A. [1 punt] DADES: R = 0,082 atm·L·K–1·mol–1 = 8,31 J ·K–1·mol–1. F = 9,65 · 104 C·mol–1. 26. En fer l’electròlisi de clorur de liti fos, LiCl, s’obté Cl2 a l’ànode i Li al càtode. a) Escriviu el procés que té lloc en cadascun dels elèctrodes i indiqueu quin és el procés d’oxidació i quin el de reducció. Quina polaritat tenen els elèctrodes? [1 punt] b) Calculeu la intensitat de corrent necessària per a descompondre 15,0 g de clorur de liti fos en una hora. [1 punt] DADES: Masses atòmiques relatives: Cl = 35,5; Li = 6,9. Constant de Faraday = F = 9,65 · 104 C·mol–1. 27. L’electròlisi de l’aigua mitjançant un corrent elèctric continu proporcionat per cèlul·les fotovoltaiques pot ser una via sostenible per a l’obtenció d’hidrogen, un combustible que, a diferència dels hidrocarburs d’origen fòssil, no produeix gasos d’efecte d’hivernacle. 27.1. Es duu a terme l’electròlisi d’aigua acidulada amb H2SO4 fent servir un esquema experimental com el que es mostra en la figura de la dreta. a) Observant la figura, raoneu quin gas s’allibera en l’elèctrode A i en l’elèctrode B i indiqueu quin nom reben aquests elèctrodes. b) Escriviu les reaccions que tenen lloc en cadascun d’aquests elèctrodes. [1,5 punts] 27.2. En una cel·la electrolítica en què té lloc l’electròlisi de l’aigua, s’hi han alliberat, passat un cert temps, 4 g d’hidrogen gas. Calculeu la càrrega elèctrica que ha circulat per la cel·la durant aquest temps. [0,5 punts] DADES: F = 96 485 C · mol–1. Massa atòmica relativa: H = 1,0. G: generador de corrent continu. A i B: elèctrodes de Pt. S: solució aquosa de H2SO4. Science and Technology Department 28. Un corrent elèctric d’intensitat 965 mA passa durant 10 4 s a través d’una cel·la electrolítica que conté 1 litre d’una solució de clorur de potassi 0,1 M i s’obté clor gas i hidrogen gas. Calculeu: a) El volum de clor i el nombre de molècules d’hidrogen obtinguts a 300 K i 105 Pa. b) El pH de la solució al final de l’electròlisi si se suposa que el volum total no varia durant el procés. DADES: Constant de Faraday: 96500 C; Constant d’Avogadro: 6,023·10 23; Constant dels gasos: 8,31 J·K-1·mol-1 29. Una cel·la electrolítica conté una dissolució de clorur de coure (II) a la qual s’han introduït dos elèctrodes de platí units externament a un generador de corrent continu. Es fa circular per la cel·la un corrent de 5 A durant 30 minuts i s’observa l’aparició d’un sòlid vermellós que es diposita sobre un dels elèctrodes, mentre que en l’altre es produeix un despreniment gasós. a) Raoneu en quin dels elèctrodes (ànode o càtode) té lloc cada fenomen i indiqueu les reaccions que es produeixen en cadascun. b) Calculeu la massa de sòlid que es diposita. DADES: masses atòmiques: H=1; O=16; Cl=35,5; Cu=63,5. 1 F = 96500 C·mol-1 30. El sodi metàl·lic s’obté industrialment per electròlisi del clorur de sodi fos. a) Indiqueu en quin elèctrode (ànode o càtode) tindrà lloc la producció de sodi metàl·lic i escriviu la reacció corresponent. b) Si es fa circular un corrent de 80 A durant 30 minuts per un recipient que conté clorur de sodi fos, calculeu la càrrega que ha circulat i la massa de sodi que s’obté . c) Es podria obtenir sodi metàl·lic electrolitzant una dissolució de clorur de sodi? Justifiqueu la resposta. Dades: Masses atòmiques: Na=23; Cl=35,5. F=96500 C·mol-1. 31. Per una cel·la electrolítica que conté bromur de potassi fos es fa circular un corrent continu de 3 A durant una hora. a) Indiqueu quins són els productes de la reacció i escriviu els processos que tenen lloc al càtode i a l’ànode. b) Calculeu la massa (en g) que s’obté de cada producte. c) Tots dos productes poden provocar cremades a la pell; a més, un d’ells és molt verinós i l’altre produeix gasos inflamables en contacte amb l’aigua. Segons això, indiqueu quina o quines de les següents indicacions de perillositat cal posar a l’envàs de cada producte: Science and Technology Department Dades: masses atòmiques: K=39,1; Br=79,9 F=96500 C·mol-1 32. Si fem passar un corrent elèctric per una dissolució aquosa de nitrat de cobalt (II) es desprèn oxigen i cobalt. a) Indica les reaccions que hi ha en cada elèctrode. b) Calcula la intensitat de corrent que es necessita per dipositar 10,72 g de cobalt en 33 minuts. c) Calcula el volum d’oxigen gasós mesurat a 25 ºC i 9,5·104 Pa. 33. En l’electròlisi de 250 mL d’una dissolució 0,1 M de nitrat de plata es fa passar un corrent elèctric de 0,15 A durant 4 hores. a) Determina la massa de plata dipositada en el càtode. b) Calcula la concentració d’ió plata de la dissolució un cop acabada l’electròlisi. Suposa que el volum es manté. 34. Volem conèixer la quantitat d’electricitat que circula a través de dues cel·les electrolítiques connectades en sèrie. La primera conté una dissolució de nitrat de plata, mentre que la segona conté una dissolució de clorur de ferro(II). Si en el càtode de la primera s’hi han dipositat 1,3 g de plata: a) Determina el corrent elèctric que hi ha circulat. b) Calcula l’augment de massa de la segona cel·la. 35. Els aliatges d’osmi s’empren per a la fabricació de puntes de bolígraf, ja que és un metall de gran duresa. Es fa passar un corrent continu de 2,7 A durant dues hores i mitja per una dissolució aquosa de sal d’osmi. Determina la càrrega de l’ió osmi en la dissolució si en l’electròlisi s’han dipositat 7,98 g d’osmi en el càtode. Massa atòmica Os=190,2 36. Dues cel·les electrolítiques contenen dissolucions aquoses de nitrat de plata i d’àcid sulfúric, respectivament. Si hi fem passar la mateixa intensitat de corrent durant el mateix temps, obtenim a la primera 0,12 g de plata. Calcula els mols d’hidrogen alliberats a la segona cel·la. 37. Dues cel·les electrolítiques connectades en sèrie contenen una dissolució de clorur de coure (II) i una de nitrat de plata, respectivament. En circularhi el corrent elèctric, a la primera cel·la s’hi dipositen 3·10 22 àtoms de coure. Determina la massa de plata dipositada a la segona cel·la. Science and Technology Department 38. En l’electròlisi del clorur de sodi en dissolució aquosa s’obté clor a l’ànode, i hidrogen i medi bàsic al càtode. Fem circular un corrent de 3 A durant 5 min per 100 mL d’una dissolució aquosa de clorur de sodi. a) Indica les equacions dels processos anòdic i catòdic i de la reacció global. b) Calcula el pH de la solució final suposant que el volum de la solució es manté constant. 39. En electrolitzar una dissolució de clorur de coure (II) s’obté clor i coure. S’electrolitzen 500 mL d’una dissolució de clorur de coure (II) 0,1 M emprant un corrent de 5 A durant 30 min. a) Escriu les reaccions que tenen lloc als elèctrodes. b) Calcula la massa de coure i el volum de clor mesurat a 27 ºC i 1 atm. c) Calcula la concentració en mol/L de la dissolució de coure(II) en acabar el procés d’electròlisi.