Grupo 17
Anuncio
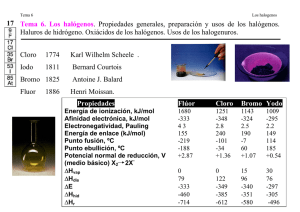
Química Inorgánica Grupo 17 1 GRUPO 17 Los elementos del grupo 17 se denominan halógenos y se comportan como no metales. Elemento símbolo flúor cloro bromo iodo astato F Cl Br I At configuración electrónica [He]2s2 2p5 [Ne]3s2 3p5 [Ar]3d10 4s2 4p5 [Kr]4d10 5s2 5p5 [Xe]4f14 5d10 6s2 6p5 Con excepción del F y At los números de oxidación pueden variar desde -1 hasta +7 (figura 1). Tienen elevadas energías de ionización, electronegatividad y afinidad electrónica. La electronegatividad y poder oxidante decrecen en el grupo. Como consecuencia de las altas electronegatividades y abundancia en la naturaleza de los halógenos más livianos, los compuestos halogenados son importantes en química. Figura 1. Diagrama de Frost para Cl, Br y I en medio ácido (línea superior) y en medio básico (línea inferior). Obtención Son demasiado reactivos para encontrarse en forma libre en la naturaleza. El F se encuentra en minerales como la criolita y el espato flúor. El cloro se encuentra en salinas y en el agua de mar. Tanto el flúor como el cloro se obtienen por electrólisis (figura 2). El Br se encuentra en el agua de mar de la cual se puede extraer. Es I existe en minerales en forma de iodato de sodio, NaIO 3. El At es radiactivo y el isótopo más estable tiene una vida media de 8,3 h. Química Inorgánica Grupo 17 2 Figura 2. Diagramas de celdas electrolíticas para la obtención de flúor y cloro (de membrana y de mercurio). Propiedades ➢ a temperatura ambiente existen como moléculas diatómicas. ➢ el flúor es un gas amarillento que reacciona con la mayoría de los moléculas orgánicas, inorgánicas y los gases nobles Kr, Xe y Rn. Es difícil de almacenar (se usan recipientes de acero) y de manipular. ➢ el cloro es un gas verdoso tóxico ➢ el bromo es un líquido marrón volátil, tóxico y cáustico. ➢ el iodo es un sólido negro brillante que sublima fácilmente a un vapor violeta por calentamiento, este color persiste en soluciones de disolventes no polares, en disolventes polares genera soluciones de color café, indicando la presencia de iones poliyoduro, como I3-. ➢ el color de los halógenos en fase gaseosa se puede explicar a partir de la TOM, el desplazamiento del máximo de absorción hacia longitudes de onda mayores refleja la disminución de la diferencia de energía entre el HOMO y el LUMO al descender en el grupo: ➢ los puntos de fusión, ebullición, los radios atómicos e iónicos aumentan al descender en el grupo. ➢ el F2 es el no metal más reactivo y el agente oxidante más fuerte, la rapidez de las reacciones se debe en parte al débil enlace F-F. ➢ la mayoría de los elementos reaccionan directamente con el cloro, el bromo y el iodo, aunque en algunos casos las reacciones deban ser activadas por calor o luz UV. ➢ reaccionan con el agua, el flúor produciendo oxígeno: Química Inorgánica Grupo 17 3 F2 + 2 H2O → 2 HF + 1/2 O2 X2 + H2O → HXO (ac) + HX (ac) Compuestos ➢ con oxígeno: OF2 y O2F2 (dado que el F es más electronegativo que el O no existen óxidos de flúor). ➢ el único oxácido del F, HOF, es inestable a temperatura ambiente ➢ óxidos de cloro: Cl2O (gas color café amarillento), Cl2O3 (sólido café oscuro), ClO2 (gas amarillo), Cl2O6 (líquido rojizo), Cl2O7 (líquido incoloro). El dióxido de cloro es el único que se produce a gran escala, para blanqueo de pulpa de papel y desinfección de agua, se puede descomponer en forma explosiva. ➢ óxidos de bromo: Br2O (sólido color café), Br2O3 (sólido naranja), BrO2 (sólido amarillo),son térmicamente inestables y explotan por calentamiento. ➢ óxidos de iodo: el más estable es I2O5 (sólido blanco), I2O4 y I4O9 (sólidos amarillos) se descomponen por calentamiento. ➢ cloro, bromo e iodo forman varios oxácidos, por ejemplo: HOCl, HOClO, HOClO 2 y HOClO3, (cuya acidez aumenta con el número de oxidación del cloro), H5IO6 (ácido periódico). ➢ forman oxoaniones (agentes oxidantes fuertes, algunos sufren desproporción), los percloratos son inestables y pueden explotar. Para el cloro, hipoclorito, clorito, clorato y perclorato: El poder oxidante de los oxoaniones aumenta con la acidez del medio ➢ los pseudohalógenos (y pseudohalogenuros) son compuestos con propiedades semejantes a los halógenos, por ejemplo el cianógeno (CN)2, CN-, SCN-, N3-. ➢ los interhalógenos son compuestos entre los halógenos mismos con fórmulas XY, XY 3, XY5, XY7, por ejemplo ClF3, usado como agente fluorante. ➢ los fluorocarbonos y clorofluorocarbonos (CFC) son compuestos estables de importancia tecnológica (teflón, freones). Destrucción de la capa de ozono En la estratosfera: O2 + hν <240nm → 2 O O + O2 → O3 O3 + hν <310nm → O + O2 Química Inorgánica Grupo 17 4 Perturbaciones: ✔ aviones supersónicos: NO, NO2 ✔ freones: CFCl3, CF2Cl2 resultado: O3 + O → 2 O Espesor de la capa de ozono = Unidades Dobson (UD) 1 mm = 100 UD (0°C y 1 atm) ➢ Polo sur: 120-130 UD ➢ Trópicos: 250 UD catálisis heterogénea NO2 + ClO → ClONO2 HCl → hielo Cl2 ↓ hν Cl