CIENCIAS 7°
Anuncio

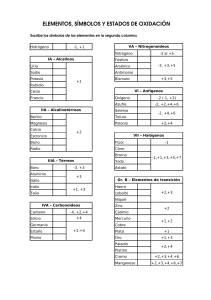
Subdirección de Educación Departamento de Educación Contratada Colegio CAFAM SANTA LUCÍA Fecha: OCT 2014 IV PERÍODO Saber - Saber:Comprender el concepto de configuración electrónica teniendo en cuenta la tabla períodica Saber-Hacer: Saber-Ser: Docente: NIDYA RODRÍGUEZ 1. Pensamiento:Científico tecnológico Completa las características de las diferentes etapas en la historia de la química Edad antigua Alquimia Latroquimia Flogisto 2. 3. Utilizando un mapa conceptual, explique la historia del átomo desde Dalton hasta el modelo actual. A. Señale cuales son los nivel, subniveles y electrones en la configuración electrónica. a. Realizar la configuración electrónica de los siguientes elementos Azufre, Magnesio, Bromo con la representación del modelo atómico de Bohr 4.Si nos pidieran calcular en el laboratorio la densidad de un trozo de metal (de forma irregular), sin deformarlo, ¿cuál sería un procedimiento?. Si hay necesidad, inventar los datos. Responda y justifique las preguntas 5 y 6, según el esquema que representa parte de la información que contiene la tabla periódica.J 5. Si se tiene en cuenta que los elementos que quedan ubicados en un mismo grupo presentan propiedades químicas semejantes, es válido afirmar que forman parte de un grupo los siguientes elementos A. B, C y N B. N, S y Br C. Be, Mg y Ca D. Li, Na y Be Justificación: ______________________________________ ______________________________________ ______________________________________ 6.. Forma parte de un nivel los siguientes elementos: A. Li, Be, B,C, N, O, F, Ne B. Na, Ca, Si, P C. B. N, S y Br D. C. Be, Mg y Ca Justificación: ______________________________________ ______________________________________ ______________________________________ RESPONDA LAS PREGUNTAS 7 A LA 9 SEGÚN LA SIGUIENTE INFORMACIÒN Y JUSTIFICQUE Para profundizar los conocimientos sobre la constitución de la materia es necesario investigar sus propiedades. Ciertas características bastantes nítidas permiten orientar este estudio. Es posible medir el calor, la conductividad eléctrica la dureza, la densidad, etc. Puede también estudiarse desde otro punto de vista: sabiendo que está compuesta de átomos, se averiguan algunas propiedades fundamentales de estas partículas y luego se imagina como pueden estar ligadas y que características presentan al ser reunidas. Así, el conocimiento de la estructura íntima de los cuerpos se logra a través del análisis de modelos imaginados teóricamente, a partir de los cuales se puede deducir las propiedades que el cuerpo debe presentar. Esta es la única manera de penetrar en el mundo de los átomos y de las moléculas porque con ningún microscopio se puede observar la estructura molecular de un gas y ningún tipo de de experimento permite tomar un átomo con las manos para someterlo a mediciones directas. A partir de la medida de las propiedades macroscópicas de los cuerpos y a través de la comparación de los resultados obtenidos con los previstos teóricamente para los distintos modelos , avanza el concepto de la estructura de la materia, eliminado modelos equivocados o insuficientes y remplazándolos por unos más perfeccionados que incluyen propiedades cada vez mas semejantes a las de los cuerpos reales.. El caso más simple de este estudio corresponde a los gases, porque es más fácil determinar las propiedades de la materia en ese estado que en el líquido, por lo menos por vías teóricas. Además algunas propiedades presentadas por pequeños grupos de átomos y moléculas permiten intuir las propiedades que deben manifestar grupos más numerosos de estas partículas. Los resultados de estos de este método que busca interpretar las propiedades macroscópicas a partir del comportamiento de sus componentes microscópicos – se tradujeron en formulas establecidas y reunida en la teoría cinética de los gases. Inicialmente, esa teoría fue creada para interpretar las propiedades de los gases; luego a medida que se fue acumulando información, se le generalizo de forma tal que se pudiera aplicar tanto a los líquidos como a los sólidos también. 7. El título del artículo puede ser: A. estructura de la materia. B. Profundización de la ciencia. C. Propiedades de la materia D. Los modelos atómicos. Justificación: __________________________________________________________________________________ __________________________________________________________________________________ 8. Por el método de estudio de la materia se puede clasificar como: A. Netamente teórico B. Teórico- practico C. Inductivo D. Científico. Justificación: __________________________________________________________________________________ __________________________________________________________________________________ 9. Una forma de profundizar en el conocimiento de la materia: A. Analizar modelos imaginados teóricamente. B. Realizar observaciones microscópicas. C. Seguir los pasos del método científico. D. Comprobar la teoría a través de la práctica. Justificación: __________________________________________________________________________________ __________________________________________________________________________________ 10. Andrés llena cuatro vasos iguales con la misma cantidad de agua, como se muestra en el siguiente dibujo. En cada uno de ellos mete un objeto que se hunde hasta el fondo y observa lo siguiente: La profesora le pregunta a Andrés si los datos que tiene son suficientes para determinar cuál es el objeto con mayor densidad. A esta pregunta Andrés responde: A. Sí, porque el objeto que desplaza mayor cantidad de agua tiene mayor densidad. B. No, porque para calcular la densidad es necesario conocer la masa de los objetos. C. Sí, porque el volumen y el tamaño sirven para determinar la densidad de los objetos. D. No, porque el objeto que tiene mayor tamaño es el que presenta mayor densidad. Justificación: ________________________________________________________________________ ________________________________________________________________________ ________________________________________________________________________ 11. Indique cuales son los elementos pertenecientes a los halógenos en la tabla periódica A. Flúor, cloro Neón, bromo y yodo B. Flúor, cloro, argón, xenón y astato C. Flúor, cloro, bromo, astato y yodo D. Flúor, cloro, boro, yodo y astato Justificación: ________________________________________________________________________ ________________________________________________________________________