isótopos. cationes. aniones. radicales libres - q
Anuncio

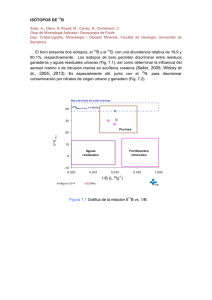
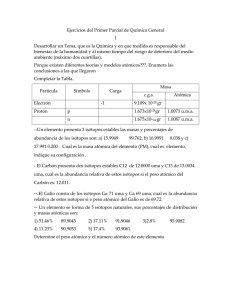
Integrantes: Chávez Alexis Comisso Douglas ISÓTOPOS. CATIONES. ANIONES. RADICALES LIBRES TEMA 1 1.- Definición y características de cationes y aniones: Catión.- Un catión es un ion (sea átomo o molécula) con carga eléctrica positiva, es decir, ha perdido electrones. Los cationes se describen con un estado de oxidación positivo. Anión.- Un anión es un ion con carga eléctrica negativa, es decir, que ha ganado electrones. Los aniones se describen con un estado de oxidación negativo. 2.- Métodos para obtener cationes y aniones de carbono: Grupos atractores favorecen la formación de carbocationes; así la ionización de halogenuros de alquilo, y reacciones de sustitución electrofílica son unos de varios métodos. Por otro lado la formación de carbaniones es más complicada por la estabilidad de los mismos, la desprotonación de un carbono con una base de Brönsted es el camino más utilizado. 3.- Estabilidad de cationes. Factores que influyen en la estabilidad. La estabilidad de los carbocationes se incrementa con el número de grupos alquilo unidos al átomo de carbono que lleva la carga. Los carbocationes terciarios son más estables (y se forman más rápidamente) que los carbocationes secundarios; los carbocationes primarios son altamente inestable porque, mientras los carbocationes de orden mayor están estabilizados por hiperconjugación y por impedimento estérico, los carbocationes primarios no lo están. En consecuencia, reacciones como la reacción SN1 y la reacción de eliminación E1 normalmente no ocurren si involucrasen a un carbocatión primario. t 4.- Posibles usos. Cationes: Sodio.- La regulación de la presión osmótica celular, Transmisión del impulso nervioso Potasio.- Contracción muscular, Activación enzimática (cofactor enzimático). Calcio.- Constitución del tejido óseo, dientes y sistema nervioso, Coagulación sanguínea Magnesio.- Activación enzimática, Desarrollo óseo. Aniones: Fósforo.- Sus aniones intracelulares más importantes son H2PO4-,HPO42-, PO43- participan en: El desarrollo óseo y de los dientes, Reacciones de transferencia de energía (ATP fosfocreatina), Constitución de núcleotidos, fosfolipidos y otras sustancias Azufre.Sus aniones (SO42-,S2-)integran: moléculas orgánicas diversas(polisacáridos complejos, aminoácidos, etc.), constituyen uñas y cabello TEMA 2. 1.-Definición y características de los isótopos: Se denominan isótopos (del griego: ἴσος, isos = mismo; τόπος, tópos = lugar) a los átomos de un mismo elemento, cuyos núcleos tienen cantidad diferente de neutrones, y por lo tanto, difieren en masa. La mayoría de los elementos químicos poseen más de un isótopo. Solamente 21 elementos (ejemplos: berilio, sodio) poseen un solo isótopo natural; en contraste, el estaño es el elemento con más isótopos estables. Otros elementos tienen isótopos naturales, pero inestables, como el Uranio, cuyos isótopos están constantemente en decaimiento, lo que los hace radiactivos. 2.-Principales isótopos de C, H, O, N, S y X. Métodos para obtener isótopos y abundancia relativa. Estabilidad de los isótopos. Factores que influyen en la estabilidad. Posibles usos. CARBONO: En 1961 la IUPAC adoptó el isótopo 12C como la base para la masa atómica de los elementos químicos. El carbono-14 es un radioisótopo con un periodo de semidesintegración de 5730 años que se emplea de forma extensiva en la datación de especímenes orgánicos. Los isótopos naturales y estables del carbono son el 12C (98,89%) y el 13C (1,11%). Las proporciones de estos isótopos en un ser vivo se expresan en variación (±‰) respecto de la referencia VPDB (Vienna Pee Dee Belemnite, fósiles cretácicos de belemnites, en Carolina del Sur). El δC-13 del CO2 de la atmósfera terrestre es −7‰. El carbono fijado por fotosíntesis en los tejidos de las plantas es significativamente más pobre en 13C que el CO2 de la atmósfera. La mayoría de las plantas presentan valores de δC-13 entre −24 y −34‰. Otras plantas acuáticas, de desierto, de marismas saladas y hierbas tropicales, presentan valores de δC-13 entre −6 y −19‰ debido a diferencias en la reacción de fotosíntesis. Un tercer grupo intermedio constituido por las algas y líquenes presentan valores entre −12 y −23‰. El estudio comparativo de los valores de δC-13 en plantas y organismos puede proporcionar información valiosa relativa a la cadena alimenticia de los seres vivos. HIDRÓGENO: El hidrógeno posee tres isótopos naturales que se denotan como 1H, 2H y 3H. Otros isótopos altamente inestables (del 4H al 7H) han sido sintetizados en laboratorio, pero nunca observados en la naturaleza. 1H, conocido como protio, es el isótopo más común del hidrógeno con una abundancia de más del 99,98%. Debido a que el núcleo de este isótopo está formado por un solo protón se le ha bautizado como protio, nombre que a pesar de ser muy descriptivo, es poco usado. 2H, el otro isótopo estable del hidrógeno, es conocido como deuterio y su núcleo contiene un protón y un neutrón. El deuterio representa el 0,0026% o el 0,0184% (según sea en fracción molar o fracción atómica) del hidrógeno presente en la Tierra, encontrándose las menores concentraciones en el hidrógeno gaseoso, y las mayores (0,015% o 150 ppm) en aguas oceánicas. El deuterio no es radiactivo, y no representa un riesgo significativo de toxicidad. El agua enriquecida en moléculas que incluyen deuterio en lugar de hidrógeno 1H (protio), se denomina agua pesada. El deuterio y sus compuestos se emplean en marcado no radiactivo en experimentos y también en disolventes usados en espectroscopia 1H - RMN. El agua pesada se utiliza como moderador de neutrones y refrigerante en reactores nucleares. El deuterio es también un potencial combustible para la fusión nuclear con fines comerciales. 3H se conoce como tritio y contiene un protón y dos neutrones en su núcleo. Es radiactivo, desintegrándose en 32He+ a través de una emisión beta. Posee un periodo de semidesintegración de 12,33 años.[7] Pequeñas cantidades de tritio se encuentran en la naturaleza por efecto de la interacción de los rayos cósmicos con los gases atmosféricos. También ha sido liberado tritio por la realización de pruebas de armamento nuclear. El tritio se usa en reacciones de fusión nuclear, como trazador en Geoquímica Isotópica, y en dispositivos luminosos auto - alimentados. Antes era común emplear el tritio como radiomarcador en experimentos químicos y biológicos, pero actualmente se usa menos. El hidrógeno es el único elemento que posee diferentes nombres comunes para cada uno de sus isótopos (naturales). Durante los inicios de los estudios sobre la radiactividad, a algunos isótopos radiactivos pesados les fueron asignados nombres, pero ninguno de ellos se sigue usando). Los símbolos D y T (en lugar de 2H y 3H) se usan a veces para referirse al deuterio y al tritio, pero el símbolo P corresponde al fósforo y, por tanto, no puede usarse para representar al protio. La IUPAC declara que aunque el uso de estos símbolos sea común, no es lo aconsejado. OXÍGENO: El oxígeno tiene tres isótopos estables y diez radioactivos. Todos sus isótopos radioactivos tienen un periodo de semidesintegración de menos de tres minutos. NITRÓGENO: Existen dos isótopos estables del nitrógeno, N-14 y N-15, siendo el primero — que se produce en el ciclo carbono-nitrógeno de las estrellas— el más común sin lugar a dudas (99,634%). De los diez isótopos que se han sintetizado, uno tiene un periodo de semidesintegración de nueve minutos (el N-13), y el resto de segundos o menos. Las reacciones biológicas de nitrificación y desnitrificación influyen de manera determinante en la dinámica del nitrógeno en el suelo, casi siempre produciendo un enriquecimiento en N-15 del sustrato. AZUFRE: Se conocen 18 isótopos del azufre, cuatro de los cuales son estables: S-32 (95,02%), S-33 (0,75%), S-34 (4,21%) y S-36 (0,02%). Aparte del S-35, formado al incidir la radiación cósmica sobre el argón-40 atmosférico y que tiene un periodo de semidesintegración de 87 días, los demás isótopos radiactivos son de vida corta. HALÓGENOS: FLUOR El flúor tiene un único isótopo natural, el 19F. El 18F es un isótopo artificial. Este isótopo tiene un número cuántico de espín nuclear de 1/2 y se puede emplear en espectroscopía de resonancia magnética nuclear. Se suele emplear como compuesto de referencia el triclorofluorometano, CFCl3 o el trifluoroacetico TFA. CLORO En la naturaleza se encuentran dos isótopos estables de cloro. Uno de masa 35 uma, y el otro de 37 uma, con unas proporciones relativas de 3:1 respectivamente, lo que da un peso atómico para el cloro de 35,5 uma. El cloro tiene 9 isótopos con masas desde 32 uma hasta 40 uma. Sólo tres de éstos se encuentran en la naturaleza: el 35Cl, estable y con una abundancia del 75,77%, el 37Cl, también estable y con una abundancia del 24,23%, y el isótopo radiactivo 36Cl. La relación de 36Cl con el Cl estable en el ambiente es de aproximadamente 700 × 10–15:1. El 36Cl se produce en la atmósfera a partir del 36Ar por interacciones con protones de rayos cósmicos. En el subsuelo se genera 36Cl principalmente mediante procesos de captura de neutrones del 35Cl, o por captura de muones del 40Ca. El 36Cl decae a 36S y a 36Ar, con un periodo de semidesintegración combinado de 308000 años. El período de semidesintegración de este isótopo hidrofílico y no reactivó lo hace útil para la datación geológica en el rango de 60000 a 1 millón de años. Además, se produjeron grandes cantidades de 36Cl por la irradiación de agua de mar durante las detonaciones atmosféricas de armas nucleares entre 1952 y 1958. El tiempo de residencia del 36Cl en la atmósfera es de aproximadamente 1 semana. Así pues, es un marcador para las aguas superficiales y subterráneas de los años 1950, y también es útil para la datación de aguas que tengan menos de 50 años. El 36Cl se ha empleado en otras áreas de las ciencias geológicas, incluyendo la datación de hielo y sedimentos.ya que es una sustancia venenosa BROMO En la naturaleza se encuentran dos isótopos: 79Br y 81Br, los dos con una abundancia de cerca del 50%. YODO Hay 37 isótopos de yodo, pero sólo el I-127 es estable. El radioisótopo artificial yodo-131 (un emisor beta y gamma) con un periodo de semidesintegración de 8 días se ha empleado en el tratamiento de cáncer y otras patologías de la glándula tiroidea. El yodo-129 (con un periodo de semidesintegración de unos 16 millones de años) se puede producir a partir del xenón-129 en la atmósfera terrestre, o también a través del decaimiento del uranio-238. Como el uranio238 se produce durante cierto número de actividades relacionadas con la energía nuclear, su presencia (la relación 129I/I) puede indicar el tipo de actividad desarrollada en un determinado lugar. Por esta razón, el yodo-129 se empleó en los estudios de agua de lluvia en el seguimiento del accidente de Chernóbil. También se ha empleado como trazador en el agua superficial y como indicador de la dispersión de residuos en el medio ambiente. Otras aplicaciones pueden estar impedidas por la producción de yodo-129 en la litosfera a través de un número de mecanismos de decaimiento. En muchos aspectos el yodo-129 es similar al cloro-36. Es un halógeno soluble, relativamente no reactivo, existe principalmente como anión no solvatado, y se produce por reacciones in situ termonucleares y cosmogénicas. En estudios hidrológicos, las concentraciones de yodo-129 se dan generalmente como la relación de yodo-129 frente al yodo total (prácticamente todo yodo-127). Como en el caso de la relación 36Cl/Cl, las relaciones 129I/I en la naturaleza son bastante pequeñas, 10-14 a 10-10 (el pico termonuclear de 129I/I durante las décadas 1960 y 1970 alcanzó unos valores de 10-7). El yodo-129 se diferencia del cloro-36 en que su periodo de semidesintegración es mayor (16 frente a 0,3 millones de años), es altamente biofílico y se encuentra en múltiples formas iónicas (generalmente I- y yodatos) que tienen distinto comportamiento químico. TEMA 3. 1.-Definición y características de los radicales libres Un radical es una especie química (orgánica o inorgánica), en general extremadamente inestable y, por tanto, con gran poder reactivo por poseer un electrón desapareado.[1] No se debe confundir con un grupo sustituyente, como un grupo alquilo, que son partes de una molécula, sin existencia aislada. Poseen existencia independiente aunque tengan vidas medias muy breves, por lo que se pueden sintetizar en el laboratorio, se pueden formar en la atmósfera por radiación, y también se forman en los organismos vivos (incluido el cuerpo humano) por el contacto con el oxígeno y actúan alterando las membranas celulares y atacando el material genético de las células, como el ADN 2.-Métodos para obtener radicales libres de carbono. El proceso para la obtención de radicales libres del carbono es provocar una ruptura homolítica (homopolar), provocada por termólisis o fotólisis. 3.-Estabilidad de los radicales libres. Factores que influyen en la estabilidad. Los radicales libres poseen una reactividad mayor a cualquier especie del carbono, la estabilidad sigue el siguiente orden Carbono Terciario secundario primario metilico 4.-Posibles usos. Reacciones adversa de los radicales libres Los radicales se producen en la respiración con la presencia de oxígeno que aunque es imprescindible para la vida celular de nuestro organismo, también induce la formación de éstas moléculas reactivas, que provocan a lo largo de la vida efectos negativos para la salud debido a su capacidad de alterar el ADN (los genes), las proteínas y los lípidos o grasas ("oxidación"). En nuestro cuerpo existen células que se renuevan continuamente como las células de la piel, del intestino, y el hígado, y otras sin capacidad de renovación como las neuronas. En el transcurso de los años, los radicales libres pueden producir una alteración genética sobre las células que se dividen continuamente contribuyendo a aumentar el riesgo de cáncer por mutaciones genéticas o bien, disminuyen la funcionalidad de las células que no se dividen tanto, disminuyendo el número de mitocondrias, que es característico del envejecimiento. Las situaciones que aumentan la producción de radicales libres son: La contaminación ambiental. El tabaquismo. Las dietas ricas en grasas. Exposición excesiva a las radiaciones solares. La ingesta de aceites "vegetales" que fueron refinados, ya que estos contienen radicales libres al ser sometidos a altas temperaturas. El estrés. Bibliografía http://es.wikipedia.org/wiki/Yodo http://es.wikipedia.org/wiki/Bromo#Is.C3.B3topos http://es.wikipedia.org/wiki/Cloro#Is.C3.B3topos http://es.wikipedia.org/wiki/Fluor#Is.C3.B3topos http://es.wikipedia.org/wiki/Cati%C3%B3n