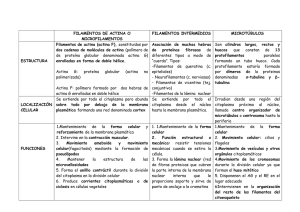
1. epitelio
Anuncio

PARTE I I TEJIDOS BÁSICOS Y BIOLOGÍA CELULAR INTEGRADA 1. EPITELIO Clasificación general de los epitelios Cuadro 1-A | Principales características de los epitelios El epitelio es una lámina muy cohesiva que recubre o tapiza las superfi cies corporales (p. ej., piel, intestino, conductos secretores) y configura las unidades funcionales de las glándulas secretoras (p. ej., glándulas salivales, hígado). La clasificación y la nomenclatura tradicionales de los distintos tipos de epitelios se basan en la morfología de las células que los integran y en su disposición en una o más capas (fig. 1-1 ).El cuadro 1-A resume las principales características de los distintos tipos de epitelios. Los epitelios se clasifi can en: 1. Epitelios simples (fig. 1-2), formados por una sola capa de células. S e subdividen en escamoso simple, cúbico simple y cilíndrico simple según la altura y la anchura de las células. E l término específi co endotelio se aplica al epitelio simple que tapiza los v asos sanguíneos y linfáticos. E l mesotelio es el epitelio simple que reviste todas las cavidades corporales (peritoneo, pericar dio y pleura). 2. Epitelios estratificados (fig. 1-3), compuestos por dos o más capas celular es. Este tipo de epitelios se subdividen en función de la mor fología de las células en la capa superficial o externa en escamoso estratificado, cúbico estratifi cado y cilíndrico estratificado. El epitelio escamoso estratifi cado es el subtipo más fr ecuente y se subdivide en moderadamente queratinizado (también llamado no queratinizado) y muy queratinizado. Las células de la capa externa de un epitelio escamoso moderadamente queratinizado son nucleadas (p. ej., en el esófago o la v agina). Las células de la capa externa del epitelio escamoso muy queratinizado car ecen de núcleo (p. ej., epidermis de la piel). Las células basales alineadas a lo largo de la lámina basal poseen actividad mitótica y sustituy en a las células en pr oceso de diferenciación de las capas superior es. • Los epitelios provienen del ectodermo, del mesodermo y del endodermo. • Los epitelios revisten y recubren todas las superficies corporales, excepto el cartílago articular, el esmalte dental y la superficie anterior del iris. • Las funciones básicas de los epitelios son la protección (piel), la absorción (intestinos delgado y grueso), el transporte de material en la superficie (realizado por los cilios), la secreción (glándulas), la excreción (túbulos renales), el intercambio gaseoso (alvéolos pulmonares) y el deslizamiento entre las superficies (mesotelio). • La mayoría de las células epiteliales se renuevan continuamente mediante mitosis. • Los epitelios carecen de irrigación sanguínea y linfática directa. Obtienen los nutrientes por difusión. • Las células epiteliales carecen casi por completo de moléculas intercelulares libres (a diferencia del tejido conjuntivo). • Las moléculas de adhesión celular y los complejos de unión mantienen la cohesividad del epitelio. • Los epitelios se anclan a la lámina basal. Esta y los componentes del tejido conjuntivo colaboran para formar la membrana basal. • Los epitelios presentan polaridad estructural y funcional. Figura 1-1. Mapa conceptual: tipos de epitelios Epitelios Morfología de las células individuales (vista lateral) Célula escamosa (aplanada) Célula cúbica (dimensiones equivalentes) Célula cilíndrica (más alta que ancha) Categorías especiales Disposición de las células (una o más capas) Epitelio seudoestratificado Epitelio transicional (urotelio) Más de una capa Una capa Epitelio estratificado Epitelio simple Endotelio Epitelio escamoso simple Epitelio cúbico simple Epitelio cilíndrico simple Epitelio escamoso estratificado Epitelio cúbico estratificado Epitelio cilíndrico estratificado Mesotelio Su designación obedece a la morfología de las células de la capa superficial © 2012. Elsevier España, S.L. Reservados todos los derechos C0005.indd 1 | 1 3/5/12 10:48:47 AM Figura 1-2. Epitelio simple Eritrocitos en la luz Lámina basal Núcleo aplanado de una célula endotelial Luz Epitelio escamoso simple Epitelio escamoso simple (endotelio) El revestimiento interno de los vasos sanguíneos se compone de una sola capa de células endoteliales escamosas. La delgadez de las células epiteliales escamosas simples refleja su función primaria en el intercambio rápido de moléculas entre la sangre y los tejidos. El peritoneo, la pleura y el pericardio están recubiertos por un epitelio similar (mesotelio). Lámina basal Luz Luz Luz Epitelio cúbico simple Epitelio cúbico simple (túbulo colector, riñones) El revestimiento interno de los túbulos renales y los folículos tiroideos está formado por una sola capa de células cilíndricas. Estas células están muy polarizadas e intervienen en la absorción, la secreción (glándula tiroidea) y el transporte activo de iones (riñones). De manera similar al endotelio, la célula se une al tejido conjuntivo subyacente a través de la lámina basal. Borde en cepillo Lámina basal Célula caliciforme Lámina propia Luz Epitelio cilíndrico simple Epitelio cilíndrico simple (intestino delgado) El intestino delgado está revestido por células epiteliales cilíndricas cuyo núcleo se localiza en la porción interna de la célula. El dominio apical contiene proyecciones digitiformes denominadas microvellosidades que configuran un borde en cepillo. Las microvellosidades intervienen en la absorción de proteínas, hidratos de carbono y lípidos, los cuales se liberan en el dominio basolateral hacia la sangre para su transporte hasta el hígado. 2 C0005.indd 2 | Célula caliciforme Borde en cepillo Las células caliciformes se entremezclan con las células epiteliales cilíndricas. Se distinguen por el citoplasma apical dilatado de forma similar a un cáliz que contiene material mucoso de tinción leve. La mucosidad se libera a la luz para recubrir la superficie de las células epiteliales. Se indica la localización de la lámina propia. Histología y biología celular. Introducción a la anatomía patológica 3/5/12 10:48:47 AM Figura 1-3. Epitelio estratificado Células escamosas superficiales nucleadas Aparecen núcleos en las células más superficiales Lámina basal Célula basal mitótica Lámina basal Epitelio escamoso estratificado con queratinización moderada (esófago) El epitelio se compone de células basales indiferenciadas especializadas en la división mitótica. Las células estratificadas que recubren la capa basal son células en diferenciación. Las células pertenecientes a la capa externa están muy diferenciadas: presentan un contenido mayor en queratina con el fin de proteger el tejido de la acción mecánica de los alimentos ingeridos. Las células más externas conservan los núcleos. Este epitelio se conoce también como no queratinizado. Las células muy queratinizadas de la capa superficial carecen de núcleos No aparecen núcleos en las células superficiales Lámina basal Célula basal Lámina basal © Elsevier. Fotocopiar sin autorización es un delito . Epitelio escamoso estratificado con queratina abundante (epidermis) Este epitelio muy queratinizado está formado por células basales indiferenciadas especializadas en la división mitótica. Las células estratificadas que recubren la capa basal son células en diferenciación. Las células de la capa superficial contienen gran cantidad de queratina con el objeto de evitar tanto las pérdidas hídricas como las agresiones químicas y físicas. Las células más externas son anucleadas. Este epitelio también recibe el nombre de epitelio queratinizado. 3. Dos subtipos especiales son el epitelio seudoestratificado y el epitelio transicional (fig. 1-4). El primero se compone de células basales y cilíndricas situadas sobre la lámina basal. No obstante, sólo las células cilíndricas alcanzan la superfi cie luminal. Los núcleos de ambos tipos celular es se hallan a distintos niv eles, por lo que el epitelio par ece presentar una organización estratifi cada. A este subtipo pertenecen el epitelio cilíndrico seudoestratificado ciliado de la tráquea y el epitelio cilíndrico seudoestratificado con estereocilios del epidídimo. El epitelio transicional de las vías urinarias se conoce, asimismo, como urotelio. Este epitelio también está formado por células basales y cilíndricas cupuliformes. Una característica importante de este epitelio es que su altura v aría en función de la distensión y la contracción del órgano (v. capítulo 14, «Aparato urinario»). La polaridad constituye un rasgo destacado de los epitelios. La may oría de las células epiteliales tapizan super ficies y cavidades, y poseen tr es dominios (fig. 1-5 ): 1. EPITELIO C0005.indd 3 | 3 3/5/12 10:48:48 AM Figura 1-4. Epitelios seudoestratificado y transicionales Célula caliciforme Célula caliciforme Célula cilíndrica ciliada Célula cilíndrica ciliada Célula basal Célula basal Epitelio cilíndrico seudoestratificado ciliado (tráquea) Este epitelio consta de tres tipos principales de células: 1) células cilíndricas con cilios en su dominio apical; 2) células basales unidas a la lámina basal, Lámina basal y 3) células caliciformes, unas células epiteliales que secretan mucosidad. Las células cilíndricas ciliadas y las caliciformes se unen a la lámina basal y alcanzan la luz. Las células basales no llegan a la luz. Grupo de estereocilios Espermatozoide Célula basal Célula cilíndrica con estereocilios Región del aparato de Golgi Célula cilíndrica con estereocilios Célula basal Espermatozoide Epitelio cilíndrico seudoestratificado con estereocilios (epidídimo) El epitelio del epidídimo contiene dos tipos celulares principales: 1) células cilíndricas dotadas de estereocilios y un aparato de Golgi prominente (llamadas células principales), y 2) células basales unidas a la lámina basal. Las células principales y basales se asocian a la lámina basal. Tan sólo las células principales alcanzan la luz. Se pueden visualizar espermatozoides en la luz. Placas Célula cilíndrica cupuliforme Célula cilíndrica cupuliforme Placas Célula basal Urotelio de una vejiga urinaria vacía Urotelio de una vejiga urinaria llena de orina Epitelio transicional (vejiga urinaria) El epitelio transicional que tapiza las vías urinarias (también llamado urotelio) está integrado por dos tipos celulares: 1) células cilíndricas cupuliformes, que se extienden desde la lámina basal hasta la luz, y 2) células basales, unidas a la lámina basal. En algunas especies, el urotelio corresponde a un epitelio seudoestratificado, mientras que en 4 C0005.indd 4 | Célula basal Placas otra representa un epitelio escamoso estratificado. El urotelio se caracteriza por la respuesta de las células superficiales a las fuerzas de tensión —provocadas por la orina— mediante cambios de la geometría y de la configuración cupuliforme de su superficie. En la membrana plasmática apical de las células cilíndricas se localizan placas de proteínas agregadas. Histología y biología celular. Introducción a la anatomía patológica 3/5/12 10:48:49 AM 1. El dominio apical está expuesto a la luz del conducto revestido por el epitelio o al ambiente externo. 2. El dominio lateral está en contacto con las células epiteliales adyacentes, las cuales se unen por medio de moléculas de adhesión celular y complejos de unión. 3. El dominio basal se asocia a una lámina basal que separa el endotelio del tejido conjuntivo subyacente. La lámina basal se refuerza mediante elementos de tejido conjuntivo. El complejo formado por la lámina basal y el tejido conjuntiv o recibe el nombre de membrana basal. Las células epiteliales se unen entre sí por medio de complejos de unión y moléculas de adhesión. Estas células se especializan para llev ar a cabo funciones impor tantes, como la absorción y la secr eción, o bien para actuar como barr era frente al paso de agua o gas. Se tratarán algunas barreras celulares y su relevancia funcional. POLARIDAD DE LAS CÉLULAS EPITELIALES Las células epiteliales poseen dos dominios principales ( fig. 1-5): 1. Un dominio apical 2. Un dominio basolateral Cada dominio presenta unas características estr ucturales y funcionales específi cas. Por ejemplo, el dominio apical posee estr ucturas que confi eren protección a la superficie epitelial (como los cilios de las vías r espiratorias) o inter vienen en la absorción de moléculas (como las microvellosidades del epitelio intestinal). La presencia de complejos de unión y de las moléculas de adhesión celular en el dominio basolateral hace posible el anclaje de unas células epiteliales a otras y a la membrana basal. Diferenciaciones apicales En el dominio apical de algunas células epiteliales pueden apar ecer tres tipos de diferenciaciones: 1. Cilios 2. Microvellosidades 3. Estereocilios Los cilios (fig. 1-6) son pr oyecciones celulares móviles que pr ovienen de los cuerpos basales anclados por medio de raicillas a la por ción apical del citoplasma. Cada cuerpo basal posee nuev e tripletes de microtúbulos en disposición helicoidal sin microtúbulos centrales. Por el contrario, el cilio se compone de una estr uctura denominada axonema, formado por un par central de micr otúbulos rodeado de nuevo pares de microtúbulos organizados de manera concéntrica. Esta disposición se conoce como disposición 9+ 2 dobletes de microtúbulos. Asimismo, el axonema forma parte de la cola de los espermatoz oides o flagelo. Figura 1-5. Dominios de una célula epitelial polarizada © Elsevier. Fotocopiar sin autorización es un delito . Unión hermética Luz Diferenciaciones del dominio apical (cilios, microvellosidades o estereocilios) Microvellosidades Dominio apical Luz Núcleo Dominio basolateral Membrana basal 1. EPITELIO C0005.indd 5 | 5 3/5/12 10:48:51 AM Figura 1-6. Diferenciaciones apicales de las células epiteliales: cilios y cilio primario Cilio: un eje con dobletes de microtúbulos en una disposición concéntrica 9 + 2 rodeada de la membrana plasmática Membrana plasmática Cilio Cuerpo basal anclado al citoplasma por las raicillas estriadas 0,25 μm Microtúbulos Cilio Cuerpo basal Cuerpo basal Los centríolos del centrosoma dan lugar a los cuerpos basales; los cuerpos basales pueden formar centríolos 0,2 μm Raicilla Raicillas estriadas Oviducto Centro organizador de microtúbulos Lámina basal Anterógrado Motor de cinesina Proteínas IFT Proteínas IFT Motor de dineína Retrógrado Cilio Cilio primario Un cilio primario solitario se proyecta desde la superficie celular. Las alteraciones de este cilio, incluido el cuerpo basal, se han asociado a ciliopatías, que engloban trastornos humanos, como los riñones quísticos, la obesidad, el retraso mental, la ceguera y diversas anomalías congénitas. Cuerpo basal Componentes proteicos del BBSoma (síndrome de Bardet-Biedl) Los cilios se forman a partir de los cuerpos basales localizados en el dominio apical del citoplasma. Los cuerpos basales provienen de los centríolos y presentan una subestructura semejante a ellos: nueve tripletes de microtúbulos periféricos en disposición helicoidal. El cuerpo basal se ancla al citoplasma a través de las raicillas. Los cuerpos basales y los centríolos carecen de microtúbulos centrales. Los centríolos, no así los cuerpos basales, están rodeados por un material denso denominado centro organizador de los microtúbulos. El cilio está compuesto por una estructura concéntrica con nueve dobletes de microtúbulos que rodean un par central de microtúbulos (organización 9 + 2). Ensamblaje del cilio La formación y el mantenimiento del cilio dependen del transporte de tubulinas a lo largo del axonema por mediación de las proteínas del sistema de transporte intraflagelar (IFT). Las proteínas motoras de cinesina que movilizan los complejos proteicos IFT se encargan del transporte de IFT desde la base del cilio hasta el extremo (transporte anterógrado; hacia el extremo positivo del microtúbulo). Los motores de dineína intervienen en el transporte retrógrado (hacia el extremo negativo del microtúbulo; base del cilio). Las proteínas IFT crean una plataforma de transporte de moléculas desde la base hacia el extremo del cilio. La alteración del motor de cinesina o de las proteínas IFT impide la formación de los cilios. Las proteínas de los cuerpos basales influyen en el tráfico ciliar. Entre ellas se encuentran los componentes del BBSoma, así llamados por su asociación con el síndrome de Bardet-Biedl (BBS). Las proteínas BBSoma pueden ayudar a cargar las moléculas a transportar en el axonema del cilio. Las proteínas pertenecientes a la vía de transmisión de señales hedgehog participan en el transporte intraciliar e intraflagelar (no se muestran). La tráquea y el o viducto están r evestidos por células epiteliales ciliadas. En estos epitelios, la actividad de los cilios desempeña un papel importante en la defensa local del aparato respiratorio y en el transpor te del óvulo fecundado hasta la cavidad uterina. Algunas células presentan un cilio primario, cuya impor tancia ponen de r elieve algunas enfermedades recesivas infrecuentes en el ser humano, las ciliopatías, debidas a anomalías estructurales en los cilios. E n la figura 1-6 se muestran la estr uctura y el mecanismo de ensamblaje de los cilios primarios, los cuales se caracterizan por: 1) la ausencia de mo vilidad; 2) su par ticipación en las etapas tempranas del desarr ollo embrionario que conducen a la organogenia; 3) la presencia de muchos componentes de la vía de transmisión de señales hedgehog, una vía clave, al menos, en el desarr ollo inicial, y 4) la posición del cilio primario, denominado cinetocilio, de la célula ciliada del órgano de Corti en el oído interno determina la polaridad corr ecta de los estereocilios que contienen actina (v. capítulo 9, «Órganos sensoriales: visión y audición»). Las microvellosidades (fig. 1-7) son proyecciones digitiformes de la superficie apical de las células epiteliales que contienen un núcleo de micr ofilamentos entrecruzados 6 C0005.indd 6 | Histología y biología celular. Introducción a la anatomía patológica 3/5/12 10:48:51 AM Figura 1-7. Diferenciaciones apicales de las células epiteliales: microvellosidades y estereocilios Microvellosidad Microvellosidad: un eje de microfilamentos que contienen actina Oviducto Cubierta Eje de filamentos de actina Eje de filamentos de actina 0,08 μm Unión hermética y desmosoma en cinturón, puntos finales de la red Microvellosidad terminal de Región de la actina red terminal Intestino delgado Lámina basal Microvellosidades Microvellosidades (corte longitudinal) Estereocilio Cilios Microvellosidades y cilios (corte transversal) Cola del espermatozoide Los estereocilios contienen un eje de microfilamentos de actina Estereocilio ramificado Vesículas de endocitosis Lámina basal Epidídimo © Elsevier. Fotocopiar sin autorización es un delito . Las microvellosidades y los estereocilios presentan la misma estructura: un eje de microfilamentos de actina y proteínas asociadas a la actina. En el epitelio intestinal, la actina se proyecta hacia la red terminal, una red de proteínas citoesqueléticas en una disposición similar a un collarín en el dominio apical del citoplasma. A pesar de que las microvellosidades presentan una longitud similar, los estereocilios son más largos y se ramifican, y el dominio apical de la célula posee vesículas de endocitosis. Los puentes que conectan distintos estereocilios (flechas rojas) indican sus ramificaciones. (un polímero de monómer os de actina G). E n el extr emo citoplásmico de la microvellosidad, los haces de actina y otras pr oteínas se extienden hacia la red terminal, un conglomerado fi lamentoso de pr oteínas citoesqueléticas de disposición paralela al dominio apical de la célula epitelial. El epitelio intestinal y algunas por ciones de la nefr ona en el riñón están r evestidos por células epiteliales con micr ovellosidades que conforman un borde en cepillo. En general, este tipo de bor de indica que se trata de una célula implicada en tar eas de absorción. Los estereocilios (v. fig. 1-7) son pr oyecciones digitiformes largas y ramificadas que aparecen en la superfi cie apical de las células epiteliales. D e manera similar a las microvellosidades, los estereocilios contienen un eje de microfilamentos de actina que se entrecruzan con otras pr oteínas. Los estereocilios carecen de axonema. Estas diferenciaciones son características del revestimiento epitelial del epidídimo e inter vienen en el proceso de maduración de los espermatoz oides que tiene lugar en este órgano . MOLÉCULAS DE ADHESIÓN CELULAR La estrecha unión de células similares entre sí y a la lámina basal, un componente de la matriz extracelular, da lugar a una lámina de células epiteliales. Las moléculas de adhesión celular permiten el contacto entre las células epiteliales, el cual se estabiliza a través de las uniones celulares especializadas. A esta organización se debe la polaridad de los dominios apical y basolateral de las láminas de células epiteliales. 1. EPITELIO C0005.indd 7 | 7 3/5/12 10:48:51 AM Figura 1-8. Cadherinas Cuatro dominios de la porción extracelular de la cadherina se unen al calcio. El funcionamiento de las cadherinas depende del Ca2+. Ca2+ Ca2+ Ca2+ La secuencia histidina-valina-alanina (HVA) facilita la formación de dímeros de cadherina cis-homófilos. Los dímeros de cadherina de las membranas celulares opuestas Dímero establecen interacciones cistrans-homófilas o trans-heterófilas. homófilo Ca2+ Las cateninas α, β y γ/placoglobina forman, junto a α-actinina, vinculina y formina-1, el complejo de las cateninas. La catenina β se une a la cadherina y la catenina γ/placoglobina; la catenina α lo hace directamente a la actina. Membrana plasmática γ β α Actina Citoplasma Interacción transhomófila Vinculina Formina-1 α-actinina Proteínas de unión a actina Las cadherinas constituyen las principales proteínas de adhesión que mantienen unidas las células epiteliales en una lámina. La desaparición del calcio altera la cohesividad tisular. La cola citoplásmica interacciona con los filamentos de actina a través de numerosas proteínas intracelulares de unión, como las tres proteínas cateninas. La catenina β también actúa como factor de transcripción. Cuadro 1-B | Moléculas de adhesión celular • Las moléculas de adhesión celular se clasifican como dependientes del Ca2+ e independientes del Ca2+. • Las moléculas de adhesión celular dependientes de Ca2+ son las cadherinas y las selectinas. • Las moléculas de adhesión celular independientes de Ca2+ engloban las moléculas de adhesión celular (CAM) de la superfamilia de las inmunoglobulinas y las integrinas. • Las cadherinas y las CAM realizan interacciones transhomófilas en el espacio intercelular. • Las integrinas constituyen las únicas moléculas de adhesión celular formadas por dos subunidades: ␣ y . • Las cadherinas y las integrinas interaccionan con la actina F a través de moléculas adaptadoras (cateninas para las cadherinas, y vinculina, talina y ␣-actinina para las integrinas). 8 C0005.indd 8 | A pesar de que las moléculas de adhesión celular y las uniones celular es se describen en este texto en el capítulo r elativo a los epitelios, las células no epiteliales también utilizan estas moléculas y uniones para establecer contacto con otras células. Un ejemplo típico de la comunicación de células no epiteliales mediante uniones especializadas es el músculo car díaco (v. capítulo 7, «Tejido muscular»). Se distinguen dos tipos fundamentales de moléculas de adhesión celular (v. cuadro 1-B): 1. Moléculas dependientes de Ca2+, como las cadherinas y las selectinas 2. Moléculas independientes de Ca2+, las cuales conforman la superfamilia de las inmunoglobulinas y las integrinas Muchas células emplean distintas moléculas de adhesión celular en sus uniones celulares. Las integrinas par ticipan, fundamentalmente, en las interacciones entr e las células y la matriz extracelular. Las integrinas y las cadherinas unen el citoesqueleto interno de una célula con la superfi cie de otra célula (cadherinas) o la matriz extracelular (integrinas). Las cadherinas (fig. 1-8) representan una familia de moléculas dependientes de Ca2+ que desempeñan un papel destacado en la adhesión celular y la mor fogenia. La pérdida de cadherinas se asocia a la adquisición de un compor tamiento invasivo por parte de las células tumorales (metástasis) (v. capítulo 4, «Tejido conjuntivo»). Se conocen más de 40 cadherinas difer entes. La E-cadherina es una cadherina epitelial que se encuentra en las superfi cies laterales de las células y se ocupa del mantenimiento de la mayor parte de las capas epiteliales. La eliminación del calcio o la utilización de anticuerpos contra esta cadherina en cultivos de células epiteliales provocan la rotura de las uniones celulares y alteran el establecimiento de las uniones estabilizadoras. Las moléculas de E-cadherina forman dímeros cis-homófilos («igual a igual») que se unen a los dímer os de la misma o distinta clase de cadher inas en la membrana celular opuesta (interacción trans-homófila o heterófi la [«igual a diferente»]). Estos tipos de unión dependen de la pr esencia de calcio y dan lugar a un patrón de adhesión inter celular semejante a una cr emallera. La N-cadherina aparece en el sistema nervioso central, el cristalino del ojo, y en los músculos esquelético y car díaco. La P-cadherina se encuentra en la placenta (trofoblasto). Histología y biología celular. Introducción a la anatomía patológica 3/5/12 10:48:52 AM Figura 1-9. Selectinas Dominio de reconocimiento de hidratos de carbono (CRD) El calcio asociado a los laterales del CRD regula la conformación del dominio y su capacidad de unión a los hidratos de carbono. Ca2+ Ca2+ Dominio similar al factor de crecimiento epidérmico (similar al EGF) Repeticiones de secuencias consenso cortas Membrana plasmática Las selectinas presentan tres dominios extracelulares: 1. Un dominio de reconocimiento de hidratos de carbono (CRD) específico de un glúcido determinado (galactosa, manosa, N-acetilglucosamina y otros). 2. Un dominio homólogo para una repetición presente en el factor de crecimiento epidérmico (similar al EGF). 3. Muchas repeticiones de secuencias consenso que aparecen en las proteínas reguladoras del complemento. Se distinguen tres tipos principales de selectinas: 1. L-selectina, presente en los linfocitos y con afinidad de unión a los hidratos de carbono sulfatados. 2. E-selectina, expresada por las células endoteliales activadas. 3. P-selectina, expresada por las plaquetas y las células endoteliales activadas. Las selectinas, junto a las integrinas y las moléculas de adhesión celular intercelular (ICAM), desempeñan una función destacada en la inflamación y la migración periódica de los linfocitos desde el torrente circulatorio hacia los órganos linfoides (homing). © Elsevier. Fotocopiar sin autorización es un delito . Cola citoplásmica El dominio citoplásmico de las cadherinas se une a la actina a través de proteínas intermedias cuyo conjunto recibe el nombre de complejo de las cateninas (del latín catena, cadena). El complejo comprende cateninas (␣,  y ␥) y proteínas de unión a actina, como ␣-actinina, vinculina y formina-1, entr e otras. El complejo de las cateninas infl uye en el funcionamiento de las cadherinas, al menos, a tres niveles: 1) las cateninas establecen enlaces dir ectos con los fi lamentos de actina; 2) interaccionan con moléculas r eguladoras del citoesqueleto de actina, y 3) controlan el estado de adhesión del dominio extracelular de las cadherinas. La asociación de la actina con el complejo cadherina-catenina es clav e para la mor fogenia celular, los cambios de la mor fología celular y el establecimiento de la polaridad celular. Las moléculas que per tenecen a la familia de las cadherinas se localizan, asimismo, entre las placas citoplásmicas de la zónula y la mácula adher ente. Las  -cateninas desempeñan una función destacada en la carcinogenia colorrectal (v. capítulo 16, «Segmento digestivo inferior»). Las selectinas (fig. 1-9), similares a las cadherinas, son moléculas de adhesión celular dependientes de Ca2+. A diferencia de estas, las selectinas se unen a los hidratos de carbono y se engloban en el gr upo de las lectinas (del latín lectum, seleccionar). Cada selectina posee un dominio de r econocimiento de hidratos de carbono (CRD) con afinidad por un oligosacárido específico unido a una pr oteína (glucoproteína) o un lípido (glucolípido). E l calcio determina la confi guración molecular del CRD. Las selectinas inter vienen en la migración de los leucocitos (del griego leukos, blanco, kytos, célula) desde el torr ente circulatorio (neutrófilos, monocitos, linfocitos B y T) hacia los tejidos mediante la extravasación. Este proceso se basa en el mecanismo de homing, el cual permite la salida de los leucocitos del torr ente circulatorio y su migración hasta los focos de infl amación (v. fig. 1-12 ).Asimismo, posibilita que los linfocitos de origen tímico se alojen en los ganglios linfáticos periféricos (v. capítulo 10, «Sistema inmunitario-linfático»). Las tres clases principales de selectinas de superfi cie celular son las siguientes: 1. P-selectina, presente en las plaquetas y las células endoteliales activ adas que revisten los vasos sanguíneos 2. E-selectina, presente en las células endoteliales activ adas 3. L-selectina, presente en los leucocitos La P-selectina se almacena en v esículas citoplásmicas de las células endoteliales. La activación de las mismas mediante señales de la r espuesta inflamatoria induce la 1. EPITELIO C0005.indd 9 | 9 3/5/12 10:48:52 AM Figura 1-10. Superfamilia de las inmunoglobulinas NCAM-1 VCAM-1 (molécula de adhesión (molécula de adhesión celular neural 1) celular vascular 1) El segmento extracelular de una Dominio similar a las molécula de adhesión celular o inmunoglobulinas CAM se pliega en dos a seis dominios similares a las inmunoglobulinas. Debido a esta característica de las CAM, estas pertenecen a la superfamilia de las inmunoglobulinas (Ig) de proteínas. Las moléculas de la superfamilia de las Ig de una célula poseen la capacidad de unirse a moléculas idénticas de otras células (unión trans-homófila) o a otros miembros de la superfamilia (unión trans-heterófila). Las moléculas ICAM y VCAM desempeñan papeles importantes en las interacciones de los linfocitos T y en la unión de los ICAM-1 leucocitos a células endoteliales (molécula de adhesión activadas o en reposo. celular intercelular 1) Membrana plasmática Citoplasma ICAM-2 (molécula de adhesión celular intercelular 2) aparición de la P-selectina en la superficie celular. Los leucocitos presentan el antígeno sialil-Lewis X, un oligosacárido específi co que actúa como ligando de la P-selectina, en su superfi cie celular. La unión de la P-selectina a este antígeno ralentiza el desplazamiento de estas células en el torr ente circulatorio y comienzan a r odar sobre la superficie de las células endoteliales. D iversos miembros de la super familia de las inmunoglobulinas (Ig) y las integrinas ayudan a estabilizar la unión de la P-selectina a los leucocitos, lo que da lugar a su extrav asación (v. fig. 1-12). N-CAM (molécula de adhesión de las células neurales) per tenece a la superfamilia de las Ig e inter viene en las interacciones homófi las y heterófi las. A diferencia de las cadherinas y las selectinas, las moléculas incluidas en la super familia de las I g son moléculas de adhesión celular independientes de Ca2+ codificadas por un solo gen. Los componentes de estas superfamilia se forman mediante el proceso de corte y empalme alternativo del ARN mensajero (ARNm) y se difer encian por su glucosilación. Una característica que compar ten todos los miembr os de la super familia de las Ig es la pr esencia de un segmento extracelular con uno o más dominios plegados típicos de las inmunoglobulinas (fig. 1-10). Cabe destacar la molécula CD4, miembro de esta superfamilia que actúa como receptor del virus de la inmunodeficiencia humana tipo 1 (VIH-1) en una subclase de linfocitos denominados linfocitos T o células colaboradoras. En el capítulo 10, «S istema inmunitario-linfático», describiremos la función de v arios miembros de la super familia de las Ig. Otros miembros de esta superfamilia desempeñan papeles destacados en el pr oceso de homing durante las reacciones inflamatorias, como las moléculas de adhesión intercelular 1 y 2 (ICAM-1 e ICAM-2) localizadas en la superficie de las células endoteliales. La expresión de ICAM-1 durante una r eacción inflamatoria facilita la migración transendotelial de los leucocitos (v. capítulo 6, «Sangre y hematopoyesis»). Las integrinas (fig. 1-11) se difer encian de las cadherinas, las selectinas y las moléculas pertenecientes a la superfamilia de las Ig en su estructura heterodimérica formada por dos subunidades ␣ y  asociadas, las cuales son codifi cadas por genes diferentes. Se conocen unos 22 heterodímeros de integrinas formados por 17 variantes de la subunidad ␣ y 8 formas de la . Casi todas las células expr esan una o más integrinas. D e manera similar a las cadherinas, el dominio citoplásmico de las -integrinas se une a filamentos de actina a través de proteínas de conexión (talina, vinculina y ␣-actinina). El dominio extracelular de las integrinas se une a la secuencia tripéptido RGD (Arg-Gly-Asp) presente en la laminina y la fibronectina, dos componentes destacados 10 | C0005.indd 10 Histología y biología celular. Introducción a la anatomía patológica 3/5/12 10:48:52 AM Figura 1-11. Integrinas Actina Talina α-actinina Las integrinas se diferencian de otras proteínas de adhesión celular: 1. Constan de dos subunidades. 2. Desempeñan una función doble: se unen a la matriz extracelular y al citoesqueleto interno. La subunidad α de una integrina presenta dos cadenas ligadas por un enlace disulfuro y una cabeza globular con sitios de unión para cationes divalentes. La subunidad β se distingue por dos rasgos destacados: 1) la cadena extracelular presenta secuencias repetidas ricas en cisteína, y 2) la porción intracelular interacciona con los filamentos de actina a través de tres proteínas conectoras: talina, vinculina y α-actinina. Vinculina Citoplasma Membrana plasmática Sólo se une la subunidad β al citoesqueleto Dominios ricos en cisteína Subunidad β S S S S Espacio extracelular Enlace disulfuro Subunidad α Sitios de unión para cationes divalentes S S Fibronectina RGD (arginina-glicina-ácido aspártico) © Elsevier. Fotocopiar sin autorización es un delito . Laminina de la membrana basal, un tipo específi co de matriz extracelular. La laminina y la fibronectina interaccionan con div ersos tipos de colágeno (como el colágeno de tipo IV), proteoglucano perlecano de tipo heparano sulfato y entactina (también conocida como nidógeno). La relación entre las integrinas y la matriz extracelular r eviste una enorme importancia para la migración celular a zonas determinadas durante la embriogénesis y es susceptible de r egulación cuando la motilidad celular es necesaria. A demás de intervenir en las interacciones entre células y matriz, las integrinas también par ticipan en la interacción inter celular. Aquellas con subunidades 2 se expr esan en la superficie de los leucocitos y están implicadas en la unión inter celular. Un ejemplo de estas moléculas es el heterodímero ␣12 de integrina que se une a ligandos de las superficies de las células endoteliales en el transcurso de la fase de homing en la que participan las integrinas ( fig. 1-12). Las integrinas responden a episodios intercelulares mediante la modifi cación de su conformación adhesiva en relación con otras moléculas de la matriz extracelular . Esta respuesta se conoce como transmisión de señales de dentr o afuera. Por otra parte, las integrinas están implicadas en una compleja cascada que se activ a como consecuencia de acontecimientos extracelulares. Proteínas ADAM Unas proteínas llamadas ADAM (un a desintegrina y un a metaloproteinasa) pueden invertir la unión de la célula a la matriz celular mediada por las integrinas. Las ADAM desempeñan funciones clave en la fecundación, la angiogenia, la neurogenia, el desarrollo cardíaco, el cáncer y la enfermedad de Alzheimer (v . capítulo 8, «Tejido nervioso»). Una proteína ADAM típica ( fig. 1-13) contiene un dominio extracelular y un dominio intracelular. El primero se compone de v arias porciones, entre las que figuran un dominio desintegrina y un dominio metaloproteinasa. 1. Un dominio desintegrina se une a integrinas e impide competitiv amente la unión mediada por estas a la laminina, fi bronectina y otras pr oteínas de la matriz extracelular. 1. EPITELIO C0005.indd 11 | 11 3/5/12 10:48:52 AM Figura 1-12. Homing, un proceso en el que participan las selectinas y las integrinas 1 Los leucocitos (neutrófilos) circulantes resisten a las fuerzas de cizallamiento para circular a una velocidad menor en el endotelio vascular. Endotelio Pared del músculo liso Fase de las integrinas Fase de las selectinas Rodamiento Integrinas β1 y β 2 Neutrófilo Fuerzas de cizallamiento VCAM-1 ICAM-1 1 Adhesión 3 Ligando con hidrato de carbono 2 Selectinas 2 La adhesión laxa al endotelio en condiciones de flujo lento provoca el rodamiento de los leucocitos. Las selectinas presentes en la superficie de las células endoteliales se asocian a los ligandos de hidratos de carbono de la superficie de los leucocitos. Migración transendotelial Espacio extravascular 3 Los receptores de las integrinas para los ligandos ICAM-1 endotelial e ICAM-1 se activan con rapidez en la superficie de los leucocitos durante el rodamiento. Los mediadores químicos en los focos de inflamación estimulan la activación de las integrinas β1 y β2. Las integrinas refuerzan la unión de los leucocitos a la superficie de las células endoteliales. La mayoría de los leucocitos circulan en la sangre sin interaccionar con ninguna otra célula sanguínea ni con las células endoteliales que revisten los vasos sanguíneos. No obstante, una subpoblación de linfocitos participa en un proceso de recirculación continua a través de los tejidos linfáticos. Este proceso de homing precisa de la intervención de numerosas moléculas de adhesión que facilitan el direccionamiento de los linfocitos a los distintos compartimentos linfoides del organismo. 4 4 Las integrinas intervienen en la migración transendotelial al interaccionar con ligandos presentes en la superficie de las células endoteliales. La actina F participa en este proceso. La interacción de los linfocitos y las células endoteliales depende de dos tipos de proteínas de adhesión celular: las selectinas y las integrinas. Los neutrófilos emplean un mecanismo similar para abandonar los vasos sanguíneos, fundamentalmente las vénulas poscapilares, hacia los focos de inflamación. La migración de los leucocitos desde el torrente circulatorio hacia los tejidos se desarrolla a lo largo de varias etapas, como se observa en este esquema. 2. Un dominio metaloproteinasa degrada componentes de la matriz para permitir la migración celular. Una función destacada de las ADAM es la liberación de ectodominios de pr oteínas, un proceso a través del cual se pr oduce la liberación proteolítica del ectodominio de una proteína de membrana escindida en la zona adyacente a la membrana plasmática. Las proteínas ADAM pertenecen a la familia de las shedasas. La liberación de ectodominios actúa sobr e la citocina pr oinflamatoria factor de necr osis tumoral ␣ (TNF-␣) y todos los ligandos del r eceptor del factor de cr ecimiento epidérmico. Un ectodominio soluble liberado de una citocina o factor de cr ecimiento puede actuar a distancia del lugar de la escisión (transmisión de señales paracrina). El ectodominio escindido de un r eceptor puede inactivarlo al funcionar como señuelo para secuestrar ligandos solubles del receptor libre asociado a la membrana plasmática. Una anomalía en la escisión del receptor 1 de TNF (TNFR1) debida a una mutación en el sitio de escisión del receptor da lugar a un síndrome febril periódico como consecuencia de la disponibilidad continua de TNFR1 para la unión de TNF-␣. UNIONES CELULARES A pesar de que las moléculas de adhesión celular son r esponsables de la adhesión de una célula con otra, las uniones celulares son necesarias para potenciar la estabilidad. Por otra parte, el movimiento de solutos, iones y agua a través de una capa epitelial 12 | C0005.indd 12 Histología y biología celular. Introducción a la anatomía patológica 3/5/12 10:48:52 AM Figura 1-13. La proteína ADAM, una shedasa Dominio intracelular Las proteínas ADAM (una desintegrina y una metaloproteinasa) son metaloproteinasas de membrana. La actividad proteolítica de las metaloproteinasas depende de un ión metálico (Zn2+). Una proteína ADAM posee un dominio extracelular que contiene un dominio metaloproteinasa N-terminal y un dominio desintegrina. Dominio citoplásmico (sitios de fosforilación o ricos en prolina que se unen a dominios con homología Src [SH3]) Dominio transmembrana Dominio extracelular Plaqueta Liberación Dominio similar a EGF Dominio rico en cisteína Dominio desintegrina Glucoproteína GpIIb/IIIa Dominio metaloproteinasa RGD Dominio Pro (chaperona intramolecular) © Elsevier. Fotocopiar sin autorización es un delito . El dominio metaloproteinasa degrada componentes de la matriz extracelular durante el proceso de migración celular. Asimismo, interviene en la escisión de una proteína de membrana en la membrana plasmática, que da lugar a la liberación de su ectodominio soluble. Este proceso recibe el nombre de liberación del ectodominio. La liberación del ectodominio actúa sobre diversas moléculas, entre las que se incluye la citocina proinflamatoria factor de necrosis tumoral α y todos los ligandos del receptor del factor de crecimiento epidérmico. El dominio desintegrina presenta una notable homología de secuencia con las desintegrinas presentes en el veneno de serpiente. Al liberarse, el dominio desintegrina, que contiene el tripéptido RGD (Arg-Gly-Asp), se une a la glucoproteína GpIIb/IIIa de las plaquetas, lo que impide su agregación. Liberación del ectodominio Membrana plasmática Liberación del ectodominio Ectodominio soluble La liberación del ectodominio hace posible la participación de factores de crecimiento anclados a la membrana en las vías de transmisión de señales paracrina (a distancia del lugar en el que tiene lugar la escisión) o bien su paso al torrente circulatorio. De igual modo, la liberación puede dar lugar a un receptor de tipo señuelo soluble que podría secuestrar un ligando. Proteína transmembrana tiene lugar a través de y entre los componentes de la célula. U n gran númer o de canales y moléculas transportadoras controla la vía de transporte transcelular. La vía paracelular está controlada por un contacto intercelular continuo o uniones celulares. La alteración de estas uniones origina enfermedades adquiridas y hereditarias debidas a unas barreras epiteliales inefi cientes. Las uniones celulares son estr ucturas simétricas formadas entr e dos células adyacentes. Se distinguen tr es clases principales de uniones celular es simétricas (fig. 1-14 ;v. cuadro 1-C). 1. Uniones herméticas 2. Uniones de anclaje 3. Uniones comunicantes Las uniones herméticas (conocidas también como uniones oclusivas) (fig. 1-15 ) llevan a cabo dos funciones principales: 1. Definen la polaridad de las células epiteliales al separar el dominio apical del basolateral y evitar la difusión libr e de lípidos y pr oteínas entre ellos. 2. Impiden el paso libre de moléculas a través de una capa epitelial (barrera de la vía paracelular) . Las membranas celulares de dos células adyacentes entran en contacto a inter valos regulares para sellar el espacio intercelular apical. Estas áreas de contacto estrecho se distribuyen en la superficie celular de manera similar a un cinturón y forman tiras anastomosadas de las proteínas transmembrana ocludina y claudina. Estas proteínas pertenecen a la familia de las tetraespaninas y poseen cuatr o dominios transmembrana, dos asas externas y dos colas citoplásmicas cor tas. 1. EPITELIO C0005.indd 13 | 13 3/5/12 10:48:53 AM Figura 1-14. Uniones de anclaje y comunicantes Obsérvese que las uniones comunicantes no se asocian a elementos del citoesqueleto. Uniones herméticas Definen la polaridad celular y controlan el transporte de sustancias entre células adyacentes. Las uniones estrellas presentan una distribución en cinturón semejante a un lazo que rodeara el perímetro interno de las células y se asocian a filamentos de actina. Unión hermética Zónula adherente o desmosoma en cinturón Esta unión de anclaje presenta una distribución en cinturón y se asocia a filamentos de actina. Zónula adherente Mácula adherente o desmosoma puntual Esta unión de anclaje se distingue por una distribución puntual y se asocia a filamentos intermedios. Hemidesmosoma Los hemidesmosomas vinculan el dominio basal de una célula epitelial con la lámina basal. Los filamentos intermedios se unen a una placa. Mácula adherente Lámina basal Uniones comunicantes Estas uniones conectan a dos células adyacentes. La unión comunicante se compone de conexones, unas estructuras semejantes a canales que permiten el paso de moléculas de pequeño tamaño (∼1,2 kDa) entre las células. La ocludina interacciona con cuatr o proteínas clave ocludina de la zónula (ZO): ZO-1, ZO-2, ZO-3 y afadina. La claudina (del latín claudere, cerrar), una familia de 16 proteínas que forman fi brillas lineales en las uniones herméticas, confi ere propiedades de barrera a la vía paracelular. Una mutación del gen que codifi ca la claudina 16 da lugar a una enfermedad humana muy infr ecuente, el síndrome de pérdida renal de magnesio, el cual se caracteriza por hipomagnesemia y convulsiones. En las uniones herméticas apar ecen dos miembros de la super familia de las I g, las nectinas y las moléculas de adhesión de las uniones ( JAM). Ambas forman heterodímeros (homodímeros cis) y posteriormente homodímeros trans en el espacio intercelular. Las nectinas se conectan a los filamentos de actina a través de la proteína afadina. La deleción dirigida del gen que codifi ca esta proteína en el ratón provoca la muerte del embrión. U na mutación del gen nectina-1 produce el síndrome del paladar leporino/labio leporino y displasia ectodérmica (CLEPD1) que afecta a la piel, al pelo, a las uñas y a los dientes en el ser humano . Los ratones macho con deficiencia de nectina-2 son estériles. Las uniones herméticas se pueden visualizar mediante criofractura como una red de hebras de sellado ramificadas y anastomosadas. El procedimiento de criofractura de estudio de las membranas celular es se describe en el capítulo 2, «G lándulas epiteliales». Las uniones de anclaje se disponen por debajo de las uniones herméticas, por lo general en las pr oximidades de la superfi cie apical del epitelio . Se han identifi cado tres clases de uniones de anclaje (v. figs. 1-14, 1-16, 1-18 y 1-19 ): 1. La zónula adherente o desmosoma en cinturón 2. La mácula adherente o desmosoma puntual 3. El hemidesmosoma De forma similar a las uniones herméticas, la zónula adherente presenta una morfología de cinturón. La zónula adherente (v. fig. 1-16) se asocia a microfilamentos de actina, asociación que se sustenta en la interacción de las cadherinas (desmocolinas y desmogleína) con las cateninas (␣,  y ␥). Las principales desmogleínas que se expresan en la epidermis de la piel son las desmogleínas 1 y 3 ( fig. 1-17 ). La mácula adherente (también llamada desmosoma) es una unión puntual asociada a filamentos intermedios de queratina (también llamados tonofilamentos) que se extienden desde un punto a otr o de las superfi cies lateral y basal de las células epiteliales (fig. 1-18). Los desmosomas puntuales confi eren resistencia y rigidez a la capa de células epiteliales. Asimismo, apar ecen en los discos inter calados que unen 14 | C0005.indd 14 Histología y biología celular. Introducción a la anatomía patológica 3/5/12 10:48:53 AM Figura 1-15. Organización molecular de las uniones herméticas Las uniones herméticas son cinturones perimetrales que se localizan en el dominio apical de las células epiteliales y unen células endoteliales. Sellan el espacio entre las células epiteliales, y regulan el paso de agua y el flujo iónico entre las células epiteliales adyacentes (vía paracelular). Las moléculas que atraviesan la célula siguen una vía transcelular. Las moléculas de adhesión de las uniones (JAM) se asocian a afadina y ZO-1. Los cis -homodímeros JAM interaccionan entre sí (interacción trans-homo) para definir la polaridad celular. El complejo afadina-nectina se ancla a ZO-1. Las nectinas forman cis-homodímeros que interaccionan entre sí (interacción trans-homo) a través de la región extracelular. JAM Afadina Nectina Las proteínas de la zónula oclusiva (ZO-1, ZO-2 y ZO-3) facilitan la interacción recíproca de la ocludina, las claudinas y las JAM con la actina F. Actina F ZO-1 ZO-2 ZO-3 La ocludina y las claudinas representan la base molecular de la formación de hileras de uniones herméticas en las preparaciones de criofractura. Ocludina Vía paracelular Claudina Vía transcelular Las nectinas y las JAM pertenecen a la superfamilia de las inmunoglobulinas. Su estructura contiene asas de inmunoglobulinas, cada una de las cuales se estabiliza por medio de enlaces disulfuro. Las nectinas y los cis-homodímeros JAM intervienen en la adhesión intercelular trans -homo. La ocludina y las claudinas pertenecen a la familia de las tetraespaninas de proteínas, que poseen cuatro dominios transmembrana, dos asas y dos colas citoplásmicas. 2 1 © Elsevier. Fotocopiar sin autorización es un delito . Luz 1 En las preparaciones de criofractura, las uniones herméticas se visualizan como crestas selladoras ramificadas e interconectadas que conforman una red en las proximidades del dominio apical de la célula. Las crestas representan a las proteínas transmembrana ocludina y claudinas asociadas a la vertiente protoplásmica fracturada. Microfilamentos de actina Zónula adherente Membrana plasmática 2 En los cortes finos, el espacio intercelular está ocluido por la ocludina, las claudinas, las JAM y las nectinas. La zónula adherente, o desmosomas en cinturón, suele localizarse por debajo de las uniones herméticas. miocardiocitos adyacentes en el corazón (v . capítulo 7, «T ejido muscular») y las meninges que tapizan las superfi cies externas del encéfalo y la médula espinal. A diferencia de las uniones oclusivas, las membranas de células adyacentes unidas por zónulas y máculas adher entes se separan por un espacio inter celular relativamente amplio. Este espacio está ocupado por la por ción glucosilada de unas proteínas pertenecientes a la familia de lascadherinas, las desmogleínas y las desmocolinas, que se anclan a placas citoplásmicas que contienen desmoplaquina, placoglobina (␥-catenina) y placofilina. Las placas citoplásmicas se unen a la cara interna de la membrana plasmática. El entrecruzamiento de cadherinas similares supone la aproximación de las células a través de una interacción homófila o heterófila dependiente 1. EPITELIO C0005.indd 15 | 15 3/5/12 10:48:53 AM Cuadro 1-C | Uniones celulares Figura 1-16. Zónula adherente (desmosoma en cinturón) • Las uniones celulares se dividen en simétricas y asimétricas. Entre las primeras se encuentran las uniones herméticas, los desmosomas en cinturón (zónula adherente) y las uniones comunicantes. El hemidesmosoma representa una unión asimétrica. • Las uniones herméticas contienen ocludina y claudina, las cuales pertenecen a la familia proteica de las tetraespaninas, ya que cuatro segmentos de cada proteína atraviesan la membrana plasmática. Otro componente es el complejo proteico afadina-nectina. Otros elementos proteicos son las moléculas de adhesión de las uniones (JAM), las proteínas de la zónula oclusiva (ZO) ZO-1, ZO-2 y ZO-3 y la actina F. Las uniones herméticas forman una junta perimetral que controla la vía paracelular de transporte de moléculas. • La zónula adherente (desmosomas en cinturón) se compone de una placa con desmoplaquina, placoglobina (␥-catenina) y placofilina. Las cadherinas, principalmente las desmocolinas y los dímeros de desmogleínas, y el complejo afadina-nectina se extienden desde la placa hacia el espacio extracelular. Un complejo de cateninas une los filamentos de actina a la placa. De manera similar a las uniones herméticas, los desmosomas en cinturón crean una junta perimetral en la región apical de las células epiteliales. • La mácula adherente (desmosoma puntual) es semejante a la zónula adherente desde el punto de vista estructural, si bien carece de complejos afadina-nectina y de cateninas y posee filamentos intermedios (tonofilamentos), en lugar de filamento de actina, que se unen a la placa. • Los hemidesmosomas se componen de una lámina de membrana interna, a la que se asocian los tonofilamentos, y una placa de membrana externa, la cual se une a la lámina basal por medio de la integrina ␣64 y la laminina 5. • Las uniones herméticas, los desmosomas en cinturón y los hemidesmosomas son uniones de anclaje. Las uniones comunicantes no actúan como uniones de anclaje, sino que representan conexiones de comunicación entre células adyacentes. La unidad básica de la unión comunicante es el conexón, formado por seis moléculas de conexinas dispuestas alrededor de un canal central. Afadina Filamento de actina Complejo afadina-nectina Nectina Unión hermética Placa Complejo de catenina Cadherinas (desmocolinas y desmogleínas) Membrana Filamentos plasmática de actina Placa: desmoplaquina, placoglobina y placofilina del Ca2+, como se ha descrito anteriormente. La figura 1-18 recoge algunos trastornos hereditarios de algunos de los componentes que integran el desmosoma. Los genes correspondientes a las cadherinas desmosómicas humanas codifi can cuatro desmogleínas y tres desmocolinas, cuyos dominios citoplásmicos interaccionan con la placoglobina y la placofi lina. La desmoplaquina interacciona con fi lamentos intermedios de queratina en la epidermis, la desmina en los discos intercalados y la vimentina en las meninges. La desmogleína 1 y la desmogleína 3 mantienen la capacidad de cohesión de la epidermis, un epitelio escamoso estratificado. La síntesis de autoanticuerpos contra la desmogleína 1 pr oduce una enfermedad ampollosa (alteración de la adhesión celular) de la piel denominada pénfigo foliáceo (v. fig. 1-17). Los hemidesmosomas son estructuras asimétricas que anclan el dominio basal de una célula epitelial con la lámina basal sub yacente (v. fig. 1-19). La organización de los hemidesmosomas difi ere respecto a las de la mácula adherente o el desmosoma. E l hemidesmosoma se compone de: 1. Una placa citoplásmica interna asociada a fi lamentos intermedios (también conocidos como queratinas o tonofilamentos) 2. Una placa de membrana externa que une el hemidesmosoma a la lámina basal por medio de filamentos de anclaje (formados por laminina 5) e integrina ␣64 A pesar de que los hemidesmosomas presentan el aspecto de medio desmosoma, ninguno de los componentes bioquímicos del desmosoma está pr esente en los primeros. Los hemidesmosomas incrementan la estabilidad global de los tejidos epiteliales a través de la unión de los fi lamentos intermedios del citoesqueleto a los elementos que forman parte de la lámina basal. Se abordarán otros detalles de los hemidesmosomas y su papel en las enfermedades autoinmunitarias de la piel al tratar la estructura de los fi lamentos intermedios en el apar tado «Citoesqueleto». Las uniones comunicantes son simétr icas y están formadas por unas pr oteínas integrales de membrana denominadas conexinas. La asociación de seis monómeros Figura 1-17. Desmogleínas en los trastornos cutáneos: pénfigo foliáceo La desmogleína 1 predomina por encima de la capa espinosa. Ampolla La desmogleína 3 predomina en las capas basal y espinosa. Capas superficiales de la epidermis Capas de la epidermis Capa córnea Capa granulosa Capa espinosa Capa basal Dermis Lámina basal El pénfigo foliáceo es una Depósitos intercelulares de enfermedad ampollosa mediada por Lámina basal inmunoglobulinas en las capas autoanticuerpos en la que los anticuerpos superficiales de la epidermis en contra la desmogleína 1 provocan la contraposición a las capas basales. pérdida de adhesión de los queratinocitos en las capas superficiales de la epidermis. Imagen de inmunofluorescencia tomada de Weedon D: Skin Pathology. 2nd edition. London, Churchill Livingstone, 2002. 16 | C0005.indd 16 Histología y biología celular. Introducción a la anatomía patológica 3/5/12 10:48:53 AM Figura 1-18. Mácula adherente (desmosoma puntual) Trastornos hereditarios que afectan a la piel y al corazón Línea media densa Placas densas citoplásmicas con las proteínas desmoplaquina, placoglobina y placofilina Los filamentos intermedios de queratina se anclan a la desmoplaquina Cadherinas (desmocolinas y desmogleínas) Desmogleínas (Dsg 1-4). Cadherinas. Mutaciones en los genes de las desmogleínas: queratodermia palmoplantar estriada. Hipotricosis localizada. Desmocolinas (Dsc 1-3). Cadherinas. No se ha definido ninguna enfermedad. Queratina Placa externa Placa interna Vimentina densa densa Membrana plasmática Desmina Membrana plasmática Filamentos intermedios de queratina (tonofilamentos) Membrana plasmática Placa externa densa Placa interna densa Línea media densa Placoglobina (γ-catenina) y placofilinas (1-4). La placoglobina interacciona directamente con la región intracelular de las cadherinas y se une, asimismo, a la desmoplaquina y a las placofilinas. Estas últimas intervienen en el reclutamiento de proteínas a la membrana plasmática. Mutación en el gen de la placoglobina: enfermedad de Naxos (miocardiopatía arritmógena del ventrículo derecho [MAVD], pelo lanudo y queratodermia palmoplantar). Los adipocitos sustituyen a los miocardiocitos. Desmoplaquinas (I-II). Las desmoplaquinas unen la región intracelular de las cadherinas a los filamentos intermedios de queratina, vimentina o desmina). Mutación en el gen de la desmoplaquina: MAVD. Pelo lanudo. de conexina da lugar a un conexón, una estructura cilíndrica hueca que atraviesa la membrana plasmática. La disposición terminoterminal de los conexones en células adyacentes origina un canal directo de comunicación (1,5-2 nm de diámetro) entre el citoplasma de dichas células ( fig. 1-20). Los conexones presentan una tendencia a agregarse y pueden formar placas de unos 0,3 mm de diámetro. Estas uniones facilitan el mo vimiento de moléculas de 1,2 nm de diámetr o (p. ej., Ca2+ y monofosfato de adenosina cíclico [cAMP]) entr e las células. Los canales axiales de conexión se cierran cuando la concentración de Ca 2+ es alta. Esta unión es responsable del «acoplamiento» químico y eléctrico de células adyacentes. Un ejemplo típico son las células del músculo cardíaco, que se conectan por medio de uniones comunicantes para la transmisión de señales eléctricas. Figura 1-19. Hemidesmosoma Epidermis © Elsevier. Fotocopiar sin autorización es un delito . Filamentos de queratina Filamentos intermedios de queratina (tonofilamentos) Lámina Lámina Placa Lámina basal Filamentos de anclaje (laminina 5) Membrana plasmática Integrina α 6 β 4 Placa Filamentos de anclaje (laminina 5) Lámina basal 1. EPITELIO C0005.indd 17 | 17 3/5/12 10:48:54 AM Figura 1-20. Uniones comunicantes El canal intercelular es un canal axial que permite el paso directo de pequeñas moléculas de transmisión de señales entre células adyacentes con el fin de coordinar la respuesta celular. Los agregados de canales intercelulares reciben el nombre de uniones comunicantes debido al angosto espacio extracelular que separa las membranas plasmáticas adyacentes. cAMP Ca2+ Ca2+ Membrana plasmática 1 Conexón Hendidura Membrana plasmática 2 cAMP Conexina Seis monómeros de conexina se ensamblan para originar un conexón hexamérico, un cilindro con un canal abierto central. Los conexones de la membrana plasmática de una célula se alinean con los de otra adyacente para formar un canal intercelular hidrófilo entre los citoplasmas de ambas células. Importancia clínica: mutaciones de las conexinas en la enfermedad humana La mutación de los genes que codifican las conexinas produce diversas enfermedades. Las mutaciones del gen conexina 26 (Cx26), cuyo nivel de expresión es elevado en las células de la cóclea, se asocia a hipoacusia. Las mutaciones del gen conexina 32 (Cx32) se obser van en la neuropatía desmielinizante de Char cot-Marie-Tooth ligada al cr omosoma X, la cual cursa con una degeneración progresiva de los nervios periféricos, y se distingue por la debilidad y la atrofia musculares distales, así como por la alteración de los r eflejos tendinosos profundos. La proteína conexina 32 se expresa en las células de Schwann, las cuales intervienen en la pr oducción de las v ainas de mielina que r odean los ax ones del sistema nervioso periférico (v. capítulo 8, «Tejido nervioso»). Las uniones comunicantes conectan diferentes porciones de las v ainas de mielina de una misma célula de Schwann en lugar de células distintas. La desaparición de los conductos axiales funcionales en la mielina da lugar a la alteración de la mielinización. Las mutaciones del gen conexina 50 (Cx50) se asocian a cataratas congénitas que originan ceguera. Las células óseas (osteoblastos/osteocitos) se conectan entre sí a través de uniones comunicantes y expresan las conexina 43 (Cx43) y 45 (Cx45). La deleción del gen Cx43 condiciona anomalías esqueléticas y r etraso en la mineralización ósea. MEMBRANA BASAL Las integrinas intervienen en las interacciones entre las células y la matriz extracelular a través de la unión al dominio RGD de la laminina y la fi bronectina (v. fig. 1-11). La laminina y la fibronectina son proteínas peculiares de la matriz extracelular que se asocian a colágenos, pr oteoglucanos y otras pr oteínas para formar la membrana basal, la lámina que sustenta a la may oría de los epitelios. La membrana basal consta de dos componentes ( fig. 1-21 ): 1. Lalámina basal, una matriz extracelular similar a una sábana que se encuentra en contacto directo con las superfi cies de las células epiteliales. E l autoensamblaje de moléculas de laminina con colágeno de tipo IV , entactina y pr oteoglucanos origina la lámina basal. 2. La lámina reticular, integrada por fi bras de colágeno, sostiene a la lámina basal y se continúa con el tejido conjuntiv o. 18 | C0005.indd 18 Histología y biología celular. Introducción a la anatomía patológica 3/5/12 10:48:55 AM Figura 1-21. Membrana basal Célula epitelial Núcleo Dominio basal Lámina basal Lámina reticular Riñón (corteza) La membrana basal, un elemento extracelular que se encuentra en contacto directo con el dominio basal de las células epiteliales, puede visualizarse con el microscopio óptico en muestras teñidas con el colorante de ácido peryódico de Schiff (PAS). En el microscopio electrónico, la membrana basal se divide en dos capas o láminas: 1. Una lámina basal, que contiene laminina, fibronectina, colágeno de tipo IV, proteoglucanos de tipo heparano sulfato y nidógeno (también llamado entactina). 2. Una lámina reticular, formada por fibras de colágeno de tipo III (fibras reticulares) Ambas capas se componen de glucoproteínas. Son positivas para la tinción de PAS. En el microscopio electrónico, ambas láminas se visualizan como una membrana basal única en muestras teñidas con el colorante PAS. El microscopio electrónico permite observar cada lámina como una entidad individual. . © Elsevier. Fotocopiar sin autorización es un delito . Lámina basal Cuadro 1-D | Reacción de ácido peryódico de Schiff (PAS) • El método de PAS es una técnica histoquímica muy utilizada para detectar grupos 1,2-glicol o 1,2-aminoalcohol, como los presentes en el glucógeno, el moco y las glucoproteínas. • El ácido peryódico, un oxidante, convierte estos grupos en aldehídos. El reactivo de Schiff, una fucsina incolora, reacciona con los aldehídos para dar lugar a un producto de color rojo-violeta (magenta) característico. • Algunas estructuras destacadas que se revelan mediante esta técnica son la membrana basal, el glucocáliz, la mucosidad fabricada por las células caliciformes, las hormonas glucoproteicas almacenadas en células de la hipófisis y los colágenos. Lámina reticular Núcleo de un fibroblasto que sintetiza componentes de la lámina reticular Célula epitelial Las láminas basal y r eticular pueden distinguirse en la micr oscopia electrónica. En el micr oscopio óptico, el conjunto de las láminas basal y r eticular recibe el nombre de membrana basal, la cual se r econoce mediante la tinción de ácido peryódico de Schiff (PAS) (v. fig. 1-21; v. cuadro 1-D). La lámina basal se ocupa de funciones específi cas en los distintos tejidos. La lámina basal doble del corpúsculo r enal representa el elemento más impor tante de la barrera de fi ltración glomerular a lo largo del paso inicial de formación de la orina (v. capítulo 14, «Aparato urinario»). En el músculo esquelético, la lámina basal mantiene la integridad tisular y su alteración condiciona la aparición de distrofias musculares (v. capítulo 7, «Tejido muscular»). Los componentes de la lámina basal orientan a las células migratorias hacia la cresta gonadal en preparación para el desarrollo de las gónadas durante la migración de las células germinales. La lámina basal no se limita a sustentar a los epitelios, sino que también desempeña otras funciones en células no epiteliales. La laminina (fig. 1-22) es una pr oteína en forma de cr uz formada por tr es cadenas: la cadena ␣, la cadena  y la cadena ␥. Las moléculas de laminina se asocian entre sí para formar un polímero similar a una red. La laminina y el colágeno de tipo IV son los dos componentes fundamentales de la lámina basal de cuya síntesis se encargan algunas células epiteliales que descansan sobr e dicha lámina. 1. EPITELIO C0005.indd 19 | 19 3/5/12 10:48:55 AM Figura 1-22. Laminina y fibronectina Cadena α Laminina Cadena β Cadena γ Sitio de unión para colágeno Nidógeno (entactina) Colágeno Sitio de unión celular (RGD) para integrinas Integrina α6β1 Sitio de unión para heparina/ heparano sulfato y α-distroglucano Proteoglucano La laminina es el componente principal de la lámina basal. Se compone de tres cadenas de polipéptidos unidas por enlaces disulfuro, las cadenas α, β y γ. Las variantes de cada cadena dan lugar a varias isoformas de la laminina con estructuras y funciones diferentes. Las lamininas poseen sitios de unión para los receptores de la superficie celular (integrinas), colágeno de tipo IV y otras proteínas de adhesión (como nidógeno, también llamado entactina). Los monómeros de laminina se asocian entre sí para dar lugar a una red que forma parte de la lámina basal. Fibronectina Fibrina Colágeno C-terminal S S S S Proteoglucanos (heparano sulfato) Sitios de unión para integrina (α5β1) La fibronectina es una glucoproteína formada por dos cadenas idénticas unidas por enlaces disulfuro próximos al extremo C. Se conocen dos formas de fibronectina: 1. Fibronectina plasmática, sintetizada por los hepatocitos y secretada al torrente circulatorio. 2. Fibronectina celular, producida por los fibroblastos, que forma parte de la matriz extracelular. La fibronectina posee sitios de unión para integrinas, colágeno, heparano sulfato y fibrina. La laminina posee sitios de unión para el nidógeno (también llamado entactina), proteoglucanos (en particular, perlecano heparano sulfato), el ␣-distroglucano (v. capítulo 7, «Tejido muscular») y las integrinas. La fibronectina (v. fig. 1-22) consta de dos cadenas proteicas unidas por enlaces disulfuro. Se trata de la molécula de adhesión más impor tante de la matriz extracelular del tejido conjuntiv o y es sintetizada por los fi broblastos. La fi bronectina muestra sitios de unión para la heparina presente en los proteoglucanos, varios tipos de colágeno (tipos I, II, III y IV) y fibrina (generada a partir del fibrinógeno durante el proceso de coagulación sanguínea). Los hepatocitos sintetizan la fi bronectina circulante en el seno del hígado . Esta fibronectina se diferencia de la producida por los fibroblastos por la ausencia de una o dos repeticiones (denominadas EDA y EDB por dominio extra A y B, r espectivamente) como consecuencia de un pr oceso alternativo de cor te y empalme del ARNm. La fi bronectina circulante se une a la fi brina, un elemento de los coágulos sanguíneos formados en z onas dañadas de los v asos sanguíneos. El dominio RGD de la fi bronectina fija se asocia a la integrina expr esada en la superfi cie de las plaquetas activadas y el coágulo aumenta de tamaño . Retomaremos la cuestión de la coagulación sanguínea o hemostasia en el capítulo 6, «S angre y hematopoyesis». Interacciones de las células entre sí y con la lámina basal En la figura 1-23 se r esumen los datos más destacados sobr e las moléculas de adhesión celular y las uniones celular es. Un epitelio es una lámina continua de células polarizadas sustentada por una membrana basal. La polaridad del epitelio depende de las uniones herméticas que dividen las células polarizadas en r egiones apical y basolateral. Las uniones herméticas contr olan la vía paracelular de transporte de solutos, iones y agua, y forman un cinturón alr ededor del perímetro de cada célula. Las células endoteliales, que integran el epitelio escamoso simple, se unen por medio de uniones herméticas y desmosomas puntuales sometidos a una estr echa regulación 20 | C0005.indd 20 Histología y biología celular. Introducción a la anatomía patológica 3/5/12 10:48:56 AM Figura 1-23. Resumen de las uniones celulares y las moléculas de adhesión celular Zónula adherente (desmosomas en cinturón) Se compone de una placa densa asociada al complejo de las cateninas (α-catenina, β- catenina y γ-catenina), α-actinina, vinculina y formina-1. Los filamentos de actina se asocian al complejo de las cateninas. Las cadherinas atraviesan el espacio intercelular y el complejo afadina-nectina conecta las placas densas adyacentes. Superfamilia de las inmunoglobulinas Las moléculas de adhesión celular pertenecen a la superfamilia de las inmunoglobulinas debido a que poseen dominios semejantes a los de estas moléculas. Las CAM no dependen del Ca2+ para mantener interacciones homófilas adhesivas. Uniones herméticas (uniones oclusivas) Están formadas por proteínas transmembrana ocludina y claudinas, asociadas a ZO-1, ZO-2, ZO-3 y el complejo afadina-nectina en el lado intracelular. La ocludina y las claudinas sellan el espacio intercelular. Actina Complejo Claudina de cateninas Ocludina Complejo afadina-nectina ZO-1, ZO-2 y ZO-3 Complejo afadina-nectina Cadherinas Selectina Las selectinas son moléculas dependientes de Ca2+ con afinidad de unión por los hidratos de carbono. Desempeñan una función destacada en el proceso de homing. © Elsevier. Fotocopiar sin autorización es un delito . Hemidesmosomas Los hemidesmosomas se componen de una lámina interna, el sitio de anclaje del filamento intermedio queratina, y una lámina externa, asociada a la basal a través de dos elementos destacados: filamentos de anclaje (laminina 5) e integrina α6β4. Mácula adherente (desmosoma puntual) Los desmosomas son estructuras simétricas formadas por: 1) placas con desmoplaquina; 2) cadherinas de unión (principalmente desmocolinas y desmogleínas), y 3) filamentos de queratina asociados a dichas placas. Integrinas En la superficie extracelular, las integrinas interaccionan directamente con la fibronectina y la laminina. En el lado intracelular, las subunidades β de las integrina interaccionan con la actina a través de proteínas intermedias (α-actinina, vinculina y talina). S S Perlecano S S Fibronectina Proteoglucanos Los proteoglucanos (principalmente, heparano sulfato perlecano) interaccionan directamente con la fibronectina y la laminina. Colágenos Colágeno de tipo IV Nidógeno (entactina) Laminina La laminina consta de tres cadenas de polipéptidos (α, β y γ) con sitios de unión para el colágeno de tipo IV, el proteoglucano perlecano, las integrinas y el nidógeno. encaminada a mantener la integridad del endotelio y a proteger los vasos de la permeabilidad incontrolada, la infl amación y las r eacciones que conducen a la coagulación sanguínea en la luz (v. capítulo 12, «Aparato cardiovascular»). Los leucocitos se unen a las superficies de las células endoteliales y migran a través del endotelio hacia los tejidos subyacentes para acceder al foco de infección mediante un mecanismo conocido como diapédesis. Los leucocitos avanzan entre las uniones entre estas células al anclarse a las endoteliales activadas o en r eposo por medio de las moléculas de adhesión de dichas células ICAM-1 y VCAM-1 (v. fig. 1-10). ICAM-1 e VCAM-1 se asocian a las subunidades 2 y 1 de las integrinas de los leucocitos (v . fig. 1-12). La cohesividad del epitelio depende de tres factores: las uniones celulares, las moléculas de adhesión celular en general y la interacción de las integrinas con la matriz extracelular , la mayor parte de la cual es pr oducida por los fi broblastos. La lámina basal r eviste una importancia clave en la diferenciación de las células epiteliales durante la embriogénesis. En la figura 1-23 se puede apreciar lo siguiente: 1. El dominio basal de las células epiteliales interacciona con la lámina basal a través de los hemidesmosomas y las integrinas. Los hemidesmosomas, así llamados por su aspecto de medio desmosoma en las micr ofotografías electrónicas, se anclan a la lámina basal fuera de la célula y a una erd de filamentos intermedios de queratina 1. EPITELIO C0005.indd 21 | 21 3/5/12 10:48:56 AM Figura 1-24. Inmunocitoquímica Generalmente se utilizan dos técnicas: la inmunocitoquímica directa e indirecta. Las células que se estudian mediante técnicas de inmunocitoquímica deben ser permeables, lo que suele conseguirse por medio de un detergente, de tal modo que las moléculas de anticuerpo (inmunoglobulinas) puedan entrar en la célula para unirse a un antígeno. Inmunofluorescencia directa La molécula de inmunoglobulina no puede pasar al citoplasma de una célula intacta. Antígeno Tras el tratamiento con detergentes, la inmunoglobulina pasa al interior celular y se une al antígeno. dentro de ella mediante un complejo lámina-placa. Las mutaciones en los elementos del hemidesmosoma dan lugar a ampollas grav es en el seno de la piel debido a la desaparición de la integridad de las moléculas de anclaje. 2. Las integrinas interaccionan dir ectamente con la laminina y la fi bronectina, en especial el dominio RGD al que se unen aquellas. E n el interior de la célula, las integrinas interaccionan con microfilamentos de actina y conectan el entorno extracelular con el espacio intracelular . Como sabemos, algunas pr oteínas ADAM emplean su dominio desintegrina para evitar la unión de las integrinas a div ersos ligandos presentes en la matriz extracelular. 3. Los colágenos y los proteoglucanos no interaccionan de forma dir ecta con el dominio basal de las células epiteliales, sino que lo hacen a través de la laminina y la fibronectina, las cuales poseen sitios específi cos de unión para los colágenos, el proteoglucano perlecano y el nidógeno . 4. Los dominios laterales de las células epiteliales adyacentes se comunican por medio de uniones comunicantes (que no apar ecen en la figura 1-23). A diferencia de las uniones herméticas y los desmosomas en cinturón y puntuales, las uniones comunicantes no constituyen sistemas de anclaje. Se componen de canales intercelulares que conectan el citoplasma de células adyacentes y actúan como uniones comunicantes. 5. Las cadherinas y el complejo afadina-nectina están pr esentes en las uniones herméticas y la zónula adher ente, a las que se asocian los micr ofilamentos de actina. CITOESQUELETO El tratamiento con detergentes convierte a la membrana plasmática en permeable ante el anticuerpo. La inmunocitoquímica directa engloba la aplicación deun anticuerpo específico o alguna molécula con afinidad de unión específica para un antígeno asociado a un marcador visible. Los marcadores visibles unidos a la molécula de la inmunoglobulina pueden ser un colorante fluorescente, como una fluoresceína (fluorescencia verde) o rodamina (fluorescencia roja). Al examinar la muestra con el microscopio de fluorescencia, los componentes marcados aparecen como estructuras fluorescentes brillantes. La inmunofluorescencia directa requiere un paso único de incubación y representa un sencillo sistema de detección. Las partículas de oro (electrodensas) unidas a las moléculas de inmunoglobulina son consideradas unos marcadores cómodos para el estudio inmunocitoquímico en el microscopio electrónico. Inmunofluorescencia indirecta Antígeno Segundo anticuerpo con un marcador fluorescente Primer anticuerpo sin marcador fluorescente unido al antígeno La inmunocitoquímica indirecta precisa de la utilización de un segundo anticuerpo unido a un marcador visible. Este segundo anticuerpo se une al primero no marcado y específico para un antígeno determinado. El método directo implica dos incubaciones (una para el primer anticuerpo y otra para el segundo) y posee una sensibilidad mayor en la identificación de antígenos. 22 | C0005.indd 22 El citoesqueleto es una red tridimensional de proteínas distribuidas en el citoplasma de las células eucariotas. El citoesqueleto interviene en: 1. El movimiento celular (deslizamiento de células sanguíneas a lo largo de las paredes de los vasos, migración de fibroblastos durante la cicatrización y movimiento de células durante el desarr ollo embrionario). 2. El soporte y el refuerzo de las células 3. La fagocitosis 4. La citocinesis 5. La adherencia de una célula con otras y con la matr iz extracelular 6. La modificación de la mor fología celular Inicialmente, los componentes del citoesqueleto se identifi caron en estudios de microscopia electrónica. En los primer os trabajos se describía un sistema de «cables»·citoplásmicos que se clasifi caron en tres grupos según su tamaño: 1. Microfilamentos (7 nmde grosor) 2. Filamentos intermedios (10 nmde grosor) 3. Microtúbulos (25 nmde diámetro) Los estudios bioquímicos, consistentes en la extracción de pr oteínas citoesqueléticas de la célula por medio de detergentes y sales y en la traducción in vitro de moléculas específicas de ARNm, pusieron de manifiesto que cada tipo de fi lamento posee una organización proteica exclusiva. Tras ser purifi cadas, las proteínas citoesqueléticas se emplearon como antígenos para la pr oducción de anticuerpos. Estos se utilizan como herramientas para la localización de div ersas proteínas citoesqueléticas en la célula. La localización inmunocitoquímica de proteínas citoesqueléticas (fig. 1-24) y el tratamiento de la célula con distintas sustancias químicasque alteran la organización normal del citoesqueleto han sido de enorme utilidad para comprender la organización y la función del citoesqueleto . Microfilamentos La actina representa el principal componente de los microfilamentos. Los filamentos de actina están formados por monómer os globulares (actina G, 42 kD a) que se polimerizan para originar fi lamentos helicoidales asimétricos (actina F). La actina es un componente citoesquelético v ersátil y abundante que forma haces estáticos y contráctiles, así como r edes filamentosas determinadas por pr oteínas de unión a actina y por su localización y su función especiales en la célula. Los haces de actina F aparecen en las microvellosidades de las células epiteliales intestinales (fig. 1-25 ) y renales (borde en cepillo) y los ester eocilios de las células ciliadas del oído interno . Hemos comentado que la por ción intracelular de las moléculas de adhesión celular cadherinas e integrina 1 interaccionan con la actina F mediante pr oteínas Histología y biología celular. Introducción a la anatomía patológica 3/5/12 10:48:56 AM Figura 1-25. Haces de actina F del eje de una microvellosidad intestinal Borde en cepillo –formado por una capa compacta de microvellosidades– en el dominio apical de las células epiteliales cilíndricas intestinales. El borde en cepillo aparece, igualmente, en las células epiteliales cúbicas del túbulo contorneado proximal (nefrona). Microvellosidad intestinal Glucocáliz Caperuza Célula caliciforme La formina —una proteína de la caperuza que interacciona con los extremos romo en crecimiento rápido de la actina F— favorece el alargamiento de la actina F no ramificada. Proteínas de ligamiento de membrana Haz de actina Formina Glucocáliz Proteínas de entrecruzamiento de actina Villina Fimbrina Miosina I Calmodulina Actina F Raicillas de los filamentos de actina Red terminal © Elsevier. Fotocopiar sin autorización es un delito . Isoforma de espectrina que conecta las fibrillas Filamentos intermedios (queratina) de unión (v. figs. 1-8 y 1-11 ). Como se abor dó en el capítulo 6, «S angre y hematopoyesis», la actina, junto a la espectrina, forma una r ed filamentosa en la cara interna de la membrana de los eritr ocitos que desempeña un papel esencial para el mantenimiento de la mor fología y de la integridad de estas células. La espectrina es un tetrámero que consta de dos cadenas polipeptídicas difer entes (␣ y ). El crecimiento de los filamentos de actina tiene lugar en ambos extremos, si bien uno de ellos ( «extremo romo» o extremo positivo) aumenta de tamaño con may or rapidez que el otr o («extremo puntiagudo» o extremo negativo). Los nombres se deben al aspecto de punta de fl echa de la cabeza de la miosina unida en ángulo a la actina. Los filamentos de actina se ramifi can en el margen adelantado (lamelipodio) de las células que inter viene en la motilidad celular y en la interacción con otros tipos celulares. La actina F comienza a ramifi carse a partir de la cara lateral de un filamento de actina preexistente por acción de Arp2/3 (proteína relacionada con actina), un complejo nucleador de actina compuesto por siete pr oteínas (fig. 1-26 ). La formina regula el ensamblaje de la actina no ramifi cada en las pr oyecciones celulares, como las microvellosidades intestinales (v. fig. 1-25). Los monómeros de actina poseen un sitio de unión para trifosfato de adenosina (ATP), el cual se hidroliza a difosfato de adenosina (ADP) conforme avanza el proceso de polimerización. La polimerización de la actina depende del A TP (v. cuadro 1-E). La cinética de la polimerización de actina implica un mecanismo denominado«cinta continua»: los monómeros de actina G ensamblados en un extr emo del filamento se separan simultáneamente del otr o extremo (v. fig. 1-26). Cuatro tipos de pr oteína controlan la «cinta continua» (v. fig. 1-26), como se detalla a continuación: 1. Latimosina secuestra agregados de monómeros de actina en el interior de las células. 1. EPITELIO C0005.indd 23 | 23 3/5/12 10:48:56 AM Figura 1-26. Papel de las proteínas de unión a actina en el ensamblaje y desensamblaje de la actina F La actina G transporta una molécula de ATP (una por monómero) Timosina Extremo romo Profilina Extremo romo Polimerización Se forma una caperuza de ATP que facilita la adición de nuevos monómeros de actina G. Se hidroliza ATP. La actina G porta moléculas de ADP unidas. La gelsolina corta los filamentos de actina y se une al extremo positivo recién formado para impedir su ulterior polimerización (cobertura). Arp2/3 —un complejo formado por siete proteínas— inicia la polimerización de la actina F desde los laterales de un filamento preexistente. Filamento de actina cortado Extremo romo con caperuza Gelsolina, una proteína con funciones de escisión y cobertura Extremo puntiagudo Extremo en despolimerización de un filamento de actina en crecimiento La profilina regula el ensamblaje de los filamentos al catalizar el intercambio del ADP unido a la actina G por ATP y propicia la transferencia de monómeros de actina desde la timosina hacia el extremo romo del filamento de actina. ADP Actina G con ADP unido El concepto de cinta continua se refiere al equilibrio dinámico existente entre los extremos de polimerización y despolimerización para mantener la longitud de los filamentos de actina. Cuadro 1-E | Microfilamentos • Los microfilamentos se componen de actina G, monómeros globulares que se polimerizan en presencia de ATP para dar lugar a un polímero filamentoso largo, la actina F, de 7 nm de espesor. • La actina F presenta una polaridad definida: un extremo romo o de polimerización y un extremo puntiagudo o de despolimerización. La profilina lleva a cabo dos funciones: corta la actina F y regula su ensamblaje al catalizar el intercambio del ADP unido a la actina G por ATP. La cofilina es un factor de despolimerización. El complejo Arp2/3 pone en marcha la ramificación de la actina F. • La cinta continua, el equilibrio dinámico entre los extremos en polimerización y despolimerización de la actina F. 24 | C0005.indd 24 La faloidina se une a los filamentos de actina para impedir su despolimerización. La faloidina unida a un colorante fluorescente se utiliza para teñir los filamentos de actina en las células. Se trata de un alcaloide producido por el hongo Amanita phalloides. 7 nm de espesor Extremo puntiagudo Despolimerización ATP Las citocalasinas se unen al extremo en crecimiento rápido (extremo positivo), lo que impide la incorporación de nuevos monómeros de actina G. Se forma una caperuza de citocalasina. Las citocalasinas son alcaloides sintetizados por hongos. Extremo romo El extremo en crecimiento de un filamento de actina en proceso de polimerización Proteínas secuestradoras/reguladoras La timosina secuestra la actina G en un depósito de reserva; la profilina se une a la actina G y regula el ensamblaje de los filamentos. La cofilina, un factor de despolimerización de la actina, estimula la disociación de la actina y el ADP unido a ella. Extremo puntiagudo Las latrunculinas alteran los filamentos de actina al unirse a la actina G e inducen de forma directa la despolimerización de la actina F. Provienen de la esponja Latrunculla magnifica, que coloniza el mar Rojo. Un filamento de actina tipo cinta continua está formado por monómeros de actina G unidos a ATP en el extremo romo, mientras que los situados en el puntiagudo están asociados a moléculas de ADP. 2. La profilina impide la enucleación de la actina G y fav orece el alargamiento de la actina F en el extr emo romo. La pr ofilina potencia el ensamblaje de los monómeros de actina G en fi lamentos al facilitar el inter cambio de ADP asociado por ATP. Tan sólo los monómer os de actina unidos a A TP se ensamblan para formar filamentos. 3. Lacofilina (también llamada factor despolimerizador de actina) pone en mar cha la despolimerización de la actina asociada a ADP en el extr emo puntiagudo. De forma semejante a las dos anterior es, la cofilina forma un complejo dimérico con la actina G. 4. Lagelsolina lleva a cabo una doble función: actúa como proteína de cubierta y evita la pérdida y la adición de monómer os de actina, que también lo hace como proteína de cor te. En presencia de Ca 2+, la gelsolina fragmenta los fi lamentos de actina y se mantiene unida al extremo romo, de modo que forma una caperuza que impide el crecimiento de los fi lamentos. El ensamblaje de los monómeros de actina G en fi lamentos y la organización de estos en haces gr uesos está sometida al contr ol de div ersos tipos de proteínas de unión a actina o r elacionadas con actina. Unas proteínas semejantes a la actina, la villina y la fimbrina, mantienen unido un haz de filamentos paralelos no ramificados de actina que conforman el eje de la microvellosidad. El haz se ancla a la membrana Histología y biología celular. Introducción a la anatomía patológica 3/5/12 10:48:57 AM Cuadro 1-F | Síndrome de Wiskott-Aldrich • El complejo Arp2/3 es necesario para la enucleación del ensamblaje de los entramados de filamentos de actina. La función de las células fagocíticas y las plaquetas depende de la presencia de un esqueleto funcional de actina. • Un gran número de proteínas activa el complejo Arp2/3. En ausencia de las mismas, este complejo es inactivo. • Dos proteínas clave que se unen al complejo Arp2/3 para activarlo son la familia de proteínas del síndrome de Wiskott-Aldrich, (WASP) integrada por varios componentes (WASP, WASP neuronal [nWASP] y SCAR/WAVE 1-3 [supresor del receptor de cAMP/proteína homóloga de verprolina de la familia WASP 1-3]). Otros miembros pertenecen a la familia de la cortactina, a la que pertenecen esta y la proteína específica hematopoyética. • Las mutaciones del gen WASP, localizado en el cromosoma X, se asocian a infecciones respiratorias recidivantes (función defectuosa de los linfocitos T y B), la disminución del número de plaquetas (trombocitopenia), que incrementa la tendencia a la hemorragia, y el eccema cutáneo. El síndrome de Wiskott-Aldrich afecta a los hombres pero no a las mujeres. plasmática a través de los braz os laterales de la miosina I y la proteína quelante de Ca2+ calmodulina (v. fig. 1-25). Arp2/3 y otras pr oteínas reguladoras forman un complejo de enucleación para el ensamblaje de los filamentos ramificados de actina. Estos filamentos se ensamblan en el margen adelantado de la célula en mo vimiento. En la micr ovellosidad, las forminas (unas proteínas con unos dominios muy conser vados de homología con formina, FH1 y FH2), en lugar del complejo ARp2/3, par ecen controlar el alargamiento de los filamentos no ramifi cados de actina mientras permanecen unidas al extremo romo (v. cuadro 1-E). Las forminas se localizan en el extremo de la microvellosidad, la región de la caper uza (v. fig. 1-25). Los hombres portadores de anomalías en pr oteínas activadoras del complejo Arp2/3 y, especialmente, en una pr oteína de la familia de proteínas del síndrome de Wiskott-Aldrich (WASP), presentan infecciones respiratorias recidivantes como consecuencia de la inmunodefi ciencia hereditaria que cursa con tr ombocitopenia (número bajo de plaquetas) desde su nacimiento y el eccema cutáneo a par tir del primer mes de vida (v. cuadro 1-F). La mutación se her eda de la madre, portadora sana de la mutación génica. Las microvellosidades y los ester eocilios son estr ucturas comparables, aunque se diferencian por su longitud y por el númer o de fi lamentos de actina: las microvellosidades intestinales presentan una longitud de 1-2 m, tienen un gr osor de 0,1 m y se componen de 20 a 30 haces de filamentos de actina; los estereocilios de las células ciliadas del oído interno muestran una morfología afilada en su base y una longitud comprendida entre 1,5 y 5,5 m, y cada haz de actina contiene hasta 900 fi lamentos de esta molécula. Las células ciliadas son muy sensibles a los desplazamientos mecánicos y cualquier mo vimiento leve de uno de ellos se amplifi ca en cambios del potencial eléctrico que se transmiten hacia el encéfalo . Las células ciliadas del oído interno se tratan en el capítulo 9, «Órganos sensoriales: visión y audición». © Elsevier. Fotocopiar sin autorización es un delito . Microtúbulos Los microtúbulos están formados por dímeros de tubulina (fig. 1-27 v. ; cuadro 1-G). Cada uno de estos dímer os se compone de dos moléculas de tubulina unidas de forma estrecha: ␣-tubulina y -tubulina. Las subunidades de tubulina se disponen en unas hileras longitudinales llamadas protofilamentos. La asociación de 13 pr otofilamentos uno al lado del otr o da lugar a un cilindr o de microtúbulos con un eje central hueco. El diámetro del microtúbulos es de 25 nm. De forma similar a los fi lamentos de actina, la estr uctura de los micr otúbulos está polarizada. Poseen un extremo positivo, que se alarga con may or rapidez que el extremo negativo (v. fig. 1-27). A diferencia de dichos fi lamentos, casi todos los micr otúbulos individuales sufren etapas alternas de crecimiento lento y despolimerización rápida. Este proceso, conocido como inestabilidad dinámica, engloba tr es pasos fundamentales: 1) una fase de polimerización, en la que se añaden subunidades de GTP-tubulina al extremo positivo del microtúbulos y se une una caperuza de GTP que facilita el alargamiento posterior; 2) liberación de fosfato hidr olizado (Pi) del GTP unido a la tubulina, y 3) una fase de despolimerización, en la que se escinden subunidades de GTP-tubulina del extremo negativo a una v elocidad alta. La fr ecuencia transicional de la polimerización a la despolimerización recibe el nombre de catástrofe, mientras que la frecuencia transicional de la despolimerización a la polimerización se denomina rescate. Las proteínas asociadas a los micr otúbulos (MAP) modifican la estabilidad de estas estructuras. Las MAP se dividen en dos gr upos: 1) MAP clásicas, como MAP1A, MAP1B, MAP2 y tau, y 2) MAP no clásicas, como miembr os de las familias Lis1 y DCX. Las MAP estabilizan a los micr otúbulos mediante la fosforilación/desfosforilación. En el capítulo 7, «Tejido muscular», se abor dará la importancia de la fosforilación y la desfosforilación mediada por tau en la enfermedad de Alzheimer. La ausencia de expr esión de Lis1 da lugar a una grav e enfermedad congénita del encéfalo conocida como lisencefalia. Centrosoma: un centro organizador de microtúbulos El centrosoma desempeña tres funciones principales: 1) nuclea la polimerización de las subunidades de tubulina para formar microtúbulos; 2) organiza los microtúbulos en unidades funcionales, y 3) se duplica una v ez en cada ciclo celular. 1. EPITELIO C0005.indd 25 | 25 3/5/12 10:48:57 AM Cuadro 1-G | Microtúbulos • Los microtúbulos están formados por dímeros de tubulina, ␣ y , que se polimerizan en presencia de GTP para originar hileras longitudinales de protofilamentos. La asociación de 13 de estos protofilamentos da lugar a un cilindro o microtúbulo de 25 nm de diámetro. • Los microtúbulos presentan una polaridad definida: un extremo positivo o de polimerización y un extremo negativo o de despolimerización. • Los microtúbulos sufren fases alternas de crecimiento y despolimerización rápidos, un proceso llamado inestabilidad dinámica. • Los centríolos, los cuerpos basales y los axonemas de los cilios y los flagelos contienen microtúbulos en una disposición determinada. • La cinesina y la dineína citoplásmica, dos proteínas motoras moleculares, utilizan los microtúbulos como vías para el transporte de mercancías, contenidas o no en vesículas. Figura 1-27. Ensamblaje de un microtúbulo Dímero de tubulina β-tubulina α-tubulina GTP GTP Ensamblaje Extremo positivo Una caperuza de GTP hace posible la incorporación de nuevos dímeros de tubulina Extremo en polimerización rápida β-tubulina La mayoría de los microtúbulos individuales pasan por fases alternas de crecimiento lento y despolimerización, un proceso llamado inestabilidad dinámica. La inestabilidad dinámica se debe a la hidrólisis de los dímeros de tubulina unidos a GTP, la liberación del fosfato hidrolizado y la posterior liberación de las subunidades de GDP-tubulina. Extremo negativo Extremo de polimerización lenta Cada protofilamento presenta una polaridad estructural definida: la β-tubulina está expuesta en un extremo (el extremo positivo), mientras que la α-tubulina lo hace en el extremo contrario (el extremo negativo). La polaridad es un aspecto clave de la dinámica de la polimerización de microtúbulos y el movimiento direccional de los orgánulos a lo largo de los microtúbulos y la separación de los cromosomas durante la división celular. α-tubulina Un protofilamento es una hilera lineal vertical de unidades de tubulina α y β que se alternan a lo largo de él. 25 nm de diámetro Cuadro 1-H | Diferencias entre los centrómeros y los cinetocoros • A menudo, los términos centrómero y cinetocoro se aplican como si de sinónimos se tratara, aunque no tienen el mismo significado. • El centrómero (no el centrosoma) es el sitio cromosómico asociado a los microtúbulos del huso mitótico. Los centrómeros se reconocen citológicamente como una región angosta de cromatina en los cromosomas metafísicos, llamada constricción primaria, que contiene ADN centromérico. • El cinetocoro se compone de proteínas asociadas a la cromatina centromérica de las cromátidas hermanas. El ensamblaje del cinetocoro depende exclusivamente de la presencia de secuencias de ADN centromérico. El centrómero y el cinetocoro intervienen en la unión de los microtúbulos cinetocóricos al huso. 26 | C0005.indd 26 Los microtúbulos son cilindros huecos formados por 13 moléculas de tubulina en disposición concéntrica que rodean a un canal central o luz. Los centrosomas se componen de un par de centríolos rodeados de material pericentriolar, una sustancia amor fa electrodensa en la que abundan div ersas proteínas, como la pericentrina y la ␥-tubulina. Los centrosomas pertenecen al centro mitótico, el cual conforma el aparato mitótico (o meiótico) junto al huso mitótico (fig. 1-28 ).El centríolo es un cilindro de pequeño tamaño (0,2 m de ancho y 0,4 m de largo) formado por nuev e tripletes de microtúbulos en una disposición helicoidal. A diferencia de la mayoría de los microtúbulos citoplásmicos, caracterizados por la inestabilidad dinámica, los del centríolo destacan por su gran estabilidad. Los centríolos se disponen formando ángulos r ectos entre sí a lo largo de la interfase. Se replican con anterioridad a la mitosis y forman dos pares. En el transcurso de la mitosis, los par es se localizan en extr emos opuestos de la célula, en los que dirigen la formación del huso mitótico o meiótico. Se distinguen tres tipos de microtúbulos que parten de los centrosomas: microtúbulos radiados o astrales, encargados de anclar cada centr osoma a la membrana plasmática; microtúbulos cinetocóricos, que unen el cinetocoro cromosómico a los centrosomas; y los microtúbulos polares, que se extienden desde ambos polos del huso en el que se encuentran los centr osomas opuestos (v. fig. 1-28). Los cromosomas no se pueden separar de forma corr ecta cuando los cinetocor os no se han ensamblado (v. cuadro 1-H). El material pericentriolar contiene el complejo anular de ␥-tubulina y un gran número de pr oteínas, como la pericentrina. Cada complejo anular de ␥-tubulina Histología y biología celular. Introducción a la anatomía patológica 3/5/12 10:48:57 AM Figura 1-28. Aparato mitótico El aparato mitótico (o meiótico) consta de dos componentes: 1. El centro mitótico 2. El huso mitótico Los tres componentes del centro mitótico son el centro organizador de microtúbulos que rodea un par de centríolos y microtúbulos radiados (también conocidos como microtúbulos astrales) que anclan el centro mitótico a la membrana plasmática. El huso mitótico está formado por dos clases principales de microtúbulos que parten del centro mitótico: los microtúbulos cinetocóricos, anclados a los centrómeros de los cromosomas metafísicos, y los microtúbulos polares, que se solapan entre sí en el centro de la célula y no se asocian a los cromosomas. Microtúbulos radiados Microtúbulos cinetocóricos Centro organizador de microtúbulos Microtúbulos polares Huso mitótico Centríolos La proteínas motoras (dineína/ dinactina) desplazan los cromosomas a lo largo de los microtúbulos cinetocóricos a medida que estos se acortan —en la dirección de la flecha— en el cinetocoro como consecuencia de la pérdida de tubulina-GDP Centro mitótico Cromosoma Centrómero Cinetocoro Microtúbulo cinetocórico Los cinetocoros están formados por varias proteínas ensambladas en el ADN centromérico en el transcurso de la mitosis y la meiosis. La región del cromosoma en la que tiene lugar el ensamblaje del cinetocoro es el centrómero. Cinetocoro Cromosoma Dineína/dinactina Tubulina-GDP ADN centromérico representa el lugar de enucleación o el molde para el ensamblaje y el alargamiento de un microtúbulo. Los centríolos no inter vienen directamente en la enucleación de microtúbulos en el centrosoma. Los dímeros de tubulina se asocian al anillo de ␥-tubulina a través de la subunidad de ␣-tubulina. Por tanto, el extremo negativo de cada microtúbulo se orienta hacia el centrosoma, y el positivo, en proceso de alargamiento, hacia fuera y queda libr e en el citoplasma. © Elsevier. Fotocopiar sin autorización es un delito . Microtúbulos en cilios y flagelos Los centríolos dan lugar a los cuerpos basales, de estructura similar, a partir de los cuales se forman los cilios (v . fig. 1-5) y los fl agelos. El síndrome de Bardet-Biedl se debe a una alteración del ensamblaje de los cuerpos basales y los cilios debida al transporte anómalo de proteínas filiares (v. cuadro 1-I). Los cilios y los fl agelos son proyecciones citoplásmicas móviles que contienen un eje de micr otúbulos denominado axonema (fig. 1-29). Este consta de nueve dobletes de microtúbulos periféricos que se disponen alrededor de un par central de micr otúbulos. Esta organización se conoce como confi guración 9 + 2 (v. cuadro 1-J). Cada doblete periférico se compone de un micr otúbulo completo (denominado túbulo A, con 13 protofilamentos) que comparte su pared con un segundo microtúbulo parcialmente completo (túbulo B, con 10-11 protofilamentos). Los espolones radiales parten del túbulo A hacia la v aina interna amorfa que rodea el par central de micr otúbulos. Los dobletes periféricos adyacentes se unen a través de la pr oteína nexina. Desde ambos laterales de túbulo A se pr oyectan dos conjuntos de braz os proteicos: Cuadro 1-I | Síndrome de Bardet-Biedl los brazos interno y externo de dineína, una adenosina trifosfatasa (ATPasa) asociada a • El síndrome de Bardet-Biedl (BBS) es un trastorno los microtúbulos. En presencia de ATP, los cilios y flagelos se inclinan como consecuencia pleiotrópico (multisistémico) que se manifiesta con dis- del deslizamiento de los dobletes periféricos en r elación con los demás. El deslizamiento trofia retiniana asociada a la edad, obesidad, polidactilia, y la fl exión de los microtúbulos son los mecanismos básicos de su mo vimiento. displasia renal, anomalías del aparato reproductor y dificultades de aprendizaje. • El BBS se debe a una alteración de los cuerpos basales y los cilios por una disfunción del transporte basado en los microtúbulos (transporte intraciliar), el cual es necesario para el ensamblaje, el mantenimiento y el funcionamiento de los cuerpos basales, los cilios y los flagelos (transporte intraflagelar). • Se han identificado ocho genes BBS (BBS1-8). No se conoce bien el origen del grado de variabilidad clínica de la BBS. Importancia clínica: fármacos contra los microtúbulos y esterilidad Se dispone de dos gr upos de fármacos antimitóticos que actúan sobr e los microtúbulos: compuestos desestabilizadores de los micr otúbulos, los cuales inhiben su polimerización, y compuestos estabilizadores de los microtúbulos, que influyen en su función al eliminar la inestabilidad dinámica. El primer gr upo engloba la colchicina, la colcemida, la vincristina y la vinblastina, que se unen a la tubulina para inhibir la polimerización de los micr otúbulos, lo que supone la parada de la mitosis. La colchicina forma par te del tratamiento clínico de la gota. La vincristina y la vinblastina, deriv ados de alcaloides Vinca 1. EPITELIO C0005.indd 27 | 27 3/5/12 10:48:57 AM Figura 1-29. Axonema Una de las principales funciones de la vaina interna y de los espolones radiales es la estabilización de la inclinación del axonema. Las tectinas son proteínas filamentosas que se extienden a lo largo de los microtúbulos. Junto a los enlaces de nexina, las tectinas crean un andamiaje para los microtúbulos o bien intervienen en el ensamblaje de las estructuras asociadas al axonema. Espolón radial Vaina interna 9 Túbulo A (13 protofilamentos) Túbulo B (10-11 protofilamentos) Brazo externo de dineína 1 Túbulo A 2 8 3 Enlace de nexina 7 Espolón radial 4 Tectina Brazo externo de dineína 6 Brazo interno de dineína Membrana plasmática 5 Par central de microtúbulos (cada uno con 13 protofilamentos) La posición relativa de los túbulos A y B y de sus brazos laterales de dineína confiere una polaridad definida y una orientación en el sentido de las agujas del reloj al corte transversal del axonema (dirección 1 a 9). Cuadro 1-J | Componentes principales de los axonemas ciliar y flagelar • Microtúbulos: principal componente del axonema. Las proteínas motoras emplean los microtúbulos del axonema como vías para el transporte intraciliar o intraflagelar de mercancías. De igual modo, el transporte axónico basado en los microtúbulos depende de las proteínas motoras. • Tectinas: proteínas semejantes a los filamentos intermedios que se extienden a lo largo de los microtúbulos del axonema y parecen conferir resistencia mecánica adicional a este. • Brazos de dineína: ATPasa responsable del movimiento ciliar y flagelar. Las cabezas se encuentran en contacto con los microtúbulos externos adyacentes a una distancia periódica y se desplazan a lo largo de ellos. • Enlaces de nexina: una organización semejante a un cinturón que estabiliza a los nueve pares concéntricos externos de los microtúbulos. • Espolones radiales: se proyectan desde cada uno de los nueve dobletes externos de los microtúbulos hacia la vaina interna que rodea al par central. • Vaina interna: una estructura que rodea el par central de microtúbulos y se encuentra en contacto con el extremo globular de los espolones radiales. 28 | C0005.indd 28 Túbulo B Cilios (corte transversal) aislados de las hojas de la planta vincaper vinca, son efi caces frente a neoplasias hematológicas infantiles (leucemias). La neur otoxicidad, debida a la alteración del flujo axónico dependiente de micr otúbulos —desaparición de los micr otúbulos y de la unión de pr oteínas motoras a micr otúbulos— y la mielodepr esión son dos efectos secundarios de los fármacos fr ente a los microtúbulos. En el segundo gr upo figura el paclitaxel (procedente de la cor teza del tejo) y su efecto es el contrario: estabiliza los micr otúbulos en lugar de inhibir su ensamblaje (fig. 1-30). El paclitaxel se ha utilizado de forma frecuente como tratamiento del cáncer de mama y o várico. De manera similar a los alcaloides de la vinca, sus principales efectos secundarios son la neur otoxicidad y la supresión de la hematopoyesis. El síndrome de Kartagener es un trastorno autosómico recesivo que suele cursar con bronquiectasias (dilatación permanente de br onquios y bronquíolos) y esterilidad en el hombre. Este síndrome se debe a la existencia de anomalías estr ucturales en el ax onema (dineína defectuosa o ausente) que impiden el aclaramiento mucociliar en las vías r espiratorias (lo que origina infecciones persistentes) y reduce la movilidad de los espermatozoides y el transporte del óvulo en el o viducto (lo que da lugar a esterilidad). Microtúbulos: vías del citoesqueleto para el transporte de mercancías por acción de las proteínas motoras El transporte de mercancías mediante vesículas u otros medios tiene lugar a lo largo de los microtúbulos y la actina F. Algunos motores moleculares específicos se asocian a los microtúbulos y la actina F para movilizar mercancías hacia determinados sitios intracelulares. Los motores moleculares basados en los microtúbulos para el transporte a larga distancia de mercancía son la cinesina y la dineína citoplásmica. Los motores basados en la actina F son las miosinas no conv encionales Va y VIIa, encargadas del transporte a corta distancia. En el capítulo 11, «S istema tegumentario», se comentan otr os aspectos del mecanismo de transpor te de mer cancías basado en la actina F en r elación con el transpor te de los melanosomas. A continuación, se describen tr es ejemplos de transpor te de mercancías basado en los microtúbulos en mamíferos (v. cuadro 1-K): Histología y biología celular. Introducción a la anatomía patológica 3/5/12 10:48:57 AM Figura 1-30. Compuestos que bloquean la función de los microtúbulos β-tubulina α-tubulina La unión de la colchicina a dímeros de tubulina impide su ensamblaje para formar microtúbulos. Igualmente, la vinblastina y la vincristina, que forman parte de tratamientos antitumorales, inhiben la polimerización de la tubulina. El nocodazol es otra proteína inhibidora de la polimerización de tubulina. Extremo positivo Complejo tubulina-colchicina El paclitaxel se une a los microtúbulos para impedir su polimerización. Esta molécula interrumpe la mitosis al alterar el ensamblaje y el desensamblaje dinámicos del huso mitótico necesario para la segregación de los cromosomas a las células hijas. Los fármacos antimitóticos son unos potentes inhibidores de la polimerización y la despolimerización de los microtúbulos del huso mitótico. Estos compuestos se unen a distintos sitios de la molécula de la tubulina y su combinación puede ser más eficaz desde el punto de vista terapéutico. Extremo negativo © Elsevier. Fotocopiar sin autorización es un delito . Cuadro 1-K | Transporte de mercancías basado en los microtúbulos por los motores moleculares • Los microtúbulos participan en el tráfico intracelular de material o mercancías incluidos o no en vesículas. • Las proteínas motoras moleculares, como la cinesina y la dineína citoplásmica, se encargan del transporte de mercancías a larga distancia, mientras que el transporte a corta distancia se da en los filamentos de actina. • Se conocen tres sistemas de transporte principales basados en los microtúbulos: 1) transporte axonémico, el cual incluye el transporte intraciliar y el transporte intraflagelar; 2) transporte axónico, y 3) transporte intramanguito. • El transporte axonémico es un mecanismo clave para el suministro de dímeros de tubulina y otras moléculas al extremo distal de poli de los microtúbulos de cilios y flagelos. Los axonemas provienen de los cuerpos basales, unas estructuras derivadas de los centríolos que contienen microtúbulos. • El transporte axónico reviste una enorme importancia para el tráfico de vesículas cargadas con neurotransmisores en las sinapsis neuronales. • El transporte intramanguito es necesario en los episodios morfogenéticos durante el desarrollo de los espermatozoides. El manguito es una estructura temporal que contiene microtúbulos asociada a un anillo perinuclear que se ensambla durante el alargamiento de la cabeza de la espermátida y, posteriormente, se desorganiza. 1. Transporte axonémico, el cual engloba los fl agelos (transporte intraflagelar) y los cilios (transporte intraciliar) (fig. 1-31). En el transporte axonémico, la cinesina y la dineína citoplásmica mo vilizan las partículas a lo largo de los dobletes de micr otúbulos del axonema. El transporte axonémico defectuoso se traduce en el ensamblaje anómalo de los cilios y de los flagelos, lo que se asocia a enfermedad renal poliquística, degeneración retiniana, disfunción ciliar respiratoria y agenesia de la cola del espermatozoide. Como se ha apuntado anteriormente (v . cuadro 1-H), el síndrome de Bardet-Biedl es un trastorno debido a la disfunción de los cuerpos basales/cilios como consecuencia de la producida en el transporte basado en los micr otúbulos. 2. Transporte axónico, a lo largo del axón de las neur onas (v. fig. 1-31). 3. Transporte intramanguito, a lo largo de los micr otúbulos de una estr uctura temporal formada por micr otúbulos, el manguito, que se organiza en el transcurso del alargamiento de la cabeza de la espermátida (v . capítulo 20, «Espermatogenia»). Transporte axónico Los axones son las pr oyecciones citoplásmicas de las neur onas encargadas de la conducción de los impulsos ner viosos. Las v esículas rodeadas de membrana que contienen neurotransmisores sintetizados en el soma de la neur ona viajan hacia la porción terminal del axón, en el que v acía su contenido en la sinapsis. Los haces de microtúbulos forman vías en el seno del axón para el transpor te de estas vesículas, el cual tiene lugar a través de dos pr oteínas motoras (v. fig. 1-31): 1. Cinesina 2. Dineína citoplásmica Las cinesinas y las dineínas citoplásmicas intervienen en dos tipos de mo vimiento de transporte intracelular: 1. Movimiento saltatorio, definido por el movimiento continuo y aleatorio de las mitocondrias y las v esículas. 2. Transporte axónico, un movimiento intracelular más dir ecto de estructuras limitadas por membranas. Las cinesinas y las dineínas citoplásmicas poseen dos cabezas de unión al A TP y una cola. La hidrólisis continua del ATP por acción de las ATPasas presentes en las 1. EPITELIO C0005.indd 29 | 29 3/5/12 10:48:58 AM Figura 1-31. Transporte intraciliar y axónico de mercancías Transporte intraciliar 1 El transporte anterógrado de mercancías a lo largo de un microtúbulo corre a cargo de la cinesina. Dímero de tubulina Microtúbulo Extremo negativo Cinesina Sitio de ensamblaje de la tubulina Extremo positivo Regreso de las proteínas balsa, proteínas del axonema ciliar o cualquier otro material al cuerpo celular. 1 Cuerpo basal Proteínas balsa 3 2 Dineína citoplásmica El mecanismo de transporte de mercancías múltiples podría basarse en un complejo de proteínas balsa. 2 El transporte retrógrado de mercancías a lo largo de un microtúbulo depende de la dineína citoplásmica. 3 Desensamblaje de la maquinaria motora molecular-mercancía complejo de proteínas balsa. Transporte axónico Neurona Extremo negativo Cinesina 1 El transporte anterógrado de una vesícula a lo largo de los microtúbulos depende de la cinesina. Microtúbulo Axón Extremo positivo Sinapsis 1 2 Vesícula sináptica reciclada Neurotransmisor 2 La dineína citoplásmica se ocupa del transporte retrógrado de una vesícula a lo largo de un microtúbulo. Aparato de Golgi Dineína citoplásmica Receptor del neurotransmisor liberado en la sinapsis cabezas da lugar a energía. Los dominios de las cabezas interaccionan con los microtúbulos, mientras que la cola se asocia a sitios de unión de r eceptores específicos localizados en la superfi cie de vesículas y orgánulos. La cinesina aprovecha la energía generada mediante la hidrólisis del A TP para transportar vesículas desde el soma de la neurona hacia la porción terminal del axón (transporte anterógrado). De igual modo, la dineína citoplásmica utiliza ATP como fuente de energía para desplazar v esículas en sentido contrario (transporte retrógrado). La familia de la miosina se asocia a la actina F para formar las estructuras contráctiles Las proteínas pertenecientes a la familia de la miosina se unen al A TP, al que hidrolizan, con el fin de obtener energía para desplazarse a lo largo de los filamentos de actina desde el extr emo puntiagudo (negativ o) hacia el r omo (positivo). La miosina I y la miosina II representan los dos miembros principales de la familia de la miosina ( fig. 1-32 ;v. cuadro 1-L). La miosina I, la cual es considerada una miosina no convencional, está presente en todos los tipos celulares, y consta de una cabeza y una cola. La cabeza se asocia a una única cabeza ligera, interacciona con los filamentos de actina y posee una ATPasa que permite el movimiento de la miosina I a lo largo de los fi lamentos mediante su asociación, separación y nueva unión. La cola se une a v esículas u orgánulos. El desplazamiento de la miosina I a lo largo de un filamento de actina supone el transporte de la vesícula o el orgánulo. Las moléculas de miosina I presentan un tamaño menor que el de las miosina II, car ecen de cola larga y no forman dímer os. 30 | C0005.indd 30 Histología y biología celular. Introducción a la anatomía patológica 3/5/12 10:48:58 AM Figura 1-32. Clases de moléculas de miosina y su funcionamiento Escisión proteolítica de la miosina II en sitios específicos Miosina II Subfragmento S1 Actina F Dominios de unión a actina y ATPasa. La cabeza de miosina II aporta la fuerza motriz para el movimiento. El ATP impulsa el movimiento de las cabezas de miosina a lo largo de los filamentos de actina. Bisagra proteolítica cabeza-cola Cadenas ligeras Meromiosina pesada (HMM) Bisagra proteolítica colaboración La miosina II posee una cola larga (150 nm), α-helicoidal enrollada, que permite el autoensamblaje de varias moléculas para formar un agregado bipolar o filamento. Meromiosina ligera (LMM) Región de autoensamblaje Monómero Dímero Tetrámero Agregado bipolar de moléculas de miosina II La base de la contracción muscular Extremo romo (positivo) Extremo puntiagudo (negativo) Actina F Extremo puntiagudo (negativo) Actina F 1 2 Actina F 1 La miosina II se desplaza a lo largo de la actina F hacia el extremo romo. Obsérvese que las cabezas apuntan en sentidos opuestos. 2 La unión de dos filamentos adyacentes de actina F en cualquiera de los extremos de un agregado bipolar provoca el movimiento de la actina F en sentidos contrarios (contracción). Miosina V Miosina I Actina F Actina F La miosina I (miosina no convencional) posee una cabeza única y una cola corta. La cola impulsa el movimiento de mercancías, como vesículas secretoras. Cabeza Dominio de unión a actina y ATPasa © Elsevier. Fotocopiar sin autorización es un delito . Extremo puntiagudo (negativo) Dominio de unión a actina y ATPasa Cabeza Cadena ligera Dominio de unión a mercancías Vesícula Cola Dominio de cola globular Proteína adaptadora Vesícula La miosina V (miosina no convencional) posee una cabeza doble con dominios ATPasa y de unión a actina F. Las colas terminan en un dominio globular que se une a vesículas por medio de una proteína adaptadora unida a Rab27a, el receptor de vesículas. Rab27a La miosina II, una miosina convencional, aparece tanto en las células musculares como en las no muscular es. La miosina II se compone de un par de moléculas idénticas. Cada una de ellas posee una cabeza con una A TPasa y una cola larga similar a un bastón. Las colas del dímero están en contacto en toda su longitud para formar un bastón enr oscado formado por dos hebras. La cola de la miosina II se autoensambla para crear dímeros, tetrámeros y un fi lamento bipolar en los que las cabezas se separan de la línea media. 1. EPITELIO C0005.indd 31 | 31 3/5/12 10:48:58 AM Cuadro 1-L | Tipos de miosinas • Las miosinas pertenecen a una gran familia de proteínas motoras que producen movimiento a lo largo de los filamentos de actina a partir de energía obtenida por hidrólisis de ATP. • Se distinguen dos grupos de miosinas: la miosina convencional, la miosina II, que impulsa la contracción muscular y los procesos contráctiles en células no musculares, y las miosinas no convencionales (no musculares) —las miosinas I y V, entre otras—, que intervienen en el movimiento de mercancías contenidas en vesículas en el seno de la célula. • La miosina II se compone de dos polipéptidos, cada uno de los cuales presenta una cabeza globular unida a una cola enroscada alrededor de la cola del polipéptido pareja. Las colas se autoensamblan para dar lugar a filamentos bipolares. Cada cabeza, que contiene también una cadena ligera, posee un sitio de unión a actina con actividad ATPasa, que es estimulada por la unión de actina y regulada por la cadena ligera. • La miosina I posee una cabeza solitaria y una cola más corta que la miosina II. No interviene en el transporte de vesículas a lo largo de los filamentos de actina F. • La miosina V cuenta con dos cabezas y dos colas enroscadas una a otra. Las cabezas contienen sitios de unión para el ATP y la actina. El extremo distal de las colas se recluta por medio de vesículas en un proceso en el que interviene el receptor de vesículas Rab27a. • La interacción de la miosina V con Rab27a participa en la transferencia de melanosomas desde los melanocitos a los queratinocitos. La transferencia defectuosa de melanosomas desde los melanocitos a los queratinocitos del tallo del cabello debido a una mutación de los genes Rab27a o miosina Va da lugar al síndrome de Griscelli de tipos I y II. Los sujetos aquejados de este síndrome presentan pelo canoso, albinismo parcial, alteraciones neurológicas ocasionales e inmunodeficiencia. Las dos cabezas —están unidas aunque apuntan en sentidos opuestos— se unen a los filamentos de actina adyacentes de polaridad opuesta. Cada cabeza de miosina asociada a la actina F se muev e hacia el extr emo romo (positivo). Por tanto, cada uno de los dos fi lamentos de actina se desplaza en relación con el otro y se produce la contracción (v. fig. 1-32). Las cabezas y las colas de la miosina II se escinden por acción de div ersas enzimas (tripsina o papaína) para dar lugar a la meromiosina ligera (LMM) y la meromiosina pesada (HMM). La LMM forma fi lamentos, si bien car ece de actividad ATPasa y no se asocia a la actina. La HMM se une a la actina, puede hidr olizar moléculas de ATP y no forma fi lamentos. Genera fuerza en el transcurso de la contracción muscular y puede escindirse en dos subfragmentos denominados S1, cada uno de los cuales contienen una porción ATPasa y cadenas ligeras, y puede asociarse a fi lamentos de actina. La miosina V, una miosina no convencional, posee una cabeza doble y una cola doble enroscada. La región de la cabeza se une a la actina F; los extremos globulares distales de las colas se unen a Rab27a, un receptor presente en las membranas de vesículas. La miosina Va interviene en el transpor te vesicular a lo largo de los trayectos de actina. E l transporte de melanosomas desde los melanocitos a los queratinocitos, el cual se realiza en primer lugar a lo largo de los microtúbulos y más tarde de la actina F, constituye un ejemplo específi co. Las mutaciones en los genes Rab27a y miosina Va dan lugar a alteraciones del transporte en la actina F. Un ejemplo de las mismas en el ser humano es el síndrome de Griscelli, un trastorno autosómico r ecesivo infrecuente caracterizado por la dilución del pigmento del pelo debido a anomalías en el transpor te de los melanosomas y asociado a anomalías de la actividad citotóxica de los linfocitos T y complicaciones de naturaleza neurológica. En la figura 1-33 se resumen las propiedades estructurales y funcionales de las proteínas motoras. Fosforilación de las cadenas ligeras por la cinasa de las cadenas ligeras de la miosina El autoensamblaje de la miosina II y su interacción con los fi lamentos de actina en las células no musculares tienen lugar en lugar es específicos definidos por las necesidades funcionales. Estos acontecimientos están sometidos al contr ol de la enzima cinasa de las cadenas ligeras de la miosina (MLCK), la cual fosforila una de las cadenas ligeras de la miosina (denominada cadena ligera reguladora) presentes en la cabeza de la miosina. La pr oteína quelante de Ca 2+, la calmodulina, regula la actividad de la MLCK (fig. 1-34 ). La MLCK presenta un dominio catalítico y un dominio regulador. La actividad 2+ cinasa se libera como consecuencia de la unión de la calmodulina y el Ca . El 2+ complejo MLCK-calmodulina-Ca cataliza la transferencia de un grupo fosfato del ATP a la cadena ligera de la miosina y esta se desplaza de forma cíclica a lo largo de la actina F para generar fuer za y contracción muscular. La fosforilación de una de las cadenas ligeras de la miosina pr oduce dos efectos: 1. Exposición del sitio de unión a actina de la cabeza de la miosina. Este paso reviste una importancia clave en la interacción de la cabeza de la miosina con el haz de actina F. Figura 1-33. Comparación de las proteínas motoras 32 | C0005.indd 32 Miosina I Miosina II Cinesina Dineína citoplásmica Número de cabezas Una Dos Dos Dos La cola se une a Membrana plasmática Miosina II Vesícula Vesícula La cabeza se une a Actina Actina Microtúbulo Microtúbulo Dirección del movimiento de la cabeza hacia Extremo romo (positivo) Extremo romo (positivo) Extremo positivo Extremo positivo Histología y biología celular. Introducción a la anatomía patológica 3/5/12 10:48:58 AM Figura 1-34. Fosforilación de las cadenas ligeras de miosina II en células no musculares En el músculo esquelético, la regulación de la interacción entre la actina y la miosina se basa en la unión de Ca2+ a la troponina. En el músculo liso y las células no musculares, la contracción está controlada por la fosforilación de una de las cadenas ligeras de la miosina. 1 La actividad de la cinasa de las cadenas ligeras de la miosina está bajo el control del complejo calmodulina-Ca2+. El aumento de las concentraciones citosólicas de Ca2+ induce la unión de la calmodulina al dominio regulador de la cinasa de las cadenas ligeras de la miosina. La unión de calmodulina y Ca2+ al dominio regulador de MLCK activa esta cinasa P P Cadena ligera de la miosina Dominio regulador Cinasa de las cadenas ligeras de miosina (inactiva) Fosforilación de la cadena ligera de la miosina 2 El complejo calmodulina Ca2+-cinasa de las cadenas ligeras de miosina activa fosforila la cadena ligera en presencia de ATP. La miosina inactiva se convierte en miosina activa, la cual se une a la actina F. Actina F Calmodulina Ca 2+ 1 P Miosina inactiva Dominio catalítico AD P Ca2+ 2 Las miosinas II inactivas tienen sus regiones de cola replegadas y están muy próximas a la cabeza de la miosina. Las miosinas II activas presentan colas extendidas. Miosina activa Complejo calmodulina-Ca2+ cinasa de las cadenas ligeras de miosina activa ATP Miosina activa 2. Liberación de la cola de la miosina de su sitio de inser ción pegajoso próximo a la cabeza de la miosina. S e trata de otro paso esencial, ya que tan sólo las colas de miosina extendidas pueden autoensamblarse para formar fi lamentos bipolares, un requisito para la contracción muscular (v . fig. 1-33). En las células del músculo liso, una fosfatasa elimina el grupo fosfato de las cadenas ligeras de la miosina. La contracción del músculo esquelético no depende de la fosforilación de dichas cadenas. La contracción muscular se abordará con mayor detalle en la sección en la que se describe el tejido muscular (v . capítulo 7, «Tejido muscular»). © Elsevier. Fotocopiar sin autorización es un delito . Filamentos intermedios Los filamentos intermedios ( fig. 1-35) conforman un gr upo heterogéneo de estructuras que reciben ese nombre debido a que su diámetro (10 nm) se encuentra a mitad de camino entre el de los micr otúbulos (25 nm) y el de los micr ofilamentos (7 nm). Los filamentos intermedios son los elementos citoesqueléticos más estables. Los tratamientos con detergentes y sales extraen los componentes de los micr otúbulos y los microfilamentos, mientras que los filamentos intermedios se mantienen insolubles. Todos los filamentos intermedios contienen un monómero formado por un bastón ␣-helicoidal acompañado de dominios de cabeza y cola ( fig. 1-36 ). La estructura del filamento intermedio no varía de un estado ensamblado a otro no ensamblado, como en el caso de los micr otúbulos y los micr ofilamentos. A diferencia de la actina y la tubulina, el ensamblaje y el desensamblaje de los filamentos intermedios están controlados por su fosforilación. Los monómeros proteicos de los fi lamentos intermedios se componen de tr es dominios (v. fig. 1-36): un dominio en forma de bastón ␣-helicoidal central fl anqueado por un dominio en bastón N-terminal no helicoidal y un dominio de cola C-terminal. A lo largo del proceso de ensamblaje, se asocian pares de dímeros, creados mediante la alineación paralela de monómer os, para formar tetrámeros en orientación laterolateral antiparalela. La alineación terminoterminal de alr ededor de ocho tetrámeros da lugar a un protofilamento. Los par es de pr otofilamentos se unen lateralmente para originar una protofibrilla, y cuatro de ellas —formadas por ocho protofilamentos— se pliegan para cr ear un fi lamento intermedio semejante a una cuerda (v. fig. 1-36). Los fi lamentos intermedios carecen de polaridad estr uctural, a 1. EPITELIO C0005.indd 33 | 33 3/5/12 10:48:58 AM Cuadro 1-M | Tipos de proteínas de los filamentos intermedios • Tipos I (ácidas) y II (básicas) Queratinas (40-70 kDa): las queratinas se organizan en forma de heteropolímeros de tipos I y II. Los distintos tipos de queratinas se coexpresan en las células epiteliales, el pelo y las uñas. En diversos trastornos cutáneos (enfermedades ampollosas y epidermólisis) aparecen mutaciones en los genes que codifican queratinas. • Tipo III (pueden autoensamblarse para formar homopolímeros) Vimentina (54 kDa): presente en células de origen mesenquimatoso. Desmina (53 kDa): componente de los discos Z del músculo estriado y las células del músculo liso. Proteína fibrilar glial ácida (GFAP 51 kDa): presente en los astrocitos. Periferina (57 kDa): forma parte de los axones del sistema nervioso periférico. • Tipo IV Neurofilamentos (NF): en las neuronas se coexpresan tres formas que se organizan en heteropolímeros: NF-L (ligera, 60 a 70 kDa), NF-M (mediana, 105 a 110 kDa) y NF-H (pesada, 135 a 150 kDa). ␣-internexina (66 kDa): componente de las neuronas en desarrollo. • Tipo V Laminas A y B (60-70 y 63-68 kDa, respectivamente): presentes en la lámina nuclear asociada a la capa interna de la envoltura nuclear. Mantienen la integridad de esta última. Un grupo de trastornos humanos —laminopatías— se asocian a mutaciones en el gen lamina A (LMNA) (v. cuadro 1-N). 34 | C0005.indd 34 Figura 1-35. Estructura fina de los principales componentes del citoesqueleto Filamentos intermedios (10 nm de espesor) Microtúbulos (25 nm de espesor) Haz formado por filamentos de actina (7 nm de espesor) diferencia de la actina F y los microtúbulos. Los extremos de un filamento intermedio no pueden distinguirse entr e sí. Los motor es moleculares asociados a un fi lamento intermedio tendrían difi cultades para discernir entre una dirección y otra. La función fundamental de los filamentos intermedios es aportar soporte mecánico a la célula. Se han identifi cado cinco tipos principales de pr oteínas en estos filamentos con arr eglo a la homología de secuencia del dominio de bastón. S e dividen en los tipos I a V (v. cuadro 1-M). Hasta ahora se han descrito alr ededor de 50 proteínas de los fi lamentos intermedios. Tipo I (queratinas ácidas) y tipo II (queratinas neutras a básicas). Esta clase de proteínas aparece en los fi lamentos intermedios del citoesqueleto de las células epiteliales (conocidas como citoqueratinas para difer enciarlas de las queratinas del pelo y de las uñas). Este tipo de fi lamento intermedio se compone de cantidades iguales de citoqueratinas ácidas (40-60 kD a) y neutras-básicas (50-70 kD a). Las queratinas de los tipos I y II forman tonofi lamentos asociados a distintas moléculas presentes en las placas citoplásmicas de los desmosomas y los hemidesmosomas (v. figs. 1-18 y 1-19 ). Retomaremos las proteínas de unión a los fi lamentos intermedios, como las filagrinas, en la sección r elativa a la difer enciación de los queratinocitos en la epidermis de la piel (v . capítulo 11, «S istema tegumentario»), y la plectina, en la corr espondiente a la r ed citoesquelética protectora presente en las células del músculo esquelético (v . capítulo 7, «Tejido muscular»). En la epidermis de la piel, las células basales expr esan las queratinas K5 y K14. Las células superiores en fase de difer enciación expresan las queratinas K1 y K10. La K9 se localiza en algunas z onas de la epidermis, como en el ár ea palmoplantar. Las mutaciones en K5 y K14 dan lugar a trastornos cutáneos ampollosos hereditarios pertenecientes al gr upo de la epidermólisis ampollosa simple (v. más adelante, «Importancia clínica: fi lamentos intermedios y enfermedades ampollosas»). Tipo III. Este grupo engloba las siguientes pr oteínas de los fi lamentos intermedios: Generalmente, la vimentina (54 kDa) aparece en células de origen mesenquimatoso. En algunas células, esta pr oteína crea una conexión estr uctural entre la membrana plasmática y las láminas nuclear es. La desmina (53 kDa) forma parte de las células del músculo esquelético y se localiza en el disco K del sarcómero (v. capítulo 7, «Tejido muscular»). Esta pr oteína de los filamentos intermedios mantiene unidos los componentes contráctiles individuales de los sarcómeros al disco Z e interviene en la coordinación de la contracción de las células musculares. De igual modo, se localiza en las células del músculo liso. La proteína gliofibrilar ácida (GFAP) (51 kDa) está presente en los astrocitos y algunas células de Schwann (v. capítulo 8, «Tejido nervioso»). Histología y biología celular. Introducción a la anatomía patológica 3/5/12 10:48:58 AM Figura 1-36. Ensamblaje de un filamento intermedio 1 Dos monómeros forman un dímero paralelo. 2 Dos dímeros (en disposición antiparalela laterolateral) forman un tetrámero. La polaridad desaparece como consecuencia de la adopción de una alineación antiparalela. 4 Los pares de protofilamentos se asocian lateralmente para crear una protofibrilla. 3 Los tetrámeros adoptan una alineación terminoterminal para dar lugar a un protofilamento. 10 nm 5 Cuatro protofibrillas se enroscan para originar un filamento intermedio similar a una cuerda de 10 nm de espesor. Monómero básico de un filamento intermedio Cabeza Bastón Cola C-terminal N-terminal © Elsevier. Fotocopiar sin autorización es un delito . 46 nm La periferina (57 kDa) forma parte de las neuronas del sistema nervioso periférico y se coexpresa junto a las proteínas de los neurofilamentos (v. capítulo 8, «Tejido nervioso»). Tipo IV. Los elementos más impor tantes son los neurofilamentos. Los neurofilamentos (NF) se encuentran en los ax ones y las dendritas de las neuronas. Un neurofilamento se compone de tr es tipos de pr oteínas: NF-L (60 a 70 kDa), NF-M (105 a 110 kD a), y NF-H (135 a 150 kD a), que constituy en neurofilamentos de peso molecular bajo, intermedio y alto, r espectivamente. La ␣-internexina (66 kD a) aparece fundamentalmente en el sistema ner vioso central (en especial, en la médula ósea y el ner vio óptico). Tipo V. Tres genes codifi can las proteínas pertenecientes a este gr upo, las laminas nucleares: LMNA, LMNB1 y LMNB2. Las laminas A y C se forman como consecuencia del corte y empalme alternativ o de los transcritos codifi cados por el gen LMNA. El gen LMNB1 codifica la lamina B1, la cual se expresa en todas las células somáticas. El gen LMNB2 codifica la lamina B2, que también se expr esa en todas las células somáticas, y la lamina B3, una proteína exclusiva de las células espermatogénicas. Las laminas nucleares (60-70 kDa) se diferencian de otras pr oteínas de los fi lamentos intermedios por su organización en una r ed ortogonal, la lámina nuclear, que se asocia a la membrana interna de la env oltura nuclear. Las laminas apor tan soporte mecánico a la env oltura nuclear y se asocian a la cr omatina. Por su importancia clínica, r etomaremos a las laminas nuclear es y las pr oteínas asociadas al abordar la organización de la env oltura nuclear. Un grupo de enfermedades humanas, que r eciben el nombr e de laminopatías, son secundarias a anomalías en las proteínas de la envoltura nuclear, como las laminas (v. cuadro 1-N). Muchas laminopatías afectan a los músculos cardíaco y esquelético, el tejido adiposo (lipodistrofias), y los ner vios periféricos motores y sensitivos. Se han propuesto dos hipótesis sobre el mecanismo patogénico de las laminopatías: 1. Según la hipótesis de la expresión génica, las laminas A y C son dos proteínas clave para la expresión correcta específica de tejido de algunos genes. 2. La hipótesis del estrés mecánico sostiene que las anomalías en las laminas A y C debilitan la integridad estr uctural de la envoltura nuclear. Durante la mitosis, la fosforilación de los residuos de serina de las laminas da lugar a un desensamblaje de la r ed, debido a que sucede la degradación de la envoltura nuclear en pequeños fragmentos. Al fi nal de la mitosis, se desfosforilan las laminas y se organizan de nuev o la red de laminas y la env oltura nuclear. En la 1. EPITELIO C0005.indd 35 | 35 3/5/12 10:48:59 AM Cuadro 1-N | Características clínicas de las laminopatías • Se dividen en tres grupos: distrofia muscular, lipodistrofia parcial y neuropatía. Debidas a mutaciones en los genes que codifican la lamina A o C y afectan a los músculos esquelético y cardíaco, y a la distribución del tejido adiposo. • La distrofia muscular de Emery-Dreifuss (fenotipo hereditario mediante mecanismo autosómico dominante y recesivo, y ligado al cromosoma X, este último debido a mutaciones en el gen emerina): contracturas en el tendón de Aquiles, debilidad muscular y caquexia graduales lentas, miocardiopatía con anomalías de la conducción. • Distrofia muscular de la cintura de las extremidades: debilidad muscular progresiva de la cintura pélvica, de la porción proximal del brazo y de los músculos de las extremidades inferiores. Miocardiopatía dilatada. • Enfermedad de Charcot-Marie-Tooth de tipo 2B1: neuropatía motora y sensitiva distal de las extremidades superiores, y proximal y distal de las inferiores. Nota: La enfermedad de Charcot-Marie-Tooth de tipo 1 ligada al cromosoma X se caracteriza, asimismo, por las neuropatías motoras y sensitivas en el sistema nervioso periférico, si bien se deben a una mutación en el gen conexina32 (Cx32) expresado en las células de Schwann. Afecta a la mielina. • Lipodistrofia parcial familiar de tipo Dunnigan: se manifiesta en la pubertad con pérdida de tejido adiposo subcutáneo del tronco y de las extremidades, y acumulación de tejido adiposo en la cara y el cuello. sección relativa al núcleo celular se describe el mecanismo de fosforilación y desfosforilación de las laminas durante el ciclo celular . Hemidesmosomas y filamentos intermedios Los hemidesmosomas constituy en uniones especializadas que apar ecen en las células basales del epitelio escamoso estratifi cado adosado a la membrana basal (fig. 1-37 ).En el inter ior de la célula, las pr oteínas BPAG1 (antígeno 1 del penfigoide ampolloso) y plectina (pertenecientes a la familia de la plaquinas de proteínas de entr ecruzamiento) se asocian a filamentos intermedios (también llamados tonofilamentos). La plectina conecta estos filamentos con la subunidad 4 de las integrinas. En la cara extracelular , la integrina ␣64, BPAG2 (antígeno 2 del penfi goide ampolloso) y la laminina 5, una proteína presente en unas estructuras especializadas denominadas filamentos de anclaje, conectan los hemidesmosomas a la lámina basal. La pr oteína relacionada con la plaquina BP AG1 se asocia a BP AG2, una proteína transmembrana portadora de un dominio colágeno extracelular . Es decir, BPAG1 actúa como puente entre la proteína transmembrana BPAG2 y los filamentos intermedios. La alteración de este puente, como en el caso del penfi goide ampolloso, provoca la separación de la epidermis de los sitios de anclaje en la lámina basal. BPAG1 y BPAG2 fueron identificados en sujetos con penfi goide ampolloso, una enfermedad autoinmunitaria. Importancia clínica: filamentos intermedios y enfermedades ampollosas El penfigoide ampolloso es una enfermedad ampollosa autoinmunitaria semejante al pénfigo vulgar (llamado «penfi goide»). En la zona de unión de la epidermis y la dermis aparecen ampollas o bullas como consecuencia de las reacciones cruzadas de la inmunoglobulina G (IgG) circulante con el antígeno 1 o 2 del penfi goide ampolloso. Los complejos I gG-antígeno así formados estimulan la pr oducción de complejos del complemento (C3, C5b y C9), los cuales dañan las uniones de los hemidesmosomas y alteran la síntesis de las pr oteínas de anclaje por las células basales (fig. 1-38 ). La producción de toxinas locales induce la desgranulación de los mastocitos y la liberación de factores quimiotácticos para los eosinófi los Las enzimas liberadas por estos últimos dan lugar a ampollas o bullas. Los filamentos intermedios r efuerzan el citoesqueleto celular . La expr esión de genes mutados de queratinas origina el ensamblaje anómalo de los fi lamentos de queratina, los cuales debilitan la r esistencia mecánica de la célula y dan lugar a afecciones cutáneas hereditarias, como indica la figura 1-39 : 1. Epidermólisis ampollosa simple, caracterizada por la formación de ampollas cutáneas debido a traumatismos leves. Se desarrolla como consecuencia de la expresión de los genes mutados de las queratinas 5 y 14. 2. Hiperqueratosis epidermolítica, en la cual se pr oduce una queratinización excesiva de la epidermis debido a la pr esencia de mutaciones en los genes de las queratinas 1 y 10. 3. Queratodermia palmoplantar epidermolítica, una enfermedad cutánea que se distingue por la fragmentación de la epidermis de las palmas de las manos y de las plantas de los pies, y se r elaciona con una mutación del gen de la queratina 9. NÚCLEO CELULAR Envoltura nuclear y complejo del poro nuclear El núcleo de las células de los mamífer os se compone de tres elementos principales: 1) la envoltura nuclear; 2) la cromatina, y 3) el nucléolo. La envoltura nuclear está formada por dos membranas concéntricas separadas por el espacio perinuclear . La membrana nuclear interna se asocia a la lámina nuclear (v. cuadro 1-O ),la cromatina y las ribonucleoproteínas. La membrana nuclear externa se continúa con las del retículo endoplásmico y puede asociarse a ribosomas. El complejo del poro nuclear presenta una estructura tripartita formada por un cuerpo cilíndrico central situado entr e los anillos octagonales interno y externo, cada uno de los cuales consta de ocho par tículas proteicas. El cilindro central se compone de un tapón central y ocho espolones radiales ( fig. 1-40 ).Se desconoce 36 | C0005.indd 36 Histología y biología celular. Introducción a la anatomía patológica 3/5/12 10:48:59 AM Figura 1-37. Estructura y composición de un hemidesmosoma Filamentos de queratina (tonofilamentos) Filamentos intermedios de queratina (tonofilamentos) Lámina Placa Membrana plasmática Lámina basal Plectina Placa Lámina BPAG1 (antígeno 1 del penfigoide ampolloso) 230 kDa Filamentos de anclaje BPAG2 (antígeno 2 del penfigoide ampolloso) 180 kDa Subunidad β4 de integrina Filamento de anclaje (laminina 5) BPAG1 (un miembro de la familia de las plaquinas) y BPAG2 (una proteína transmembrana con un dominio colagenoso extracelular) conectan la lámina basal a los filamentos intermedios. Lámina basal La plectina (un miembro de la familia de las plaquinas) y la subunidad β4 de la integrina (que forma un complejo con la subunidad α6) conectan la lámina basal con los filamentos intermedios. Hemidesmosomas cuál es la función exacta de cada proteína del complejo del poro nuclear en el tráfico nucleocitoplásmico. Los complejos del poro nuclear embebidos en la env oltura nuclear establecen vías de comunicación para el tráfi co de macr omoléculas entre el compar timento citoplásmico y el núcleo. Las moléculas de pequeño tamaño molecular (menores de 40-60 kDa) atraviesan por difusión el complejo de por o nuclear. Las proteínas de cualquier tamaño molecular que contienen la secuencia de aminoácidos de localización nuclear (NLS, Pro-Lis-Lis-Lis-Arg-Lis-Val) son importadas al núcleo a través de un mecanismo con gasto de energía (que pr ecisa de ATP y GTP). Figura 1-38. Origen del penfigoide ampolloso, un trastorno autoinmunitario © Elsevier. Fotocopiar sin autorización es un delito . 1 Un anticuerpo circulante contra el antígeno del penfigoide ampolloso (BPAG1 o BPAG2) estimula una respuesta local que induce la liberación del factor quimiotáctico de eosinófilos (ECF) por parte de los mastocitos para atraer a los eosinófilos. 2 Los eosinófilos secretan proteasas que degradan los filamentos de anclaje que unen la lámina de unión del hemidesmosoma a la lámina basal. Se forma una ampolla. 2 1 IgG Mastocito Factor quimiotático de eosinófilos Eosinófilos 1. EPITELIO C0005.indd 37 | 37 3/5/12 10:48:59 AM Figura 1-39. Enfermedades cutáneas producidas por mutaciones en las queratinas de los filamentos intermedios Queratodermia palmoplantar epidermolítica Queratina B (epidermis palmoplantar) Hiperqueratosis epidermolítica Queratinas 1 y 10 Capa córnea Capa granulosa Epidermis Capa espinosa Queratinas 5 y 14 Epidermólisis ampollosa simple Capa basal Lámina basal Fotografías tomadas de Callen JP, et al.: Color Atlas of Dermatology. Philadelphia, WB Saunders, 1993. Dermis Epidermólisis ampollosa simple Hiperqueratosis epidermolítica Mutación de queratinas 5 y 14. Se forman ampollas poco después del nacimiento en lugares sometidos a presión o fricción. Las ampollas se localizan en los dedos del lactante. Mutación de queratinas 1 y 10. La queratinización excesiva provoca la degradación de la epidermis. Queratodermia palmoplantar epidermolítica Mutación de la queratina 9. Este trastorno se limita a la epidermis de las palmas de las manos y de las plantas de los pies. Transporte nucleocitoplásmico: Ran-GTPasa Ran (GTPasa nuclear similar a Ras), una pequeña GTPasa de la super familia de Ras que determina la direccionalidad del transporte nucleocitoplásmico, controla la importación/exportación nuclear de proteínas. Ran atraviesa los poros nucleares para acumularse en el compar timento nuclear a través de un mecanismo de transpor te activo (fig. 1-41 ). 1. En el núcleo, se mantiene una concentración alta de Ran-GTP por acción de RCC1, una proteína de intercambio de GDP-GTP unida a la cr omatina. RanGTP determina la disociación de las pr oteínas importadas portadoras de NLS al unirse a la importina , la proteína receptora del transportador. 2. En el sentido contrario, del núcleo hacia el citoplasma, la unión de Ran-GTP a la proteína transportadora exportina/Crm 1 propicia el ensamblaje de complejos que contienen proteínas con la secuencia de exportación nuclear (NES). 3. En el citoplasma, Ran-GTP se convierte en Ran-GDP por acción de la RanGTPasa, activada por dos pr oteínas colaboradoras: Ran-GAP (proteína activadora de Ran-GTPasa) y RanBP (proteína de unión a Ran-GTP). P or tanto, la pr oteína exportada se separa de la r eceptora del transportador exportina/Crm1 y Ran-GTP. Las importinas y las exportinas se reciclan al ser transportadas de nuevo a través del complejo del poro nuclear. Por otra parte, Ran-GTPasa interviene en el ensamblaje del huso mitótico . Cromatina La cromatina se defi ne como partículas o «cuentas» (llamadas nucleosomas) sobre una cadena de ADN bicatenario ( fig. 1-42). Cada nucleosoma se compone de un núcleo de octámeros de histonas rodeado por alrededor de dos vueltas de ADN. E l octámero de histonas contiene dos moléculas de cada una de las histonas H2A, H2B, H3 y H4. La histona H1 establece enlaces cr uzados en la molécula de ADN que envuelve el octámero. La cromatina está condensada en cromosomas separados que pueden visualizarse en el transcurso de la mitosis (o la meiosis). Los cromosomas individuales no pueden identificarse durante la interfase (fases G1, S y G2 del ciclo celular), si bien se encuentran en un estado difuso o no condensado . 38 | C0005.indd 38 Histología y biología celular. Introducción a la anatomía patológica 3/5/12 10:49:00 AM Figura 1-40. Envoltura nuclear y complejo de poro nuclear Las nucleoporinas filamentosas Phe-Gly del canal central contienen sitios de anclaje para proteínas de mercancía-factor de transporte nuclear que pasan a través del canal desde el citoplasma o el núcleo. El conjunto de las proteínas del complejo del poro nuclear recibe el nombre de nucleoporinas Nucleoporina Phe-Gly Fibrilla proteica asociada a cada partícula proteica Canal central Partícula proteica del anillo citoplásmico octagonal Espolón radiado Citoplasma Factor de transporte nuclear Mercancía Espaciador Poro central Membrana nuclear externa Espacio perinuclear Membrana nuclear interna Partícula proteica del anillo nuclear octagonal Laminas A, B y C Mitocondria Cestillo nuclear Actina F Nesprina-1/2 Núcleo Actina F Proteína de filamentos intermedios Plectina Nesprina-3 Nesprina-1/2 Membrana nuclear externa Receptor de lamina B (LBR) Dímero Sun1 Espacio perinuclear Emerina Membrana nuclear interna Las laminas se unen a varias proteínas de la membrana nuclea interna: el receptor de lamina B (LBR), la emerina, los polipéptidos asociados a laminas 1C (LAP1C) y 2β (LAP2β). El dímero proteico Sun1 une las laminas a las nesprinas insertadas en la membrana nuclear externa. La nesprina 1/2 se asocia a la actina F y la nesprina 3 se une a la plectina, la cual se asocia, a su vez, a las proteínas de los filamentos intermedios. Las mutaciones de la emerina —que se une a las laminas A y B— y el receptor de la lamina B —que se une a la lamina B— dan lugar a la distrofia muscular de Emery- Dreifuss y la anomalía de Pelger-Huet en los granulocitos sanguíneos (diferenciación incompleta). La mutación homocigótica en el gen que codifica el receptor de lamina B origina la displasia esquelética de Greenberg, una condrodistrofia embrionaria mortal. Lamina B1/B2 Lamina A/C Poros nucleares Cromatina © Elsevier. Fotocopiar sin autorización es un delito . Polipéptido asociado a Polipéptido asociado lamina 1C (LAP1C) a lamina 2β (LAP2β) La cromatina difusa, denominada eucromatina («cromatina verdadera»), es activa desde el punto de vista de la transcripción (síntesis de ARN) y r epresenta alrededor del 10% de la cr omatina total. La eucr omatina es el lugar de síntesis de los precursores de los ARN no ribosómicos, como el ARNm y el ARN de transferencia (ARNt). La cromatina condensada, conocida como heterocromatina («cromatina diferente») no es activ a desde el punto de vista de la transcripción y corresponde aproximadamente al 90% de la cr omatina total ( fig. 1-43 ). Compensación de la dosis: inactivación de uno de los cromosomas X La inactivación al azar de uno de los dos cromosomas X en todas las células somáticas femeninas recibe el nombre de compensación de la dosis. Ambos cr omosomas X permanecen activos en los o vocitos. La inactivación tiene lugar al azar , ya que se 1. EPITELIO C0005.indd 39 | 39 3/5/12 10:49:01 AM Figura 1-41. La Ran-GTPasa dirige el transporte nucleocitoplásmico 1 En el citoplasma, Ran-GDP se asocia a las importinas β y α. Esta última reconoce la NLS de las proteínas de importación nuclear. La importina β se une a Ran-GDP. Ran aparece en dos formas que pueden unirse a GTP y GDP e interaccionan de forma diferente con las proteínas. Un gradiente de concentración de RanGTP/Ran-GDP a través de la envoltura nuclear controla el transporte direccional de muchas proteínas por los poros nucleares. La conversión entre ambas formas y el ensamblaje/desensamblaje de los complejos proteicos depende de proteínas reguladoras. Ran-GDP Citoplasma Proteína con secuencia de localización nuclear (NLS) GDP GDP Ran-GDP Pi Ran-GBP1 Ran-GDP Ran-GAP GDP Complejo importina α/β 4 En el citoplasma, la proteína exportada que contiene NES se separa de Ran GTP al interaccionar con Ran-GBP1, seguida de la hidrólisis del GTP inducida por Ran-GAP. Ran-GDP libera su mercancía y se prepara para la translocación de proteínas portadoras de NLS hacia el núcleo, como se muestra en 1 . GTP Importina β Envoltura nuclear Importina α 1 4 Complejo del poro nuclear Núcleo Proteína-NLS Exportina/Crm1 Importina β Ran-GDP GTP Ran-GTP Importina α RCC1 (intercambiador GDP-GTP) Ran-GTP GTP Cromatina 2 3 2 En el núcleo, tras la translocación del complejo proteico Ran-GDPimportina- αβ/NLS, se libera la importina β de Ran y la importina α se separa de la proteína con NLS, la cual queda libre. RCC1, una proteína intercambiadora de nucleótidos de guanina unida a la cromatina produce Ran-GTP. 3 En el núcleo, Ran-GTP se asocia a exportinas (p. ej., exportina Crm1) necesarias para la exportación al citoplasma de las proteínas portadoras de NES. • Las laminas, proteínas de los filamentos intermedios de tipo V, son los principales componentes de la lámina nuclear. • Las laminas se unen a proteínas de la membrana nuclear interna, como emerina (con ocho dominios transmembrana), receptor de lamina B, polipéptidos asociados a laminas 1 y 2, y nesprina-1␣, una proteína con varias repeticiones similares a espectrina que se une a lamina A y emerina (v. fig. 1-40). • Las laminas y las proteínas asociadas intervienen en la organización de la cromatina, el espaciamiento de los complejos del poro nuclear y el reensamblaje del núcleo tras la división celular. • Las mutaciones en los genes que codifican las laminas y las proteínas de unión a laminas dan lugar a diversas enfermedades (conocidas como laminopatías) (v. cuadro 1-L). El síndrome de progeria de Hutchinson-Gilford (envejecimiento prematuro) se debe a una mutación en el gen de la lamina A. C0005.indd 40 GTP GDP Cuadro 1-O | Lámina nuclear 40 | Proteína con secuencia de exportación nuclear (NES) inactiva el cromosoma X paterno o materno . La elección deja de ser aleatoria en la descendencia de estas células. La inactiv ación de la transcripción de uno de los dos cromosomas X tiene lugar el día 12 posterior a la fecundación en el tr ofoblasto y el día 16 en el embrión. En el ser humano, el cr omosoma X inactivado se reconoce por la pr esencia del corpúsculo de Barr, una masa de heter ocromatina próxima a la env oltura nuclear o un elemento en forma de palillo de tambor en los leucocitos polimor fonucleares (v. fig. 1-43). Si una célula posee más de dos cr omosomas X, los extranumerarios se inactivan y se visualiza más de un corpúsculo de B arr. Nucléolo El nucléolo representa el lugar de síntesis del ARN ribosómico (ARNr) y del ensamblaje de las subunidades r ibosómicas. Contiene diversas proteínas necesarias para el procesamiento del pre-ARNr, como la fibrilarina y la nucleolina. Contiene, además, la proteína nucleoestemina, relacionada con la biogenia del ribosoma. La nucleolina y la nucleoestemina son pr oteínas transportadoras que viajan desde el nucléolo hacia el nucleoplasma para interaccionar con la proteína p53, la cual confi ere protección frente a las lesiones en el ADN al impedir la r eplicación del ADN en condiciones de estrés genómico. Esta proteína se analiza en una sección posterior (v . fig. 1-54 ). En esencia, el nucléolo es una estr uctura nuclear multifuncional formada por proteínas estables que par ticipan en la síntesis ribosómica y en el transpor te de Histología y biología celular. Introducción a la anatomía patológica 3/5/12 10:49:02 AM Figura 1-42. Estructura de la fibra de cromatina: el nucleosoma El ADN se enrolla 1,65 veces alrededor del núcleo de octámeros de histonas H1, una histona de unión, se une al ADN enrollado alrededor del núcleo de octámeros de histonas El núcleo de octámeros de histonas se compone de dos moléculas de cada una de las histonas H2A, H2B, H3 y H4 Figura 1-43. Inactivación del cromosoma X Corpúsculos de Barr en células de un frotis del epitelio bucal Palillo de tambor en un neutrófilo © Elsevier. Fotocopiar sin autorización es un delito . Compensación de la dosis El cromosoma X inactivo continúa condensado durante la mayor parte de la interfase del ciclo celular. Aparece como una mancha de cromatina teñida intensamente (corpúsculo de Barr o cromatina X) en un número variable de núcleos (30-80%) de una mujer normal. Se observa un pequeño palillo de tambor en el 1-10% de los neutrófilos en las células femeninas. La inactivación de uno de los cromosomas X se produce de forma aleatoria (cromosoma X paterno o materno). Si la célula presenta más de dos cromosomas X, los cromosomas adicionales se inactivan y el número máximo de corpúsculos de Barr de cada núcleo será uno menos del número total de cromosomas X del cariotipo. Fibra de cromatina formada por la disposición linear de los nucleosomas Un nucleosoma (10 nm de diámetro) es la unidad estructural básica de la cromatina moléculas entre el nucléolo y el nucleoplasma para desempeñar funciones no nucleolares. Desde el punto de vista estr uctural, el núcleo consta de tr es componentes principales (fig. 1-44 ;v. cuadro 1-P). 1. Un centro fibrilar (que corresponde a la cromatina que contiene genes repetidos para ARNr, ARN polimerasa I y ARN de la partícula de reconocimiento de señales [SRP]). 2. Un componente fibrilar denso (que contiene ARNr naciente, el cual está sometido a algunas etapas de pr ocesamiento). Aparecen, además, la fibrilarina y la nucleolina. 3. Un componente granular (en el que concluye el ensamblaje de las subunidades ribosómicas, que contienen ARNr 18S [subunidad pequeña] y ARNr 28S [subunidad grande]). La nucleoestemina, una proteína sin relación con la biogenia de los ribosomas, coexiste con los componentes granular es. El nucléolo se disocia en el transcurso de la mitosis y er aparece de nuevo al comienzo de la fase G 1. En el núcleo puede aparecer más de una masa nucleolar, cada una de las cuales representa el pr oducto de un cr omosoma con una región organizadora del nucléolo (NOR). En algunas células con inter fase prolongada, como las neur onas, la fusión de varias masas nucleolares da lugar a un nucléolo solitario de gran tamaño . El proceso activo de síntesis de ARN se visualiza mediante micr oscopia electrónica (fig. 1-45) al extender el contenido nuclear de células con cientos de nucléolos (p. ej., ovocitos de anfibio). Los genes que codifican el ARNr aparecen en forma de unidades génicas repetidas en el hilo de la cromatina, de manera similar a «árboles de Navidad» que apuntan en la misma dir ección y están separados por secuencias espaciadoras no transcritas. Más de 100 moléculas de ARN polimerasa I que sintetizan un número equivalente de fibrillas, cada una de ellas dotada de un gránulo terminal, recubren la región correspondiente al ARNr. Cada fibrilla representa una molécula ribonucleoproteica precursora del ARNr (45S) con una orientación perpendicular al eje de cr omatina, de forma similar a las ramas de un árbol. E l precursor de ARNr de 45S se separa del eje de cr omatina y se escinde en ARNr de 28S, 18S y 5,8S. El ARNr de 18S y las pr oteínas asociadas forman la subunidad pequeña del ribosoma. Los ARNr de 28S y 5,8S, junto al ARNr de 5S sintetizado fuera del nucléolo, dan lugar a la subunidad grande del ribosoma. La ARN polimerasa II transcribe el precursor del ARNm y la ARN polimerasa III se ocupa de transcribir el ARNt. Localización de los ácidos nucleicos Las técnicas de citoquímica y autorradiografía (fig. 1-46) aportan información acerca de la distribución celular y de la síntesis de los ácidos nucleicos. La reacción de Feulgen se utiliza para localizar el ADN (v. cuadro 1-Q ).Los colorantes básicos, 1. EPITELIO C0005.indd 41 | 41 3/5/12 10:49:02 AM Figura 1-44. Componentes del núcleo y el nucléolo El núcleo de las células eucariotas se separa del citoplasma por medio de la envoltura nuclear, una membrana concéntrica doble procedente del retículo endoplásmico. La envoltura nuclear se interrumpe a intervalos aleatorios por los complejos del poro nuclear, unas estructuras con nucleoporinas que controlan el flujo de moléculas entre los compartimentos nuclear y citoplásmico. Envoltura nuclear Nucléolo Eucromatina NOR Las proteínas nucleolares nucleolina y fibrilarina se localizan en el componente fibrilar denso. La nucleoestemina se halla en el componente granular. La ARN polimerasa I se encuentra en el centro fibrilar. Heterocromatina Envoltura nuclear Retículo endoplásmico rugoso Heterocromatina (inactiva desde el punto de vista de la transcripción) Nucléolo Eucromatina (activa desde el punto de vista de la transcripción; ARNm y ARNt) Componente fibrilar denso Núcleo de célula pancreática Nucléolo NOR NOR Componente granular Lámina nuclear Centro fibrilar Poro nuclear Cromatina asociada al nucléolo (región organizadora del nucléolo, NOR) Nucléolo ADN Nucleoestemina p53 Nucleolina Proteína A de replicación (RPA) Nucleoplasma Como respuesta al estrés celular, la unión de nucleoestemina y nucleolina a p53 y su posterior inactivación (de modo que no puede ser reclutada hacia el ADN) inhibe el paso de la célula a la fase S (síntesis de ADN). La nucleolina crea un complejo con RPA (necesario para el comienzo de la síntesis del ADN) que se asocia a p53. Componente fibrilar denso Componente granular Centro fibrilar como el azul de toluidina, confi eren coloración al ADN y al ARN (v . cuadro 1-R). El pretratamiento con deso xirribonucleasa (ADNasa) y la ribonucleasa (ARN asa) permite definir la distribución del ADN y del ARN a través de la eliminación selectiv a de uno de los ácidos nucleicos. La autorradiografía y los precursores marcados con radioactividad de uno de los ácidos nucleicos permiten determinar el momento de su síntesis. En esta técnica, las células vivas se exponen a un pr ecursor radioactivo del ADN ([ 3H]timidina) o ARN ([3H]uridina). Como consecuencia de esta exposición, el ADN o el ARN sintetizados incorporan el precursor radioactivo. La radiactividad se detecta al recubrir a las células de una fi na capa de emulsión fotográfi ca. Los cristales con plata de la emulsión se exponen a las estr ucturas celulares que contienen ADN o ARN. Los granos de plata indican la localización de las estr ucturas marcadas al r evelar la emulsión. Este abordaje se ha aplicado de manera frecuente con el fin de determinar la duración de las distintas fases del ciclo celular . 42 | C0005.indd 42 Histología y biología celular. Introducción a la anatomía patológica 3/5/12 10:49:02 AM Figura 1-45. Procesamiento del ARN ribosómico Molécula precursora de ARNr maduro (45S) ARN polimerasa Dirección de síntesis de ARN (extremo 5’ a 3’) Fibra de cromatina Microfotografía electrónica tomada de Franke WW et al.: Morphology of transcriptional units of rDNA. Exp Cell Res 100:233-244, 1976. Fibra de cromatina Molécula precursora de ARNr naciente 18S pre-ARNr Procesamiento de pre-ARNr 5,8S 18S 5,8S Dirección de síntesis de ARN (extremo 5’ a 3’) Molécula precursora de ARNr naciente 28S 5,8S 18S ARN polimerasa 28S El precursor de ARNr se compone de tres elementos: 18S, 28S y 5,8S. El componente adicional 5S procede de otro gen. 28S 5S Alrededor de 30 proteínas se asocian a la molécula 18S para originar la subunidad ribosómica pequeña (40S). Aproximadamente 45 proteínas se ensamblan con las moléculas 28S, 5,8S y 5S para formar la subunidad ribosómica grande (60S). Complejo del poro nuclear Núcleo Envoltura nuclear Citoplasma Polirribosoma © Elsevier. Fotocopiar sin autorización es un delito . Polirribosoma ARNm 25 nm Ribosoma ensamblado CICLO CELULAR El ciclo celular se define como el intervalo existente entre dos divisiones mitóticas sucesivas que dan lugar a la formación de dos células hijas (fig. 1-47 ).Tradicionalmente, el ciclo celular se ha dividido en dos fases principales: 1)interfase y 2) mitosis (también conocida como fase M). 1. EPITELIO C0005.indd 43 | 43 3/5/12 10:49:03 AM Figura 1-46. Localización de los ácidos nucleicos Reacción de Feulgen 1 La hidrólisis con ácido clorhídrico da lugar a la formación de grupos aldehído en la desoxirribosa (glúcido del ADN) pero no en la ribosa (glúcido del ARN). Autorradiografía 2 La cromatina con ADN adquiere color púrpura debido a que la reacción de los grupos aldehído con el reactivo de Schiff incoloro origina un producto de color púrpura. HCl Citoplasma Núcleo Nucléolo El nucléolo no se tiñe (los centros fibrilares intranucleolares que contienen ADN no pueden visualizarse con el microscopio óptico). Basofilia 1 El azul de toluidina, un colorante básico, se une a los grupos fosfato con carga negativa del ADN y el ARN. La cromatina (ADN), el nucléolo (ARN) y los ribosomas adosados al retículo endoplásmico (ARN) se tiñen de color azul. Estas estructuras son basófilas. Retículo endoplásmico rugoso Nucléolo 2 Pretratamiento con ADNasa seguido de tinción con azul de toluidina para identificar las áreas que contienen ARN. ADNasa ARNasa Retículo endoplásmico rugoso Núcleo Nucléolo Núcleo Reacción de Feulgen 3 Pretratamiento con ARNasa seguido de tinción con azul de toluidina para identificar las áreas que contienen ADN. Reacción de PAS En esta autorradiografía se muestra la captación de [3H]timidina por los núcleos de las células epiteliales del intestino (duodeno). El precursor radiomarcado se inyectó en un animal de experimentación, que se sacrificó 24 h después. Los cortes histológicos fueron recubiertos por una emulsión fotográfica y expuestos a la oscuridad durante 48 h. El revelado de la emulsión fotográfica seguido de la tinción del corte puso de manifiesto la localización de los granos de plata (puntos negros) en algunos núcleos que se encontraban en la fase S (síntesis de ADN) del ciclo celular. Basofilia Basofilia tras digestión con ARNasa Nucléolos no teñidos Retículo endoplásmico rugoso Cromatina positiva para Feulgen Nucléolo negativo para Feulgen Núcleo no teñido Glucógeno teñido Hígado Páncreas El ADN se tiñe de púrpura. Las El glucógeno del citoplasma proteínas del nucléolo se tiñen de de los hepatocitos se tiñe de púrpura. verde con un colorante de contraste. El núcleo no se tiñe. 44 | C0005.indd 44 Nucléolo Cromatina teñida Cromatina teñida Páncreas Los ácidos nucleicos (ADN en la cromatina y ARN en el nucléolo y el retículo endoplásmico rugoso) se tiñen. Páncreas Tras el tratamiento con ARNasa sólo se tiñe la cromatina. Los nucléolos y el retículo endoplásmico rugoso no se tiñen. Histología y biología celular. Introducción a la anatomía patológica 3/5/12 10:49:03 AM Cuadro 1-P | Nucléolo • El nucléolo es el lugar de síntesis, procesamiento y modificación del pre-ARNr y del ensamblaje inicial del prerribosoma. Asimismo, contiene proteínas que carecen de relación con la síntesis del ribosoma y el transporte entre el nucléolo y el nucleoplasma para desempeñar funciones específicas. • El nucléolo consta de tres componentes: 1) centros fibrilares; 2) un componente fibrilar denso que rodea a los centros fibrilares, y 3) un componente granular. La síntesis del pre-ARNr tiene lugar en la interfaz entre los centros fibrilares y el componente fibrilar denso que lo rodea. Los transcritos nacientes del pre-ARNr se extienden hacia el componente fibrilar denso y migran hacia el componente granular, en el que se produce el procesamiento, la modificación y el ensamblaje de los prerribosomas. • Los centros fibrilares contienen cromatina y factores de transcripción, así como la ARN polimerasa I. El componente fibrilar denso, el lugar de procesamiento inicial del pre-ARNr, consta de pequeñas ribonucleoproteínas que intervienen en la modificación del ARN. El componente granular representa alrededor del 75% de la masa nucleolar; los gránulos corresponden a prerribosomas. • El nucléolo desaparece durante la profase mitótica y se reorganiza de nuevo hacia el final de la telofase en unas regiones cromosómicas específicas denominadas regiones organizadoras del nucléolo (NOR). Cuadro 1-Q | Reacciones de PAS y Feulgen • Ambas reacciones se basan en el reactivo de Schiff. • En la reacción de PAS, el ácido peryódico forma grupos aldehído en glúcidos de las glucoproteínas a través de un proceso de oxidación. • En la reacción de Feulgen, el ácido clorhídrico genera grupos aldehído en la desoxirribosa mediante hidrólisis. © Elsevier. Fotocopiar sin autorización es un delito . Cuadro 1-R | Basofilia y acidofilia En muchas técnicas de tinción citológica se utilizan colorantes ácidos y básicos. • Los colorantes básicos o catiónicos presentan radicales coloreados con carga positiva que establecen uniones electrostáticas con los grupos ácidos (p. ej., grupos fosfato en los ácidos nucleicos). El azul de toluidina es un colorante catiónico que se une a grupos fosfato del ADN y del ARN para conferir una coloración azulada. El ADN y el ARN son basófilos (presentan afinidad de unión por colorantes básicos). • Los colorantes ácidos o aniónicos presentan radicales coloreados con carga negativa que forman enlaces electrostáticos con grupos básicos. La eosina es un colorante aniónico que tiñe a muchas proteínas. Se considera que las proteínas básicas son acidófilas (con afinidad por colorantes ácidos). La etapa más r elevante de la inter fase es la fase S, en el transcurso de la cual se replica el ADN nuclear. La fase S se ve precedida por un intervalo o gap denominado fase G1. Con anterioridad al comienz o de la mitosis tiene lugar la fase G2, durante la cual se v erifica que la r eplicación del ADN haya fi nalizado antes de ponerse en marcha la fase M. E n esencia, las fases G 1 y G 2 crean un marco temporal para el crecimiento celular antes y después de la síntesis del ADN. E l crecimiento celular es clave para la duplicación de la masa celular como pr eparación para la división celular. Las células situadas en la fase G 1 pueden comprometerse con la r eplicación del ADN y pasar a la fase S o bien detener el avance hacia la siguiente fase S. Las células que no ingresan en la fase S se encuentran en un estado de reposo conocido como fase G0, una fase en la que la célula puede permanecer varis días, meses o años antes de entrar de nuevo en el ciclo celular. La noción más moderna del ciclo celular sostiene que es un pr oceso progresivo coordinado encaminado a la compleción de tr es ciclos diferentes: 1. Un ciclo citoplásmico, que corresponde a la activación secuencial de proteína cinasas dependientes de ciclinas en presencia de ciclinas. 2. Un ciclo nuclear, en el que se replica el ADN y se condensan los cromosomas de cara a la división celular . 3. Un ciclo centrosómico, el cual consiste en la duplicación de los dos centríolos, llamados centríolos madre e hija, y en el ensamblaje de las proteínas pericentriolares en preparación para la organización del huso mitótico durante la mitosis o la meiosis (v. fig. 1-47). Cabe r ecordar de nuestra exposición pr evia acerca del centr osoma como centro organizador de microtúbulos que los complejos anulares de ␥ tubulina son complejos nucleador es de micr otúbulos que interaccionan con la pr oteína pericentrina en el material pericentriolar . La alteración de esta interacción supone la interrupción del ciclo celular durante la transición entre las fases G2 y M, de modo que la célula sufre una muerte celular programada o apoptosis. Los cuerpos basales, el lugar de origen de los cilios y los fl agelos, provienen de los centríolos. Las actividades de los complejos formados entr e las pr oteína cinasas dependientes de ciclinas y las ciclinas reglan la progresión temporal de los ciclos nuclear y centrosómico (v. cuadro 1-S ).En la figura 1-48 se ofr ece información más detallada. Autorradiografía y FACS: análisis de la dinámica del ciclo celular Se pueden estudiar las distintas fases del ciclo celular por medio de la autorradiografía. Las células de la fase S se r econocen mediante la detección de la síntesis de ADN con [ 3H]timidina como precursor radiomarcado. Las células se pueden teñir a través de la emulsión revelada con el fi n de identifi car la localización exacta de los granos de plata solapados. Es posible estimar la progresión temporal de las células a lo largo de las div ersas fases del ciclo celular mediante pulsos br eves y pr olongados de [ 3H]timidina. El número de células radiomarcadas durante la interfase (habitualmente, alrededor del 30%) representa el índice de marcaje de la fase S. La fracción de células radiomarcadas que se encuentran en mitosis (índice mitótico) señala que el precursor radiomarcado que ingresó en la célula a lo largo de la fase S ha pasado de la fase G 2 a la fase M. Una técnica alternativa a la autorradiografía es la determinación del contenido de ADN (valor C 1,5 pg por célula haploide) mediante un selector celular activado por fluorescencia (FACS). Las células se tiñen con un colorante fluorescente que se une al ADN. La cantidad de fl uorescencia detectada por el FACS equivale a la cantidad de ADN de cada célula (p . ej., 2C en G 1; 4C al fi nal de la fase S; 4C en G 2). Degradación y reorganización de la envoltura nuclear La envoltura nuclear se desorganiza hacia el fi nal de la profase mitótica y meiótica. Supone la fragmentación de la envoltura nuclear, la disociación de los complejos del poro nuclear y la despolimerización de la lámina nuclear ( fig. 1-49 ). La lámina nuclear está formada por proteínas de filamentos intermedios de tipo V, las laminas A, B y C, las cuales se asocian entre sí para configurar la lámina nuclear. 1. EPITELIO C0005.indd 45 | 45 3/5/12 10:49:05 AM Figura 1-47. Fases del ciclo celular En la mitosis, los centrosomas poseen un complemento completo de proteínas pericentriolares Al final de la fase G2 concluye la duplicación de los centrosomas y cada centríolo está ensamblado G2 Huso mitótico Mitosis S El punto de restricción del final de la fase G1 controla el paso a la fase S. La ausencia de moléculas de transmisión de señales obliga a la célula a entrar en una fase de reposo G0. Durante la transición entre las fases G1 y S, los centrosomas se duplican. Los centríolos hijos provienen de cada centríolo Material pericentriolar Citocinesis G1 G0 Centríolo madre Centríolo hijo Durante G1, la célula presenta un centrosoma ormado por dos centríolos (un centríolo madre y un centríolo hijo) rodeados de material pericentriolar División celular en las células eucariotas: el ciclo nuclear y el ciclo centrosómico El ciclo celular se divide en cuatro fases: G1 (gap 1), S, G2 (gap 2) y mitosis. La mitosis se sigue de la citocinesis en la mayoría de los casos. La replicación del ADN tiene lugar a lo largo de la fase S y se detecta mediante autorradiografía utilizando [3H]+ timidina como precursor. La duración de las fases del ciclo celular es variable. La mitótica es la más breve (alrededor de 1 h para una duración total del ciclo celular de 24 h). La fase G1 es la más larga (aproximadamente 11 h). La S concluye en el plazo de 8 h, mientras que G2 dura unas 4 h. En algunas células se interrumpe la división celular o se dividen de manera ocasional para sustituir a otras destruidas por lesiones o apoptosis. Estas células abandonan la fase G1 del ciclo celular y pasan a un estado de latencia, conocido como fase G0. A pesar de que las células G0 son activas desde el punto de vista metabólico, han perdido su capacidad proliferativa a no ser que alguna señal extracelular adecuada estimule su reincorporación al ciclo celular. La fosforilación de las laminas, catalizada inicialmente por la proteína cinasa C y más tarde por la cinasa Cdk1 activada por la ciclina A, da lugar a la desorganización de la lámina nuclear. Por otra parte, se dispersan los componentes del complejo del poro nuclear, las nucleoporinas, y las cisternas membranosas del r etículo endoplásmico, el cual constituy e el reservorio de la membrana nuclear para la ulterior reorganización de la envoltura nuclear. A lo largo de la anafase, las nucleoporinas y tr es componentes proteicos transmembrana de la membrana nuclear interna: el polipéptido asociado a la lámina 2, receptor de lamina B y la emerina se unen a la superfi cie de los cr omosomas (cromatina). A continuación, las nucleoporinas y las pr oteínas de la membrana nuclear interna reclutan cisternas del retículo endoplásmico y se reorganiza la envoltura nuclear hacia el fi nal de la telofase. La desfosforilación de la lamina B por acción de laproteína fosfatasa 1 constituye el paso final de la reconstrucción de la envoltura nuclear. La lamina B desfosforilada se asocia a las laminas A y C para formar la lámina nuclear antes de que se inicie la citocinesis. Esta secuencia de episodios pone de r elieve la importancia de las mutaciones que afectan a la expr esión de las pr oteínas lamina A o de unión a laminas (v. cuadro 1-M) como origen de las laminopatías. 46 | C0005.indd 46 Histología y biología celular. Introducción a la anatomía patológica 3/5/12 10:49:05 AM Figura 1-48. Control del ciclo celular 4 Transición G2/mitosis: el comienzo de la profase depende de la actividad ciclina A/Cdk1. La deleción del gen que codifica Cdk1 se asocia a mortalidad embrionaria temprana. Cdk1 G2 33 Inicio de la fase S: la ciclina A se une a Cdk2 y fosforila a proteínas que participan en la replicación del ADN. 5 Mitosis: los complejos ciclina B/Cdk1 participan activamente y completan la mitosis Ciclina A 4 Cdk1 Mitosis 5 Ciclina B Punto de restricción 2 2 G1 tardía: Cdk2 se activa como consecuencia de su unión a la ciclina E. La fosforilación de la proteína Rb concluye, lo que estimula de nuevo la activación de la transcripción mediada por E2F. Cdk2 y su regulación son esenciales en la meiosis. S Cdk2 Ciclina A 1 G1 temprana: Cdk4 y/o Cdk6 son activadas por la ciclina D y ponen en marcha la fosforilación de la proteína del retinoblastoma (Rb). Este acontecimiento determina la liberación de factores de transcripción E2F que activan los genes de la ciclina E y la ciclina A. Punto de restricción 1 3 Ciclina D 1 Cdk4/Cdk6 G1 2 Ciclina E Cdk2 Ciclina E Ciclina A Proteína Rb fosforilada Liberación de factores de transcripción E2F La regulación de los acontecimientos del ciclo celular se basa en combinaciones complejas de cinasas dependientes de ciclinas (Cdk) y ciclinas en las distintas fases del ciclo celular, las cuales ejercen un control adicional de la maquinaria que interviene en el mismo. Genes supresores de tumores © Elsevier. Fotocopiar sin autorización es un delito . Cuadro 1-S | Ciclo celular • La división celular depende de la progresión coordinada de tres ciclos: el ciclo citoplásmico, el ciclo nuclear y el ciclo del centrosoma. Este último interviene en la regulación de los otros dos. • El ciclo citoplásmico depende de la disponibilidad de las ciclinas activadas y desactivadas por cinasas dependientes de ciclinas (Cdk). Los inhibidores de Cdk inactivan los complejos Cdk-ciclina. Estos inhibidores están sometidos a regulación por un aumento en la transcripción para interrumpir, en caso necesario, los ciclos citoplásmico y nuclear. • El ciclo nuclear implica la duplicación del ADN y la condensación cromosómica. La fosforilación de un complejo proteico unido a la secuencia de inicio de la replicación del ADN por acción de Cdk2 supone el reclutamiento de la ADN polimerasa para comenzar y completar la síntesis de ADN en la fase S. La fosforilación mediada por Cdk1 induce la condensación cromosómica (mediada por la fosforilación de la histona H3) y la degradación de la envoltura nuclear (determinada por la fosforilación de la lámina nuclear). • En el ciclo del centrosoma tiene lugar la duplicación de los dos centríolos que integran el centrosoma durante la fase S tras la fosforilación de los sustratos centrosómicos por Cdk2. Los centríolos hijos provienen de cada centríolo. • Las Cdk participan en la coordinación de los ciclos citoplásmico, nuclear y centrosómico. • El inicio de la replicación del ADN y la duplicación de los centríolos requiere la actividad de la Cdk2. El control de la pr ogresión y de la fi nalización del ciclo celular no depende ex clusivamente de los complejos Cdk-ciclina. Los tejidos adoptan dos estrategias para limitar la proliferación celular: 1. Limitación de los factores mitógenos, como el factor de crecimiento derivado de plaquetas (PDGF) y el factor de cr ecimiento fibroblástico (FGF), los cuales favorecen la proliferación celular. 2. Utilización de genes reguladores que inhiben la pr oliferación activamente. Estos genes, llamados genes supresores de tumores, regulan la proliferación celular normal. El modelo del retinoblastoma ofrece datos de interés acerca del funcionamiento de los genes supresores de tumores (fig. 1-50). Cada célula posee dos copias del gen del retinoblastoma (Rb) como mecanismo de seguridad. Cuando las dos copias del gen Rb están mutadas, la proteína Rb anómala induce la pr oliferación neoplásica de las células retinianas. Cuando la mutación afecta a una de las copias del gen Rb, la otra actúa con normalidad e inhibe la pr oliferación celular no r egulada, a no ser que se pr oduzca una segunda mutación. Todas las células embrionarias de los niños con una sola copia intacta del gen Rb crecen del modo normal. E n una fase más av anzada del embarazo, las células r etinianas pueden perder la copia normal del gen Rb, lo que hace posible el desarrollo del retinoblastoma. El gen Rb codifica una pr oteína nuclear que par ticipa en la r egulación de la actividad de un grupo de proteínas —factores de transcripción— implicados en la síntesis del ADN y en la pr ogresión del ciclo celular . La proteína Rb se une a los factores de transcripción al ser desfosforilada. El complejo formado por la proteína Rb y el factor de transcripción se puede unir a los genes diana, si bien la actividad del factor de transcripción se encuentra inhibida. La fosforilación de la pr oteína Rb por acción del complejo Cdk4-ciclina D implica su disociación del complejo con el factor de transcripción, lo cual activ a la expresión de genes específi cos (fig. 1-51). La pr oteína Rb fosforilada modifi ca la acción inhibidora de los factores de transcripción a una acción activ adora necesaria para la síntesis de ADN y el av ance del ciclo celular. 1. EPITELIO C0005.indd 47 | 47 3/5/12 10:49:05 AM Figura 1-49. Ensamblaje y desensamblaje de la envoltura nuclear 1 Durante la interfase, la lámina nuclear, una red de laminas A, B y C, se une a la cromatina y a la membrana interna de la envoltura nuclear. Membrana nuclear interna Lámina nuclear Cromatina 2 En la mitosis, la proteína cinasa C y, después, la Cdk1 cinasa activada por la ciclina A fosforilan las laminas, lo que provoca la disociación de los filamentos para dar lugar a dímeros libres de lamina. Cabeza Bastón Cola Sitio de fosforilación Dímeros de lamina 3 La envoltura nuclear se degrada a medida que la lámina nuclear se desintegra. Las laminas A, B y C continúan estando fosforiladas y se dispersan. Los componentes del complejo del poro nuclear se desorganizan y se dispersan. Las cisternas del retículo endoplásmico actúan como depósito de la futura envoltura nuclear. Cisternas del retículo endoplásmico Telofase Cromosoma Cisternas del retículo endoplásmico asociadas a la cromatina Cisternas fragmentadas del retículo endoplásmico Acontecimientos secuenciales durante el reensamblaje de la envoltura nuclear Laminas A, B y C fosforiladas 4 Durante la anafase, las proteínas solubles del complejo del poro nuclear (nucleoporinas) se unen a la superficie de la cromatina. 4 5 Durante el final de la anafase, el polipéptido asociado a laminas 2β (LAP2β), el receptor de lamina B (LBR) y la emerina —proteínas transmembrana de la membrana nuclear interna— aparecen en la superficie de la cromatina. 5 6 Durante el final de la telofase, las cisternas del retículo endoplásmico se anclan a LAP2β, LBR y emerina, y se inicia la reorganización de la envoltura nuclear. Nucleoporinas Cromatina LBR Emerina LAP2 β Cisterna del retículo endoplásmico 6 7 Antes de la citocinesis, la lamina B se desfosforila por acción de la proteína fosfatasa 1 y, junto a las laminas C y A, pone en marcha la formación de la lámina nuclear. La formación de esta estructura comienza una vez finalizada la reconstrucción de la envoltura nuclear. Ensamblaje del poro nuclear Proteína fosfatasa 1 Lamina B fosforilada Complejo del poro nuclear desorganizado 7 Ensamblaje de la lámina nuclear Lamina B desfosforilada Importancia clínica: gen del retinoblastoma y otros genes supresores El retinoblastoma es un tumor que aparece en una etapa temprana de la vida y rara vez se desarr olla con posterioridad a los 5-6 años. A menudo, se obser van varios casos en el seno de una misma familia. E n estos grupos familiares, el tumor puede afectar al 50% de la descendencia. Los niños con la forma familiar del retinoblastoma suelen presentar varios tumores en ambos ojos. Una segunda variante del retinoblastoma, la forma esporádica, se observa en niños cuyos padres carecen de antecedentes de la entidad. Después de curarse, estos pacientes 48 | C0005.indd 48 Histología y biología celular. Introducción a la anatomía patológica 3/5/12 10:49:05 AM Figura 1-50. Proteína Rb, un inhibidor del avance del ciclo celular G2 Mitosis Los factores de crecimiento estimulan el paso de la fase G1 a la fase S S G1 Cdk4 Punto de restricción Ciclina D © Elsevier. Fotocopiar sin autorización es un delito . La proteína Rb fosforilada —por acción del complejo ciclina D-Cdk4— facilita el paso a través del punto de restricción. La proteína Rb fosforilada está inactiva. La proteína Rb no fosforilada impide el avance del ciclo celular más allá del punto de restricción de G1 no transmiten la enfermedad a su descendencia al llegar a la vida adulta. Los niños aquejados de la forma esporádica son normales desde el punto de vista genético en el momento de la fecundación, per o a lo largo de la embriogénesis se pr oducen dos mutaciones en una estirpe celular que dará lugar a los fotorr eceptores retinianos: los bastones y los conos. Los genes Rb portadores de una doble mutación así creados inducen la proliferación celular que conducirá al desarr ollo del retinoblastoma. En el retinoblastoma familiar, el óvulo fecundado contiene una copia mutada del gen Rb procedente del espermatozoide o el ovocito. Todas las células derivadas del cigoto portan esta mutación, incluidas las que integran la r etina. La copia normal del gen Rb habrá de sufrir una mutación para alcanzar el estado de mutación doble necesario para la aparición del tumor. Cada una de las células retinianas es susceptible de carcinogenia y un solo episodio pondrá en mar cha el proceso de desarrollo tumoral. El retinoblastoma representa uno de los distintos tumor es que aparecen como consecuencia de la pérdida o la inactivación de genes clave. El tumor de Wilms del riñón se forma como consecuencia de la desaparición de un gen r egulador de la proliferación, llamado WT-1. De manera similar al gen Rb, ambas copias deben estar mutadas para que la célula pr olifere sin control. Un gen supresor de tumores que no encaja claramente en este modelo es p53, el gen mutado más a menudo en los tumor es humanos (leucemias, linfomas, tumores cerebrales y cáncer de mama, entr e otros). El gen p53 codifica la proteína p53, un tetrámero que se une a una secuencia específi ca del ADN implicado en el control de la transcripción de algunos genes. La presencia de una mutación que afecte a una de las cuatro subunidades de p53 puede repercutir en el funcionamiento de las otras tr es. A diferencia de las mutaciones que afectan a muchos otr os genes supr esores de tumor es a través de la supresión total de la función génica, las mutaciones en p53 pueden dar lugar a una proliferación leve o invasiva. En el capítulo 16, «Segmento digestivo inferior», nos ocuparemos del gen supresor de tumor es poliposis adenomatosa del colon (APC), el cual está implicado en una variante hereditaria del cáncer de colon (poliposis adenomatosa familiar) secundaria a la transformación maligna de algunos de los muchos pólipos (tumores benignos) observados en los sujetos aquejados de este trastorno . MITOSIS La duplicación del par de centríolos, cada uno de los cuales migra hacia posiciones opuestas del núcleo para organizar un centrosoma, precede a la mitosis. La función primaria del centr osoma es la formación y el mantenimiento del huso mitótico, 1. EPITELIO C0005.indd 49 | 49 3/5/12 10:49:06 AM Figura 1-51. La proteína Rb desfosforilada, un gen supresor 1 Proteína Rb desfosforilada Factores de transcripción ADN La actividad génica está inhibida. No se sintetiza ADN ni avanza el ciclo celular NÚCLEO Factores de transcripción Fosforilación de Rb por el complejo Cdk4-ciclina D Disociación de Rb de los factores de transcripción 2 ADN 3 Unión a la diana génica de los factores de transcripción disociados Proteína Rb fosforilada Activación génica; síntesis de ADN y avance del ciclo celular Cdk4 Ciclina D NÚCLEO 1 La forma desfosforilada de la proteína Rb se une a un grupo de factores de transcripción y suprime la transcripción génica de dianas génicas activadas normalmente. 2 La fosforilación de Rb por acción del complejo Cdk4-ciclina D induce la disociación de los factores de transcripción de la proteína Rb a lo largo de la fase G1 tardía. 3 Los factores de transcripción libres estimulan la expresión de los genes necesarios para la síntesis de ADN y el avance del ciclo celular. integrado por microtúbulos. El centrosoma se conoce también como centro organizador de los micr otúbulos (COM) debido a esta función. Cada centr osoma puede organizar alrededor de 1.000 micr otúbulos nuevos por minuto a par tir de dímeros de tubulina procedentes del desensamblaje de los micr otúbulos citoplásmicos. La mitosis se divide en cuatr o subetapas: profase, metafase, anafase y telofase. En la figura 1-53 se resumen los aspectos más destacados de la mitosis. Telomerasa, senescencia y cáncer Las células somáticas pueden someterse a un númer o determinado de divisiones celulares antes de pasar a un estado de senescencia. Por el contrario, las células tumorales tienen una vida ilimitada, lo que es necesario para el desarr ollo de un tumor. Los estudios in vitro con cultivos celulares representan un modelo para el estudio del reloj biológico de las células somáticas normales. Los telómeros son los extremos de los cromosomas y se componen de un tramo de secuencias de nucleótidos r epetidas (fig. 1-52). Los telómer os se ocupan de mantener la integridad cromosómica y representan el reloj biológico de la célula. Su tamaño va disminuyendo en cada división celular cuando las ADN polimerasas no copian los extremos de los cr omosomas. La senescencia celular tiene lugar cuando el acortamiento de los telómeros impide mantener la integridad cr omosómica. El mantenimiento de la longitud de los telómer os en las células germinales masculinas y femeninas corr e a cargo de la enzima telomerasa, una ribonucleoproteína con actividad transcriptasa inv ersa que emplea ARN como molde para mantener dicha longitud. La telomerasa no apar ece en las células somáticas. La expresión de la telomerasa es elev ada en la may or parte de las células tumorales. El complejo de la telomerasa (v. fig. 1-52) engloba la transcriptasa inversa de la telomerasa (TERT), el ARN patrón de la subunidad de ARN de la telomerasa (TR), que aporta el molde para la síntesis r epetida de los extr emos cromosómicos, y la disquerina (DKC1), una pr oteína auxiliar. Este complejo se organiza en los cuerpos de Cajal en el compar timento nuclear y se transpor ta hasta los telómer os 50 | C0005.indd 50 Histología y biología celular. Introducción a la anatomía patológica 3/5/12 10:49:06 AM Figura 1-52. El complejo de la telomerasa Los telómeros humanos se componen de muchas kilobases de repeticiones TTAGGG con una hebra adelantada y otra retrasada ricas, respectivamente, en G y en C. La hebra rica en G se extiende en dirección 3’, lo que da lugar a un solapamiento en G. Cromosoma Telómero Hebra retrasada rica en C 2 Hebra adelantada rica en G 1 Cuerpo de Cajal Disquerina (DKC1) Proteína 1 de los cuerpos de Cajal de la telomerasa (TCAB1) Solapamiento en G ATC-’5 GGGTTAG-’3 AUC Reptina Pontina Molde de ARN del telomerasa (TR) Transcriptasa inversa de la telomerasa (TERT) Núcleo Citoplasma 1 El complejo de la telomerasa se ensambla en los cuerpos de Cajal en el úcleo y es transportado a los telómeros por la acción de la proteína auxiliar TCAB1. © Elsevier. Fotocopiar sin autorización es un delito . 2 Las ATPasas pontina y reptina activan el complejo telomérico en los extremos cromosómicos y ponen en marcha la incorporación de nucleótidos. A través de este mecanismo, el complejo telomérico compensa el acortamiento de los telómeros para conservar su longitud y estabilidad. Esta última es muy importante en las células madre en proliferación rápida. Un complejo integrado por seis proteínas, llamado shelterina, regula la longitud del telómero (no se muestra). por acción de una pr oteína auxiliar, la proteína 1 de los cuerpos de C ajal de la telomerasa (TCAB1). Dos ATPasas, la pontina y la reptina, activan el complejo de la telomerasa en el extremo del cromosoma y ponen en marcha la incorporación de nucleótidos. La disfunción de los telómeros se ha relacionado directamente con dos trastornos: la disqueratosis congénita y la fibrosis pulmonar idiopática. La primera se distingue por la mielodepr esión, las anomalías en la pigmentación cutánea, la distrofia ungueal y la leucoplaquia (placas queratósicas en la lengua y en la cara interna de las mejillas). La fi brosis pulmonar idiopática da lugar a una destr ucción gradual del parénquima pulmonar, la cual que conduce a la muerte. Los pacientes afectados por ambas enfermedades por tan telómeros acortados. Importancia clínica: función de la proteína p53 en la quimioterapia La quimioterapia y la radioterapia son dos tratamientos eficaces frente a los tumores metastásicos. Los fármacos quimioterápicos pueden: 1. Propiciar el establecimiento de enlaces cr uzados en el ADN (compuestos alquilantes). 2. Inhibir las enzimas necesarias para la síntesis del ADN (análogos de nucleótidos). 3. Alterar los micr otúbulos del huso mitótico (paclitax el, vinblastina). Estos fármacos suelen administrarse en combinación durante períodos br eves o bien de forma continuada, con arr eglo a la susceptibilidad del tipo tumoral y tratando de evitar la to xicidad en órganos muy sensibles, como la médula ósea, el epitelio intestinal, los riñones y el sistema ner vioso. 1. EPITELIO C0005.indd 51 | 51 3/5/12 10:49:06 AM Figura 1-53. Fases de la mitosis Envoltura nuclear Centrómero (región cinetocórica) Cromátida Cohesina Condensina Centrosoma Profase 1. Un centrosoma inicia la organización del huso mitótico. 2. La envoltura nuclear se desintegra como consecuencia de la fosforilación de las laminas. 3. Los cromosomas replicados se condensan. Cada cromosoma consta de dos cromátidas idénticas (denominadas cromátidas hermanas) que se mantienen unidas en el centrómero o por constricción primaria del cromosoma. Una proteína de unión a la cromatina, llamada cohesina, une a las cromátidas hermanas entre sí. La condensina de la periferia de las cromátidas compacta la cromatina. Microtúbulo cinetocórico Microtúbulo radial Microtúbulo polar Metafase Placa ecuatorial Complejo promotor de la anafase (APC) Topoisomerasa 1. El cinetocoro aparece en la región centromérica. Se trata de una especialización estructural de la superficie del cromosoma en la que se insertan los microtúbulos. Los que se extienden desde el centrosoma hasta el cinetocoro reciben el nombre de microtúbulos cinetocóricos. 2. Los cromosomas se alinean en la placa ecuatorial (también conocida como placa metafásica). 3. Los microtúbulos que se extienden desde un polo de la célula hasta el opuesto son los microtúbulos polares. Los microtúbulos radiales parten del centrosoma. No se insertan en el cinetocoro. 4. Durante la metafase, los cromosomas se mantienen en la placa ecuatorial debido a la acción de dos fuerzas contrarias equilibradas entre sí. Los microtúbulos cinetocóricos empujan a los cromosomas hacia uno de los polos, mientras que los microtúbulos radiales estabilizan el centrosoma al anclarse a la membrana plasmática. 5. El complejo promotor de la anafase, APC, se desensambla cuando la unión de los microtúbulos cinetocóricos al cinetocoro es correcta. Cuando el cinetocoro no está unido a los microtúbulos, el APC detiene el ciclo mitótico en la metafase mediante el retraso de la actividad de las ciclinas. Anafase Los microtúbulos polares se alargan Los microtúbulos cinetocóricos se acortan 1. Las cromátidas hermanas se separan debido a que, de forma simultánea, también lo hacen los centrómeros. 2. La topoisomerasa, una enzima localizada en la región cinetocórica, libera las fibras enrolladas de cromatina para propiciar la separación de las cromátidas hermanas. 3. Dos procesos independientes, aunque simultáneos, provocan la separación de las cromátidas hermanas a los polos opuestos: 1) los microtúbulos cinetocóricos se acortan y las cromátidas se separan del plano ecuatorial hacia sus polos respectivos. Este paso se denomina, generalmente, anafase A. 2) Los polos celulares se separan debido al alargamiento de los microtúbulos polares. Este paso recibe el nombre de anafase B. 4. La aneuploidía (número anómalo de cromosomas) puede deberse a la separación incorrecta de las dos cromátidas de un cromosoma a las dos células hijas. La ausencia de unión de los microtúbulos cinetocóricos al cinetocoro puede inhibir el comienzo de la anafase. Existe un mecanismo de verificación en el cinetocoro que evita la aneuploidía. Telofase Anillo contráctil Cuerpo medio 1. La envoltura nuclear se reorganiza gradualmente; las laminas se desfosforilan y la lámina nuclear se ensambla. 2. Los cromosomas se descondensan. 3. En el transcurso de la citocinesis, aparece un anillo contráctil transitorio,formado por actina y miosina, alrededor de la región ecuatorial, el cual se contrae para separar ambas células hijas por medio de un proceso llamado abscisión (del latín abscindo, separar de). 4. En el núcleo del anillo contráctil pueden quedar microtúbulos residuales. Forman una estructura conocida como cuerpo medio. 5. Los microtúbulos radiales, cinetocóricos y polares desaparecen. Se han defi nido dos tipos de r esistencia tumoral a los fármacos quimioterápicos: 1. Resistencia intrínseca (tumores habitualmente resistentes a muchos fármacos —melanoma, hepatocarcinoma, carcinoma de células renales—). 2. Resistencia adquirida (tumores que adquieren resistencia a la quimioterapia tras un período inicial de sensibilidad). Una forma de r esistencia adquirida se debe a los genes de la familia génica de la resistencia a múltiples fármacos (mdr) (fig. 1-54). Estos genes codifi can bombas dependientes de ATP que participan en el transporte de moléculas orgánicas de gran 52 | C0005.indd 52 Histología y biología celular. Introducción a la anatomía patológica 3/5/12 10:49:06 AM tamaño. La familia génica mdr se estudiará, de nuevo, en el capítulo 17, «Glándulas digestivas», al abordar el mecanismo de secr eción biliar de los hepatocitos. El gen implicado en la r esistencia a la quimioterapia antitumoral que se ha estudiado con may or detalle es mdr-1. La exposición r epetida a algunos fármacos quimioterápicos se ha relacionado con la sobreexpresión de este gen y con el aumento de la expulsión de estos compuestos cuando entran en una célula tumoral. Los daños al ADN ocasionados por la quimioterapia y la radioterapia —estrés genotóxico— inducen la activación de p53, un factor de transcripción tetramérico que destruye las células con lesiones terminales a través de la activ ación de un programa de muer te celular o apoptosis (v. cuadro 1-T). En las células normales, el estrés genotóxico estimula la inhibición de Mdm2 (del inglés mouse double minute 2), lo que posibilita la activación de p53, así como la continuación del crecimiento y del desarrollo normales (v. fig. 1-54). Mdm2 es una ubicuitina ligasa que se une a p53 y facilita su degradación dependiente de la ubicuitina en el citoplasma por acción del proteasoma 26S (v. fig. 3-14 en el capítulo 3, «T ransmisión de señales celular es»). La inhibición de Mdm2 (p. ej., por ARF —del inglés alternate reading frame—, una pr oteína de 14 kDa) permite la activación de las funciones supresoras de tumores de p53. Mdm2 ejerce un efecto inhibitorio similar en la pr oteína supresora del r etinoblastoma (proteína Rb). Las concentraciones de ARF , Mdm2 y p53 no son tan altas en las células no sometidas a estrés genotóxico . La semivida de p53 sólo es de 10-15 min. Las células tumorales utilizan tres posibles mecanismos para evitar la destrucción de las células por apoptosis inducida por estrés genotóxico: 1. Incapacidad de Mdm2 de inhibir la función supr esora de tumores de p53. 2. Afectación de la función de p53 por una mutación inactiv adora. 3. Alteración de la cascada apoptósica (p . ej., pér dida de la activ ación de la caspasa 9). En el 50% de los tumor es humanos se detectan mutaciones del gen TP53, el cual codifica la pr oteína p53. La desaparición de la expr esión de TP53 por una Figura 1-54. Quimioterapia antitumoral y actividad de p53 Funcionamiento de la actividad supresora de tumores de p53 Estrés genotóxico © Elsevier. Fotocopiar sin autorización es un delito . Cuadro 1-T | p53, una proteína supresora de tumores • La proteína supresora de tumores p53 salvaguarda la integridad del ADN frente a estrés nocivo, denominado estrés genotóxico. • La función protectora de p53 depende de su capacidad de inducción de la muerte celular programada o apoptosis o detención de los acontecimientos del ciclo celular cuando una célula está sometida a estrés genotóxico. • ¿Cómo funciona p53? Como factor de transcripción, p53 controla la activación de la transcripción de genes proapoptósicos y la inactivación de los antiapoptósicos. A través de este mecanismo son destruidas aquellas células afectadas por estrés genotóxico. • ¿Qué puede ocurrir de forma anómala? La pérdida de la función de p53 puede deberse a una mutación del gen TP53, que codifica p53, o bien a una alteración de la vía de transmisión de señales que controla la función de esta proteína (v. fig. 1-54). • ¿En qué radica la importancia de p53? Las células tumorales son muy sensibles a las señales proapoptósicas, pero pueden sobrevivir en ausencia de la función de p53. Células normales Células tumorales Mdm2 (ubicuitina ligasa) inactivada Mdm2 (ubicuitina ligasa) activa p53 estable y activa Supresión de tumores por apoptosis Ausencia de supresión de tumores Inactivación de p53 2 Aumento de la exportación de fármacos quimioterápicos a través de mdr-1 1 La inactivación de p53 inhibe la respuesta protectora frente a daños al ADN (muerte celular). p53 ADN Mecanismos de resistencia de tumores a fármacos quimioterápicos mdr-1 1 La resistencia adquirida por una mutación en el gen TP53 impide la muerte celular como respuesta a fármacos inductores de daños al ADN. 2 El aumento de la exportación de un fármaco por una proteína asociada a la resistencia a múltiples fármacos (mdr) impide la acción intracelular. 1. EPITELIO C0005.indd 53 | 53 3/5/12 10:49:06 AM Figura 1-55. Nomenclatura de los cromosomas humanos: cariotipos normales y anómalos Satélite Brazo corto (p de pequeño) Tallo Acrocéntrico Submetacéntrico Brazo largo (q) 46,XX Mujer normal (46 cromosomas, incluido el par XX) 46,XY Metacéntrico Hombre normal (46 cromosomas, incluido el par XY) 47,XXY 47,XX,+21 Mujer con un cromosoma 21 extra (síndrome de Down) Constricción primaria o región centromérica 47,XY,+17p+ Hombre con un cromosoma Hombre con un cromosoma X extra (síndrome 17 extra y aumento de Klinefelter) de la longitud del brazo corto mutación autosómica dominante origina el fenotipo de tumor es múltiples llamado síndrome de Li-Fraumeni (v. cuadro 1-U ).p53 es un gen supresor de tumores. La inactivación de la actividad de p53 está alterada en las células tumorales r esistentes a fármacos (v. fig. 1-54). La pérdida de expresión de p53 en las células tumorales humanas y en algunos estudios clínicos se ha propuesto la existencia de una relación entre la inactiv ación de la expr esión de p53 y la r esistencia a compuestos quimioterápicos. Los fármacos quimioterápicos capaces de unirse a M dm2 podrían conferir estabilidad y aumentar las concentraciones de p53 en las células tumorales para ejer cer una acción supresora de tumores basada en la inducción de la apoptosis. E l mecanismo que sustenta la muer te celular pr ogramada o apoptosis se comenta en el capítulo 3, «Transmisión de señales celulares». Cariotipificación Cuadro 1-U | Síndrome de Li-Fraumeni • El síndrome de Li-Fraumeni (LFS) es un trastorno autosómico dominante que se distingue por la predisposición al desarrollo de tumores. • En un sujeto joven (menor de 45 años) pueden desarrollarse distintos tipos de neoplasias malignas: tumores cerebrales, tumores mamarios (40% de los casos en mujeres), leucemia aguda y sarcomas de partes blandas y óseos. • El síndrome LFS se debe a una mutación del gen supresor de tumores p53, un factor de transcripción que desempeña una función reguladora en el ciclo celular. • La incidencia del LFS es baja. A pesar de que la neoplasia inicial suele tratarse con resultados satisfactorios en los niños afectados, tienen un riesgo elevado de presentar un segundo tumor maligno primario. 54 | C0005.indd 54 En el ser humano existen 22 pares de autosomas y un par de cromosomas sexuales (XX o XY). En la clasifi cación de los cr omosomas según la longitud y la posición del centrómero existen siete gr upos designados con las letras A a G. En la terminología de la citogenética humana, el númer o total de cr omosomas (46) se sigue del númer o total de cr omosomas sexuales ( fig. 1-55 ).Un hombre normal se identifi ca como 46,XY (46 cromosomas, incluido el par de cromosomas XY), y una mujer , como 46,XX (46 cromosomas, incluido el par de cromosomas XX). Los cromosomas adicionales se indican al expr esar el número del cromosoma extra después de los cromosomas sexuales precedido por el signo más (+). De este modo, el cariotipo de una mujer afectada por la trisomía del cr omosoma 21 (síndrome de Down) es 47,XX + 21. Un hombre con un cr omosoma X adicional se designa como 47,XXY. Se añade el signo de más o menos tras el símbolo del cr omosoma para señalar el aumento o la disminución de la longitud de uno de sus braz os. La letra p se utiliza para el brazo corto, y la q, para el brazo largo. Por tanto, 47,XY, + 17p+ corresponde a un hombre con 47 cromosomas por la presencia de un cr omosoma 17 adicional, con un aumento de la longitud de su braz o corto. Histología y biología celular. Introducción a la anatomía patológica 3/5/12 10:49:06 AM Conceptos esenciales | Epitelio • El epitelio constituye uno de los cuatro tejidos básicos. Los otros tres tejidos básicos son el conjuntivo, el muscular y el nervioso. Los epitelios se dividen en tres grupos principales en función: 1) del número de capas celulares (una capa: epitelio simple; más de una capa: epitelio estratificado); 2) de la morfología de las células (epitelio escamoso, epitelio cúbico y epitelio cilíndrico), y 3) de la morfología de las células en la capa más superficial (epitelio escamoso estratificado, epitelio cúbico estratificado y epitelio cilíndrico estratificado). El epitelio escamoso estratificado se subdivide en moderadamente queratinizado (con frecuencia denominado no queratinizado) y muy queratinizado. El término endotelio se aplica al epitelio escamoso simple que tapiza los vasos sanguíneos y linfáticos. El vocablo mesotelio se refiere al revestimiento cúbico o escamoso simple de la serosa (peritoneo, pleura y pericardio). Los tumores que provienen del mesotelio reciben el nombre de mesoteliomas. • Un componente citoesquelético destacado de las células epiteliales son las proteínas queratinas (citoqueratinas). Los anatomopatólogos tratan de detectar la presencia de queratinas para definir el origen epitelial de un tumor (llamado carcinomas, a diferencia de los de origen conjuntivo, conocidos como sarcomas). © Elsevier. Fotocopiar sin autorización es un delito . • El epitelio seudoestratificado representa un tipo intermedio en el que todas las células se encuentran en contacto con la lámina basal, pero no todas alcanzan la luz. Se considera que el epitelio transicional, o urotelio, el cual reviste las vías urinarias, es seudoestratificado, aunque su aspecto corresponde a uno escamoso estratificado. Las células más externas del urotelio de la vejiga urinaria son capaces de modificar su geometría y su configuración como respuesta a las fuerzas de tensión que ejerce la orina. • Algunos epitelios pueden subdividirse en función de la presencia de diferenciaciones apicales, como cilios, microvellosidades y estereocilios. El epitelio seudoestratificado ciliado aparece en el árbol respiratorio y el oviducto. El epitelio cúbico simple de ciertos segmentos de la neurona y el epitelio cilíndrico simple del intestino delgado poseen microvellosidades que forman un borde en cepillo a lo largo del dominio apical. Los estereocilios se localizan en el revestimiento epitelial del epidídimo y en las células ciliadas del oído interno. Las células epiteliales se organizan en capas celulares en estrecho contacto a través de estructuras especializadas, como uniones herméticas, uniones de anclaje (desmosomas en cinturón y puntuales y hemidesmosomas) y uniones comunicantes. • Las células epiteliales son muy polarizadas. Poseen un dominio apical y un dominio basolateral. La disposición de las uniones y sus componentes, la distribución polarizada del citoesqueleto de actina y la presencia de la membrana basal en la superficie basal definen los límites de cada dominio. • El dominio apical de algunas células epiteliales presenta diferenciaciones que se proyectan hacia la luz. Estas diferenciaciones apicales pueden ser móviles (cilios) o inmóviles (microvellosidades y estereocilios). Los cilios móviles contienen un axonema, formado por una disposición concéntrica de nueve dobletes de microtúbulos que rodean un par central. Los cilios parten de un cuerpo basal —una estructura derivada del centríolo—, que se inserta en la región apical de la membrana plasmática. A diferencia del axonema, el cuerpo basal y el centríolo están compuestos por nueve tripletes de microtúbulos en disposición helicoidal. No aparecen microtúbulos centrales en los cuerpos basales ni los centríolos. Las microvellosidades y los estereocilios inmóviles contienen un eje central de microfilamentos de actina. Las microvellosidades presentan una longitud uniforme. Los estereocilios son más largos, tienen una longitud variable y tienden a ramificarse en el epitelio del epidídimo. • Las moléculas de adhesión celular y las uniones celulares mantienen la posición y la estabilidad de las capas de células epiteliales. • Las moléculas de adhesión celular se dividen en dependientes de Ca2+ e independientes de Ca2+. Las cadherinas y las selectinas son dependientes de Ca2+. Las moléculas de adhesión celular (CAM) de la familia semejante a las inmunoglobulinas y las integrinas son independientes de este ión. A diferencia de las cadherinas, las selectinas y las CAM, las integrinas constan de dos subunidades, ␣ y , que dan lugar a un heterodímero. Las cadherinas forman cis-homodímeros homófilos (entre iguales) que interaccionan a través del dominio extracelular con dímeros semejantes o diferentes en las células epiteliales adyacentes (para originar trans-homodímeros o transheterodímeros [entre desiguales]). El dominio intracelular de las cadherinas interacciona con el complejo de las cateninas formado por las cateninas ␣,  y ␥. Este complejo interacciona con la actina filamentosa mediante proteínas adaptadoras (␣-actinina, vinculina y formina-1). Las selectinas se unen a ligandos de naturaleza glucídica a través de su dominio de reconocimiento de hidratos de carbono. Estas proteínas desempeñan una función destacada en el proceso de homing, en la migración transendotelial de los neutrófilos, los linfocitos y los macrófagos en las reacciones inflamatorias, y en la formación de estrías grasas en el espacio subendotelial de los vasos sanguíneos en las etapas iniciales del desarrollo de las lesiones ateroescleróticas. El dominio extracelular semejante a las inmunoglobulinas de las CAM se asocia a moléculas idénticas (unión homotípica) o diferentes (unión heterotípica) de otra célula adyacente. La molécula CAM CD4 constituye el receptor para el VIH-1 en los linfocitos T (linfocitos colaboradores). Las integrinas son heterodímeros formados por dos subunidades asociadas, ␣ y . El dominio extracelular de la subunidad  de las integrinas se une a laminina y fibronectina, dos componentes de la lámina basal. Los proteoglucanos y el colágeno se asocian a la laminina y la fibronectina para dar lugar a la lámina reticular. El dominio intracelular se une a la actina filamentosa a través de las proteínas adaptadoras ␣-actinina, vinculina y talina. Las integrinas vinculan la matriz extracelular con el citoesqueleto interno. • La membrana basal es una estructura positiva para PAS que aparece en el dominio basal de las células epiteliales. Se compone de una lámina basal y otra reticular, que pueden visualizarse con microscopia electrónica. El anatomopatólogo evalúa la integridad de la lámina basal con el fin de determinar si las células epiteliales malignas en proliferación se localizan sólo en la capa epitelial (carcinoma in situ) o bien han invadido el tejido conjuntivo suprayacente dotada de vasos sanguíneos y linfáticos. 1. EPITELIO C0005.indd 55 | 55 3/5/12 10:49:07 AM • Las proteínas ADAM presentan una relación funcional con las integrinas. El dominio desintegrina de algunas proteínas ADAM puede inhibir las afinidades de unión por las integrinas. El dominio metaloproteinasa de las ADAM interviene en la liberación del dominio extracelular de los factores de crecimiento, las citocinas y los receptores anclados a la membrana plasmática. Las proteínas ADAM lo hacen en la angiogenia, la fecundación, la neurogenia y el cáncer. • Las uniones celulares no se limitan a mantener la integridad mecánica del epitelio, sino que también actúan como estructuras de transmisión de señales que comunican la posición celular y pueden modular la proliferación de células o la muerte celular programada (apoptosis). Estas uniones pueden ser simétricas, como las uniones herméticas, los desmosomas en cinturón (zónula adherente), los desmosomas puntuales (mácula adherente) y las uniones comunicantes, y asimétricas, como los hemidesmosomas. • Las uniones herméticas se componen de dos proteínas transmembrana, las tetraespaninas ocludina y claudina, y dos proteínas similares a las inmunoglobulinas, las moléculas de adhesión de las uniones (JAM) y las nectinas. Estas últimas se asocian a la proteína afadina para crear el complejo afadina-nectina. Las JAM y las nectinas forman dímeros (denominados dímeros cis) y los dímeros localizados en las membranas plasmáticas enfrentadas interaccionan entre sí (dímeros trans). Las proteínas adaptadoras zónula oclusiva ZO-1, ZO-2 y ZO-3 vinculan las ocludinas, las claudinas, las JAM y el complejo afadina-nectina con los microfilamentos de actina. Las claudinas conforman el esqueleto de las hebras de las uniones herméticas, que pueden visualizarse en las microfotografías electrónicas de criofractura. Las uniones herméticas forman una barrera perimetral que separa el dominio apical del basolateral. Las moléculas pueden atravesar las láminas de células epiteliales y endoteliales por medio de dos vías diferentes: la vía transcelular y la vía paracelular. Estas uniones regulan el transporte paracelular de iones y moléculas de forma dependiente de la carga y el tamaño. De manera similar a las uniones herméticas, la zónula adherente (desmosomas en cinturón) muestra una distribución perimetral e interacciona con la actina filamentosa. Un rasgo distintivo de estas uniones es la presencia de una placa que contiene desmoplaquina, placoglobina (␥-catenina) y placofilina. Las cadherinas (desmocolinas y desmogleínas) y el complejo afadina-nectina actúan como vínculo de las membranas plasmáticas de las células epiteliales adyacentes. La región intracelular de las cadherinas interacciona con la actina a través del complejo de las cateninas. La mácula adherente (desmosoma puntual) confiere fuerza y rigidez a la capa de células epiteliales, en especial en el epitelio escamoso estratificado, y une los miocardiocitos adyacentes como componente de los discos intercalados. A diferencia de los desmosomas en cinturón, los puntuales son similares a un punto. La placa (formada por desmoplaquina, placoglobina y placofilina) constituye el sitio de inserción de los filamentos intermedios de queratina (llamados tonofilamentos) o desmina (disco intercalado). La desmoplaquina actúa como proteína de unión a los filamentos intermedios en la placa. No aparece el complejo de la catenina. Las cadherinas más abundantes son las desmocolinas y las desmogleínas. Los hemidesmosomas son uniones de anclaje asimétricas localizadas en la región basal de las células epiteliales. Los hemidesmosomas constan de dos componentes: una placa interna, asociada a los filamentos intermedios, y 56 | C0005.indd 56 una placa externa, que une el hemidesmosoma a la lámina basal a través de los filamentos de anclaje (laminina 5). Las uniones comunicantes son conexiones de comunicación simétricas (en lugar de uniones de anclaje). Estas uniones se componen de conjuntos de canales intercelulares que conectan el citoplasma de células adyacentes. Se distinguen más de 20 monómeros de conexinas, cada uno de los cuales se identifica por su masa molecular asignada. Seis monómeros de conexina forman un conexón, que se inserta en la membrana plasmática. Los conexones se aparean con sus homólogos en la membrana plasmática de la célula adyacente y forman un canal intercelular axial que permite la difusión de iones y pequeñas moléculas de una célula a otra. Una mutación del gen conexina32 (Cx32) de las células de Schwann que sintetizan mielina da lugar al síndrome de Charcot-Marie-Tooth ligado al cromosoma X, una enfermedad desmielinizante que afecta al sistema nervioso periférico. • La membrana basal está formada por dos elementos: una lámina basal, en contacto directo con la superficie de las células epiteliales basales, y una lámina reticular, compuesta por fibronectina y fibras de colágeno, y que se continúa con el tejido conjuntivo. La lámina basal contiene laminina, colágeno de tipo IV, entactina y proteoglucanos. Es un componente destacado de la barrera de filtración glomerular de los riñones. La superficie de las células musculares está recubierta por una lámina basal que favorece el mantenimiento de la integridad de las fibras del músculo esquelético durante la contracción. La alteración de la relación existente entre la lámina basal y las células musculares da lugar a las distrofias musculares. La membrana basal se reconoce en muestras teñidas con PAS en la microscopia óptica. • El citoesqueleto se compone de microfilamentos (7 nm de espesor), microtúbulos (25 nm de diámetro) y filamentos intermedios (10 nm de diámetro). La unidad básica de un microfilamento es el monómero de actina G. La polimerización dependiente de ATP de los monómeros da lugar a un filamento de actina F de 7 nm de espesor. Los monómeros que se añaden al extremo romo del filamento se desplazan, o se mueven como en una cinta continua, a lo largo del filamento hasta desprenderse por despolimerización en el extremo puntiagudo. Las proteínas motoras, como la miosina Va, transportan vesículas con mercancía a lo largo de la actina F. La miosina Va defectuosa origina el síndrome de Griscelli, una alteración del transporte de los melanosomas a los queratinocitos en la epidermis. Los sujetos afectados por esta entidad presentan cabello plateado, albinismo parcial, anomalías neurológicas ocasionales e inmunodeficiencias. La actina F asociada a miosina II forma las estructuras contráctiles de las células de los músculos esquelético y cardíaco. Representan los componentes de miofilamentos de las miofibrillas. Estas se componen de una cadena lineal de sarcómeros y constituyen la unidad contráctil básica presente en el citoplasma de las células del músculo estriado. Los microtúbulos están formados por dímeros de ␣ y  tubulina. Los dímeros de tubulina se organizan longitudinalmente para dar lugar a protofilamentos. La asociación laterolateral de 13 protofilamentos origina un microtúbulo. Los microtúbulos sufren fases alternas de polimerización lenta y despolimerización rápida, un proceso conocido como inestabilidad dinámica. La polimerización de las subunidades de tubulina depende del GTP. Los microtúbulos organizan el centrosoma, una estructura formada por un par de centríolos rodeados de matriz Histología y biología celular. Introducción a la anatomía patológica 3/5/12 10:49:07 AM © Elsevier. Fotocopiar sin autorización es un delito . pericentriolar. Cada centríolo se compone de nueve tripletes de microtúbulos en disposición helicoidal. Los centríolos se duplican a lo largo del ciclo celular con anterioridad al ensamblaje del huso mitótico durante la división celular. Los centríolos originan los cuerpos basales, de los que provienen los cilios. El aparato mitótico se compone de un centro mitótico, representado por el centrosoma, y el huso mitótico, formado por tres tipos de microtúbulos: 1) microtúbulos radiales; 2) microtúbulos cinetocóricos, y 3) microtúbulos polares. Los microtúbulos cinetocóricos se unen al cinetocoro, un agregado proteico asociado al centrómero, la constricción primaria del cromosoma. Centrosoma y centrómero son términos similares, si bien representan dos estructuras distintas. La quimioterapia antitumoral actúa frente a los microtúbulos con el fin de inhibir la división de las células tumorales a través de la desestabilización o la estabilización de la inestabilidad dinámica. Se han utilizado de manera frecuente los derivados de los alcaloides de la vinca y el paclitaxel. El axonema consta de nueve dobletes de microtúbulos en disposición concéntrica, rodeados por un par central de microtúbulos. Cada doblete se compone de un túbulo A, formado por 13 protofilamentos, y se une estrechamente a un túbulo B, integrado por 10-11 protofilamentos. Los cilios y los flagelos de la cola del espermatozoide contienen axonemas. Los brazos de dineína, una ATPasa, se unen al túbulo A. La ATPasa hidroliza ATP para obtener la energía necesaria para el desplazamiento de los microtúbulos, el fundamento del movimiento ciliar y flagelar. Los microtúbulos constituyen las vías para el transporte de mercancías, contenidas o no en vesículas, mediado por proteínas motoras en el seno de la célula. Los motores moleculares, como la cinesina y la dineína citoplásmica, intervienen en el transporte de mercancías. Se conocen tres sistemas principales de transporte basados en microtúbulos: transporte axonémico, que engloba los transportes intraciliar e intraflagelar; el transporte axónico; y el transporte intramanguito. El manguito es una estructura temporal que participa en el desarrollo de los espermatozoides. El síndrome de Bardet-Biedl, una alteración de los cuerpos basales y de los cilios que deriva de anomalías del transporte intraciliar, cursa con distrofia retiniana, obesidad, polidactilia, displasia renal, anomalías del aparato reproductor y dificultades de aprendizaje. El síndrome de Kartagener, un trastorno de los axonemas por afectación o ausencia de los brazos de dineína, se asocia a bronquiectasias e infertilidad (disminución de la movilidad de los espermatozoides y del transporte de los óvulos en el oviducto). Los filamentos intermedios se componen de monómeros que presentan un eje enrollado central flanqueado por regiones globulares. A diferencia de la actina F y de los microtúbulos, el ensamblaje de los filamentos intermedios está controlado por la fosforilación-desfosforilación. Se distinguen varios tipos de filamentos intermedios, como las queratinas de tipos I y II (marcadores de las células epiteliales), la vimentina (presente en las células de origen mesenquimatoso), la desmina (abundante en las células musculares), la proteína gliofibrilar ácida (marcadora de las células gliales), los neurofilamentos (presentes en la neuronas) y las laminas (que integran la lámina nuclear asociada a la capa interna de la envoltura nuclear). Las alteraciones de las queratinas dan lugar a enfermedades ampollosas de la piel. La expresión génica anómala de las laminas origina un grupo de trastornos conocidos como laminopatías, las cuales afectan al tejido muscular (p. ej., distrofia muscular de Emery-Dreifuss), al nervioso (enfermedad de Charcot-Marie-Tooth de tipo 2B1) y al adiposo (lipodistrofia familiar de tipo Dunnigan). • El núcleo celular se compone de la envoltura nuclear, la cromatina y el nucléolo. La envoltura nuclear presenta poros nucleares, una estructura triple formada por anillos octagonales interno y externo, y un cuerpo cilíndrico central. Los poros nucleares contienen varias proteínas, las nucleoporinas. La Ran-GTPasa regula el transporte nucleocitoplásmico a través de los poros nucleares al permitir el paso de proteínas con una secuencia de importación nuclear unida a un complejo proteico de importinas ␣ y  y RanGDP. En el núcleo, Ran-GDP se convierte en Ran-GTP por acción de RCCI, una proteína intercambiadora de GDP por GTP, lo que induce la disociación del complejo importina-proteína importada. Ran-GTP se asocia a las exportinas y las proteínas portadoras de una secuencia de exportación nuclear son transferidas al citoplasma. Ran-GTP interacciona con Ran-GBP1 y se convierte en Ran-GDP por hidrólisis, estimulada por Ran-GAP. Se libera la proteína transportada y Ran-GDP puede comenzar un nuevo ciclo de transporte. Se han descrito dos formas de cromatina: heterocromatina (inactiva desde el punto de vista de la transcripción) y eucromatina (activa). Uno de los dos cromosomas X de cada célula somática femenina se mantiene condensado, lo que recibe el nombre de compensación de la dosis. El cromosoma X condensado se visualiza como una masa de heterocromatina próxima a la envoltura nuclear (llamado corpúsculo de Barr) o como un palillo de tambor en los leucocitos polimorfonucleares. El nucléolo se compone de un centro fibrilar (cromatina con genes repetidos para el ARNr, ARN polimerasa I y SRP); un componente fibrilar denso (con las proteínas fibrilarina y nucleolina); y un componente granular (lugar de ensamblaje de las subunidades ribosómicas). Las técnicas de tinción y autorradiografía permiten identificar la localización de los ácidos nucleicos en las células. La reacción de Feulgen detecta la presencia de ADN. Los colorantes básicos indican la localización del ADN y el ARN. El pretratamiento con ARNasa y ADNasa se utiliza para definir la identidad de las estructuras basófilos. La autorradiografía se basa en la administración de un precursor radiomarcado en células vivas. Se pueden visualizar los puntos radioactivos por medio de una emulsión fotográfica, cuyo revelado y fijación ponen de manifiesto la presencia de granos plateados en los sitios en los que se localiza el precursor radiomarcado. Esta técnica permite estudiar el ciclo celular y la localización de las estructuras implicadas en la síntesis de proteínas, en la glucosilación y en el transporte. La selección de células activadas por fluorescencia hace posible la identificación y la separación de distintos tipos celulares por medio de marcadores de superficie celular, así como la investigación del ciclo celular basada en el contenido de ADN. • El ciclo celular se define como el intervalo comprendido entre dos divisiones celulares sucesivas (mitótica y meiótica) que da lugar a la producción de dos células hijas. Desde el punto de vista tradicional, el ciclo celular se ha dividido en dos fases principales: 1) interfase, y 2) mitosis (o meiosis). La interfase incluye la fase S (síntesis de ADN), la cual se ve precedida por la G1 y se sigue de la G2. Las fases de la mitosis son las siguientes: 1. Profase (los centrosomas organizan el huso mitótico; las laminas se fosforilan; cada cromosoma se compone de cromátidas hermanas unidas en el centrómero; la proteína cohesina mantiene la asociación entre las regiones no centroméricas; la condensina compacta la cromatina). 1. EPITELIO C0005.indd 57 | 57 3/5/12 10:49:07 AM 2. Metafase (los microtúbulos cinetocóricos se asocian al cinetocoro presente en cada cromosoma; los cromosomas se alinean en la placa ecuatorial; el complejo promotor de la anafase se desensambla cuando la unión de los microtúbulos cinetocóricos es correcta). 3. La anafase (la topoisomerasa libera las fibras enmarañadas de cromatina; las cromátidas se separan unas de otras y se aproximan a los polos correspondientes —anafase A— y los polos celulares separados por acción de los microtúbulos polares —anafase B—). 4. Telofase (las láminas se desfoforilan y la envoltura nuclear se reorganiza; los cromosomas se descondensan; se forma un anillo contráctil [actina-miosina] durante la citocinesis; los microtúbulos del huso desaparecen). La noción contemporánea del ciclo celular lo divide en tres ciclos diferentes: 1) ciclo citoplásmico (activación secuencial de las proteína cinasas dependientes de ciclinas); 2) ciclo nuclear (replicación del ADN y condensación de los cromosomas), y 3) ciclo centrosómico (duplicación de los dos centríolos —centríolos madre e hijo— para la preparación del ensamblaje del aparato mitótico). La cariotipificación es el análisis estructural y numérico de los cromosomas metafísicos. Un hombre normal posee un complemento cromosómico 46,XY (46 cromosomas, incluido el par XY). Una mujer normal cuenta con 46,XX (46 cromosomas, incluido el par XX). Los cromosomas se clasifican como metacéntricos, submetacéntricos o acrocéntricos en función de la posición del centrómero o de la constricción primaria. Las proteína cinasas dependientes de ciclinas controlan el avance y la finalización del ciclo celular, y las proteínas supresoras de tumores, el avance de dicho ciclo. La proteína Rb desfosforilada, una proteína supresora de tumores, se asocia a ciertos factores de transcripción para inhibir la 58 | C0005.indd 58 actividad génica. Los factores de transcripción se separan de la proteína Rb fosforilada y estimulan el avance del ciclo celular. El retinoblastoma, un tumor ocular maligno, se desarrolla en sujetos portadores de una mutación en el gen Rb. Otra proteína supresora de tumores es p53, un factor de transcripción que interviene en la regulación del ciclo celular. En los pacientes con leucemia, linfoma y tumores cerebrales se observan mutaciones del gen p53. p53 confiere protección a la célula: puede inducir apoptosis o detención del ciclo celular cuando la célula está sometida a estrés nocivo (denominado estrés genotóxico). Las mutaciones del gen p53 anulan esta función protectora. El síndrome de Li-Fraumeni se debe a una mutación del gen p53. Los pacientes jóvenes presentan predisposición al desarrollo tumoral (tumores cerebrales y mamarios, leucemia aguda, y sarcomas óseos y de partes blandas). La desorganización de la envoltura nuclear tiene lugar hacia el final de la profase. Implica la fragmentación de la envoltura nuclear, la disociación de los complejos del poro nuclear y la fosforilación de las laminas (despolimerización). La reorganización de la envoltura nuclear depende de la desfosforilación de las láminas por acción de una proteína fosfatasa. Los telómeros son las regiones terminales de los cromosomas formados por una hilera de secuencias de nucleótidos repetidas. La longitud de los telómeros disminuye en cada división celular hasta que resulta imposible mantener la integridad del cromosoma cuando la ADN polimerasa es incapaz de copiar los extremos del mismo. Las células germinales masculinas y femeninas protegen a los telómeros a través de la enzima telomerasa, la cual no aparece en las células somáticas. Casi todas las células tumorales expresan la telomerasa. Histología y biología celular. Introducción a la anatomía patológica 3/5/12 10:49:07 AM