UNEFA Química General Ing. Arévalo Uribe
Anuncio

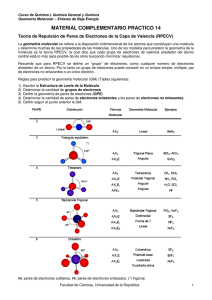
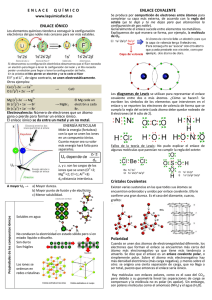
UNEFA Química General Ing. Arévalo Uribe UNIDAD 3. ENLACE QUIMICO 3.1 Enlace Químico Son las fuerzas de atracción que mantienen unidos a los átomos en sus formas combinadas, se producen como resultado de la compartición o transferencia de electrones. En las reacciones químicas se crean o se destruyen enlaces químicos. Enlace Covalente: se produce al compartir un par de electrones entre átomos, la fuerza de enlace proviene de la atracción entre estos electrones compartidos y el núcleo positivo que entra en el enlace. Representación Simbólica. Para la representación de los enlaces covalentes se emplea la simbología de Lewis (Químico Norteamericano G.N. Lewis 1875-1946) Ejemplo: para el Hidrogeno H2 H H H : H Ejemplo: para el Metano CH4 Ejemplo: para el Amoniaco NH3 Ejemplo: para el Agua H2O Regla del Octeto: regla que especifica la tendencia de los átomos a formar una configuración electrónica de 8 electrones en la última capa del átomo, esta configuración da estabilidad debido a que los orbitales s y p están completos. UNEFA Química General Ing. Arévalo Uribe 3.2 Enlace Iónico: enlace formado por un anión (átomo que gana electrones) y un catión (átomo que pierde electrones), estos iones se atraen electrostáticamente, formando un enlace muy fuerte, el compuesto resultante es un solidó, conductor de electricidad, duro, frágil y puede disolverse en agua. Ejemplo: para el Fluoruro de Litio LiF Ejemplo: para el Cloruro de Sodio NaCl Energía de Enlace: es la energía que se requiere para romper el enlace y producir fragmentos neutros. 3.3 Polaridad y Electronegatividad La Electronegatividad se define como la atracción por los electrones que un átomo tiene en un enlace químico. Si las electronegatividades de dos átomos en un enlace son diferentes, el par de electrones pasara la mayor parte de sus tiempo alrededor del elemento mas electronegativo, produciendo que un átomo adquiera carga positiva y el otro un carga negativa. Ejemplo: para el HCl H Cl Donde δ+ y δ- indican las cargas parciales positiva y negativa respectivamente. Las cargas positivas y negativas separadas por cierta distancia forman lo que se conoce como un dipolo, por lo tanto la molécula de HCl es un dipolo, y de allí se dice que la molécula es Polar. Cuantitativamente un dipolo esta definido por su momento dipolar, que es el producto de la carga de cualquiera de los extremos bipolares multiplicada por la distancia entre las cargas. UNEFA Química General Ing. Arévalo Uribe Una molécula Polar es aquella que tiene un momento dipolar grande, mientras que una molécula no polar no tendrá ningún momento dipolar. Ejemplo: para el CO2 O C O El momento dipolar global de una molécula corresponde a la suma de los enlaces bipolares individuales dentro de la molécula, que se adicionan como vectores.