Fuerzas intermoleculares
Anuncio
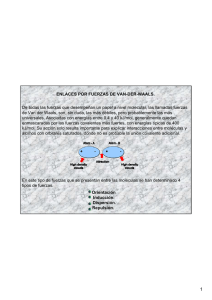
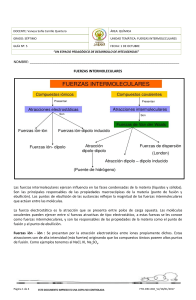
Fuerzas intermoleculares • Las fuerzas intermoleculares son aquellas interacciones que se dan entre las moléculas y hacen que éstas se mantengan unidas. • Dependen del dipolo eléctrico de las moléculas. • En el fluoruro de hidrógeno, HF, el flúor atrae con más fuerza a los electrones que el hidrógeno, pero los electrones que se comparten entre los dos átomos no se han cedido de uno a otro como en el caso de una interacción iónica: Por lo tanto, decimos que el flúor es más electronegativo que el hidrógeno • El momento dipolar se da en las sustancias moleculares; es decir, aquellas sustancias que presentan interacciones covalentes, y representa la distribución de la densidad electrónica en un enlace. • Depende de la electronegatividad de los átomos que forman el enlace. Electronegatividad • Es la capacidad de un átomo para atraer electrones hacia sí mismo en un enlace. Comportamiento periódico Predicción del tipo de enlace • ∆χ = 0 enlace covalente no polar • 1.9 < ∆χ < 0 enlace covalente polar • ∆χ > 1.9 enlace iónico CsF NaCl LiBr HF BF3 ∆χ = ∆χ = ∆χ = ∆χ = ∆χ = 4.0 – 0.7 = 3.3 3.0 – 0.9 = 2.1 2.8 – 1.0 = 1.8 4.0 – 2.1 = 1.9 4.0 – 2.0 = 2.0 Óxidos • • • • Na2O ∆χ = 2.4 CaO ∆χ = 2.5 FeO ∆χ = 1.7 Al2O3 ∆χ = 2.0 • Sólidos (redes) • CO2 ∆χ = 1.0 • NO2 ∆χ = 0.5 • SO3 ∆χ = 1.0 • Gases (moléculas) La polaridad depende también de la geometría de la molécula Efectos del momento dipolo metanol etano H H H H C H C H H H PM= 30, T.eb. = -88°C tolueno C H O H PM= 32, T.eb. = 65°C fenol CH3 O H PM= 92, T.eb= 110°C PM= 94, T.eb= 180°C Interacciones dipolo instantáneo— dipolo inducido • Son aquellas interacciones que se producen entre las moléculas o los átomos que no presentan ni carga ni momento dipolo permanente. • En estos casos se forma primero un dipolo instantáneo, el cual puede generar un dipolo inducido. • La probabilidad para que un átomo se polarice se da en mayor medida en átomos más grandes y que, por consiguiente, tienen más electrones Interacciones dipolo-dipolo inducido • El dipolo permanente se presenta cuando las moléculas contienen átomos con distinto valor de electronegatividad. • Una molécula con dipolo permanente puede inducir un dipolo en otra molécula. Esta interacción se conoce como dipolodipolo inducido. Ácido acético Dipolo permanente δ+ Yodo Dipolo inducido δ- Interacciones dipolo-dipolo • Cuando en una sustancia existen interacciones dipolo-dipolo, es muy probable que pueda disolverse en otra sustancia en la que también se encuentran estas interacciones. Interacciones puente de hidrógeno • La interacción entre el átomo de hidrógeno de una molécula, y un átomo con un alto valor de electronegatividad (O, F, N) de otra molécula, se conoce como puente de hidrógeno. • La temperatura de ebullición depende de esta interacción en muchos casos.