ENLACES POR FUERZAS DE VAN-DER
Anuncio

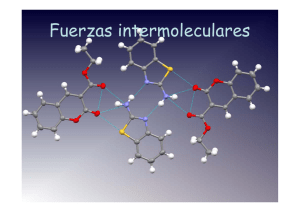
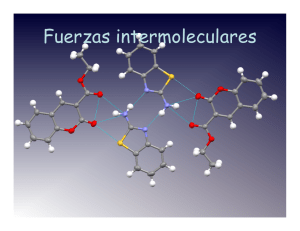
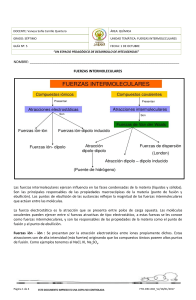
ENLACES POR FUERZAS DE VAN-DER-WAALS. De todas las fuerzas que desempeñan un papel a nivel molecular, las llamadas fuerzas de Van der Waals, son, sin duda, las más débiles, pero probablemente las más universales. Asociadas con energías entre 0.4 y 40 kJ/mol, generalmente quedan enmascaradas por las fuerzas covalentes más fuertes, con energías típicas de 400 kJ/mol. Su acción solo resulta importante para explicar interacciones entre moléculas y átomos con orbitales saturados, donde no es probable la unión covalente adicional. En este tipo de fuerzas que se presentan entre las moléculas se han determinado 4 tipos de fuerzas. Orientación Inducción. Dispersión. Repulsión. 1 1.- ORIENTACIÓN : Es la primera fuerza de tipo atractivo, conduce a lo que se llama energía de orientación y está presente en las agrupaciones moleculares, se presenta en moléculas con dipolo permanente orientándose de acuerdo a sus cargas como son HCl, NH3, H2O etc. 2.- INDUCCIÓN.- Este tipo de fuerza se presenta entre moléculas con dipolo permanente y otra sin dipolo permanente este último bajo la influencia del primero se distorciona y orienta con relación a la primera formando un dipolo inducido. Las cargas contrarias quedan orientadas como en el primer caso, pero la energía en este caso es de inducción. La interacción atractiva entre el dipolo permanente y el dipolo inducido proporciona la segunda contribución de Van der Waals. 2 3.- DISPERSIÓN.- Es la tercera clase de fuerza que conduce a la energía de dispersión, explica el comportamiento de los gases nobles y al mismo tiempo resulta ser el principal contribuyente a la atracción de Van der Waals. La energía de dispersión se atribuye a la atracción entre dos dipolos inducidos 4.- REPULSION.- La cuarta fuerza necesariamente grande y repulsiva, se manifiesta cuando las nubes electrónicas saturadas de electrones empiezan a traslaparse. Esta energía se conoce como energía de repulsión de LONDON y predominan sobre las energías anteriores. 3 Relación del material con el tipo de enlace químico 4 5