Un tratamiento con Perjeta, de Roche, ha permitido a pacientes con
Anuncio

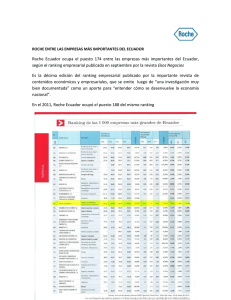
Comunicado de prensa Basilea, 1 de junio de 2015 Un tratamiento con Perjeta, de Roche, ha permitido a pacientes con cáncer de mama precoz HER2-positivo vivir más tiempo sin reaparición o empeoramiento de la enfermedad que con un régimen de Herceptin y quimioterapia Nuevos datos del estudio de fase II NeoSphere proporcionan información adicional sobre el papel de Perjeta en el tratamiento neoadyuvante (previo a la cirugía) del cáncer de mama precoz (incipiente) HER2-positivo. Los datos sugieren que la ventaja observada en el análisis principal del estudio para el tratamiento que incluía Perjeta respecto a la combinación de Herceptin y quimioterapia podría traducirse en mejores resultados a largo plazo para las pacientes. Estos datos se suman a otros que sugieren una asociación entre la respuesta completa anatomopatológica (RCa) y los resultados a largo plazo en pacientes con cáncer de mama precoz HER2-positivo. Roche (SIX: RO, ROG; OTCQX: RHHBY) ha dado a conocer hoy nuevos resultados del estudio de fase II NeoSphere, los cuales sugieren que la administración previa a la cirugía de Perjeta® (pertuzumab) en combinación con Herceptin® (trastuzumab) y quimioterapia a base de docetaxel reduce el riesgo de empeoramiento de la enfermedad e incrementa el tiempo de supervivencia sin reaparición del cáncer en pacientes con cáncer de mama precoz (CMp) HER2-positivo con respecto a la administración de Herceptin y quimioterapia únicamente. El perfil de seguridad del régimen que incluía Perjeta coincidió con el observado en estudios anteriores, sin que se identificasen nuevas señales de riesgo. Los datos serán anunciados hoy en el 51.º congreso anual de la Sociedad Estadounidense de Oncología Clínica (ASCO) que se celebra en Chicago; la presentación correrá a cargo del Dr. Luca Gianni, del área de Oncología Médica del Instituto Científico del Hospital San Raffaele (resumen n.º 505). En el estudio NeoSphere se evaluaron a los tres años tanto la supervivencia sin progresión (SSP) de la enfermedad como la supervivencia sin enfermedad (SSE). Los resultados sugieren que quienes recibieron el tratamiento con Perjeta antes de la cirugía tenían una probabilidad un 31 % menor de experimentar un F. Hoffmann-La Roche Ltd 4070 Basel Suiza Group Communications Roche Group Media Relations Tfno. +41 61 688 88 88 Fax +41 61 688 27 75 www.roche.com 1/6 empeoramiento de la enfermedad, sufrir una recidiva o fallecer que quienes únicamente recibieron Herceptin y quimioterapia (hazard ratio [HR] para la SSP = 0,69; intervalo de confianza [IC] del 95 %: 0,34–1,40)1. Asimismo, las pacientes que recibieron la terapia con Perjeta tenían una probabilidad un 40 % menor de sufrir una recidiva o morir (HR para la SSE = 0,60; IC 95 %: 0,28-1,27)1. Las pacientes del estudio NeoSphere que recibieron una terapia neoadyuvante también recibieron un tratamiento adyuvante (tras la cirugía) de un año de duración con Herceptin y quimioterapia. Los resultados de este análisis tienen carácter descriptivo, ya que el estudio no estaba diseñado para proporcionar datos estadísticamente significativos sobre la SSP y SSE a los tres años. «Tratar el cáncer de mama de forma temprana, antes de que se extienda, puede ayudar a impedir que la enfermedad reaparezca o alcance un estadio avanzado —señala Sandra Horning, directora médica y máxima responsable del área de Desarrollo Internacional de Roche—. Estos nuevos resultados vienen a añadirse al conjunto de datos sobre Perjeta en el contexto del tratamiento neoadyuvante. Por otra parte, esperamos con interés los resultados del estudio de fase III APHINITY para comprender de forma más amplia el impacto de Perjeta para el tratamiento adyuvante del cáncer de mama precoz HER2-positivo». Los resultados también sugieren que las pacientes que alcanzaron una respuesta completa anatomopatológica (RCa) —es decir, aquellas en quienes en el momento de la cirugía no se detectó tejido tumoral en la mama afectada ni en los ganglios linfáticos locales— tenían una mayor probabilidad, en todos los grupos del estudio, de sobrevivir tres años sin reaparición o progresión de la enfermedad (HR para la SSP = 0,54 , IC 95 % = 0,29-1,00; HR para la SSE = 0,68 , IC 95 % = 0,36-1,26), lo que respalda la asociación de la RCa con mejores resultados clínicos a largo plazo1. Ya se notificó en su momento que el tratamiento que incluía Perjeta aumentó significativamente el porcentaje de pacientes que logró una RCa con respecto al tratamiento exclusivo con Herceptin y quimioterapia (39,3 % frente a 21,5 %)2 . Los nuevos datos presentados ahora en el congreso de la ASCO sugieren que esta mayor tasa de RCa observada con la combinación de Perjeta, Herceptin y quimioterapia podría traducirse en mejores resultados clínicos a largo plazo para las pacientes. En 2013, la FDA estadounidense concedió una autorización provisional acelerada (o «condicional») del régimen que incluye Perjeta para el tratamiento neoadyuvante de pacientes con CMp HER2-positivo de alto riesgo. Para que esta autorización acelerada dé paso a una autorización plena, deberán evaluarse a fondo los datos del estudio de fase III APHINITY, aún en curso, en el que se compara la administración de Perjeta, 2/6 Herceptin y quimioterapia con la administración exclusiva de Herceptin y quimioterapia para el tratamiento adyuvante (posterior a la cirugía) de pacientes con CMp HER2-positivo. Se espera disponer de los datos de APHINITY en 2016. Roche ha presentado recientemente ante la Agencia Europea de Medicamentos (EMA) la solicitud de autorización de comercialización del régimen con Perjeta para el tratamiento neoadyuvante del CMp HER2positivo. La solicitud de autorización se basó fundamentalmente en los resultados del estudio NeoSphere, con datos adicionales del estudio de fase II TRYPHAENA y datos de seguridad a largo plazo del estudio de fase III CLEOPATRA, que evaluó Perjeta en pacientes con cáncer de mama avanzado HER2-positivo. Acerca del estudio NeoSphere3 El estudio NeoSphere (Neoadjuvant Study of Pertuzumab and Herceptin in an Early Regimen Evaluation, «Estudio neoadyuvante del pertuzumab y Herceptin para la evaluación de un régimen terapéutico temprano») es un estudio internacional multicéntrico aleatorizado de fase II en 417 personas con CMp HER2-positivo recién diagnosticado y operable, localmente avanzado o inflamatorio. Las participantes fueron asignadas aleatoriamente a uno de los cuatro grupos del estudio y recibieron cuatro ciclos (12 semanas) de tratamiento neoadyuvante seguido de cirugía y un año de tratamiento adyuvante con Herceptin y quimioterapia. La variable principal de valoración fue la respuesta completa anatomopatológica (RCa). Las variables secundarias fueron la respuesta clínica, el tiempo hasta la respuesta clínica, el perfil de seguridad, la supervivencia sin enfermedad, la supervivencia sin progresión de la enfermedad, la tasa de cirugía conservadora de la mama y la evaluación de biomarcadores. Los nuevos datos indican: La tasa de SSP a los tres años fue del 90 % en el grupo cuyo tratamiento incluía Perjeta, frente al 86 % en el grupo tratado únicamente con Herceptin y quimioterapia con docetaxel (HR = 0,69). La tasa de SSE fue del 92 % en quienes recibieron el régimen con Perjeta, frente al 85 % en el grupo tratado únicamente con Herceptin y quimioterapia con docetaxel (HR = 0,60). El perfil de seguridad coincidió con el observado en estudios anteriores sobre Perjeta, sin que se identificasen nuevas señales de riesgo. 3/6 Los datos del análisis principal2 ya comunicados en su día indicaban lo siguiente: • El tratamiento con Perjeta, Herceptin y quimioterapia a base de docetaxel mejoró significativamente en 17,8 puntos porcentuales la tasa de RCa en la mama afectada y los ganglios locales en comparación con el que únicamente incluía Herceptin y quimioterapia (39,3 % frente a 21,5 %; p = 0,0063). - La RCa fue del 21,5 % con Herceptin y quimioterapia - La RCa fue del 39,3 % con Perjeta, Herceptin y quimioterapia - La RCa fue del 11,2 % con Perjeta y Herceptin - La RCa fue del 17,7 % con Perjeta y quimioterapia El régimen que incluía Perjeta no supuso un aumento significativo de los acontecimientos adversos (AA) en comparación con el que únicamente incluía Herceptin y quimioterapia. Los AA graves (de grado 3 o superior) más frecuentes en el grupo tratado con Perjeta fueron neutrocitopenia (44,9 %), neutrocitopenia febril (8,4 %), leucocitopenia (4,7 %) y diarrea (5,6 %). Acerca de Perjeta Perjeta es un medicamento que actúa sobre el receptor HER2, una proteína presente en el exterior de numerosas células normales y que en los tumores HER2-positivos se halla incrementada en el exterior de las células cancerosas. Perjeta está diseñado específicamente para evitar el emparejamiento (dimerización) del receptor HER2 con otros receptores HER (EGFR/HER1, HER3 y HER4) de la superficie celular, un proceso que, según se cree, desempeña un papel para el crecimiento y la supervivencia de los tumores. La unión de Perjeta a HER2 también podría constituir una señal para que el sistema inmunitario del propio organismo destruya las células cancerosas. Se cree que los mecanismos de acción de Perjeta y Herceptin se complementan, ya que ambos se ligan al receptor HER2 pero lo hacen en sitios distintos. Se piensa que la combinación de Perjeta y Herceptin bloquea de forma más completa las vías de señalización de HER, previniendo así el crecimiento y la supervivencia de las células tumorales. Acerca de los medicamentos de Roche contra el cáncer de mama HER2-positivo Roche lleva más de 30 años encabezando la investigación de la vía HER2 y está comprometida a mejorar la salud, la calidad de vida y la supervivencia de las personas con tumores HER2-positivos tanto de estadio temprano como avanzado. Roche ha desarrollado tres medicamentos innovadores que han ayudado a transformar el tratamiento del cáncer de mama HER2-positivo: Herceptin, Perjeta y Kadcyla. El cáncer de mama HER2-positivo es una forma particularmente agresiva de la enfermedad que afecta aproximadamente al 20 % de las pacientes4. A lo 4/6 largo de los últimos 15 años, el pronóstico para las pacientes con tumores HER2-positivos ha mejorado hasta el punto de que actualmente su evolución clínica cuando son tratadas con estos medicamentos innovadores es generalmente mejor que la de las pacientes con tumores HER-negativos menos agresivos5. La idoneidad para recibir tratamiento con los medicamentos de Roche dirigidos contra HER2 se determina mediante una prueba diagnóstica, que ahorra tiempo desde el primer momento al identificar en el momento de la aparición de la enfermedad a aquellas pacientes a las que resulta probable que beneficien dichos fármacos. Acerca de Roche Roche, cuya sede central se halla en Basilea (Suiza), es una compañía líder del sector de la salud, centrada en la investigación y con la potencia combinada de la integración farmacéutica-diagnóstica. Roche es la mayor empresa biotecnológica del mundo y tiene medicamentos auténticamente diferenciados en las áreas de oncología, inmunología, enfermedades infecciosas, oftalmología y neurociencias. Roche también es el líder mundial en diagnóstico in vitro y diagnóstico histológico del cáncer, y se sitúa a la vanguardia en el control de la diabetes. La estrategia de Roche en medicina personalizada tiene como fin proporcionar medicamentos y pruebas diagnósticas que hagan posibles mejoras tangibles de la salud, la calidad de vida y la esperanza de vida de los pacientes. Fundada en 1896, Roche lleva más de un siglo contribuyendo de manera importante a mejorar la salud en todo el mundo. La Lista de Medicamentos Esenciales de la Organización Mundial de la Salud contiene 28 medicamentos desarrollados por Roche, entre ellos antibióticos, antipalúdicos y quimioterápicos que salvan vidas. En el año 2014, el Grupo Roche tenía 88 500 empleados, invirtió 8900 millones de francos suizos en Investigación y Desarrollo y sus ventas alcanzaron la cifra de 47 500 millones de francos suizos. Genentech, en Estados Unidos, es un miembro de plena propiedad del Grupo Roche. Roche es el accionista mayoritario de Chugai Pharmaceutical (Japón). Para más información, consulte la página roche.com. Todas las marcas comerciales mencionadas en este comunicado de prensa están protegidas por la ley. Más información Roche en oncología: www.roche.com/media/media_backgrounder/media_oncology.htm. Síganos en Twitter (@roche) y en LinkedIn (https://www.linkedin.com/company/1602). 5/6 Relaciones con la prensa del Grupo Roche Teléfono: +41 -61 688 8888 / Correo electrónico: basel.mediaoffice@roche.com - Nicolas Dunant (director) - Ulrike Engels-Lange - Štěpán Kráčala - Nicole Rüppel - Claudia Schmitt - Nina Schwab-Hautzinger Referencias 1 Gianni L, et al. American Society for Clinical Oncology 2015; Abstract #505. 2 Gianni L, et al. Lancet Oncol 2012; 13: 25-32. 3 F. Hoffmann-La Roche. ClinicalTrials.gov NCT00545688. National Library of Medicine. Disponible en: https://clinicaltrials.gov/ct2/show/NCT00545688 4 Wolff AC, et al. J Clin Oncol 2013; 31(31): 3997-4013. 5 Dawood S, et al. J Clin Oncol 2010; 28: 92. 6/6