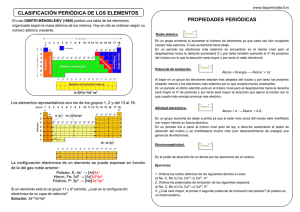
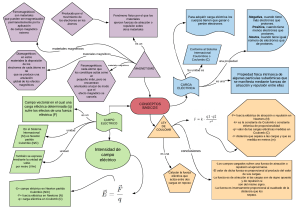
PROPIEDADES PERIÓDICAS Radio atómico:
Anuncio
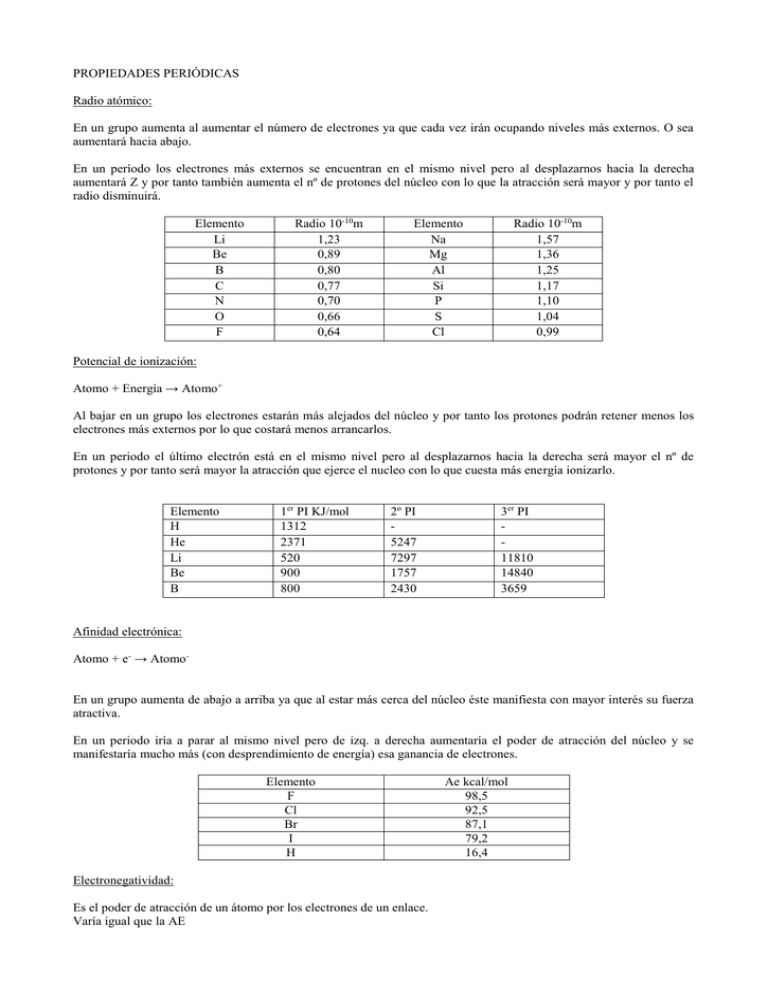
PROPIEDADES PERIÓDICAS Radio atómico: En un grupo aumenta al aumentar el número de electrones ya que cada vez irán ocupando niveles más externos. O sea aumentará hacia abajo. En un período los electrones más externos se encuentran en el mismo nivel pero al desplazarnos hacia la derecha aumentará Z y por tanto también aumenta el nº de protones del núcleo con lo que la atracción será mayor y por tanto el radio disminuirá. Elemento Li Be B C N O F Radio 10-10m 1,23 0,89 0,80 0,77 0,70 0,66 0,64 Radio 10-10m 1,57 1,36 1,25 1,17 1,10 1,04 0,99 Elemento Na Mg Al Si P S Cl Potencial de ionización: Atomo + Energía → Atomo+ Al bajar en un grupo los electrones estarán más alejados del núcleo y por tanto los protones podrán retener menos los electrones más externos por lo que costará menos arrancarlos. En un periodo el último electrón está en el mismo nivel pero al desplazarnos hacia la derecha será mayor el nº de protones y por tanto será mayor la atracción que ejerce el nucleo con lo que cuesta más energía ionizarlo. Elemento H He Li Be B 1er PI KJ/mol 1312 2371 520 900 800 2º PI 5247 7297 1757 2430 3er PI 11810 14840 3659 Afinidad electrónica: Atomo + e- → Atomo- En un grupo aumenta de abajo a arriba ya que al estar más cerca del núcleo éste manifiesta con mayor interés su fuerza atractiva. En un periodo iría a parar al mismo nivel pero de izq. a derecha aumentaría el poder de atracción del núcleo y se manifestaría mucho más (con desprendimiento de energía) esa ganancia de electrones. Elemento F Cl Br I H Electronegatividad: Es el poder de atracción de un átomo por los electrones de un enlace. Varía igual que la AE Ae kcal/mol 98,5 92,5 87,1 79,2 16,4