Diapositiva 1
Anuncio
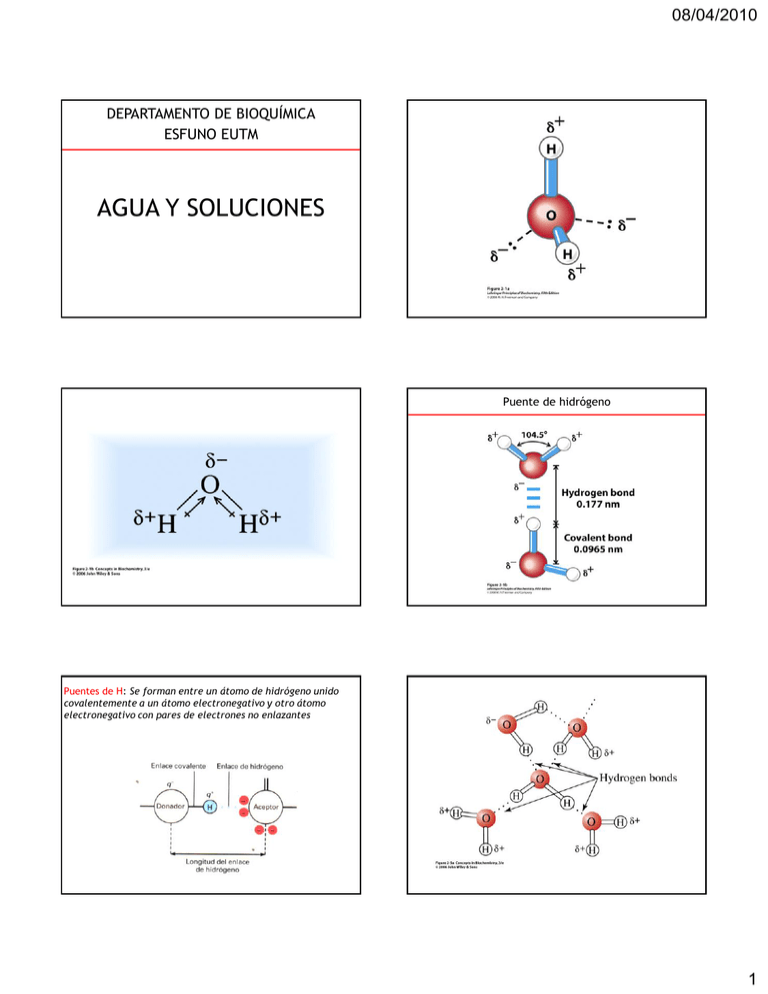
08/04/2010 DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM AGUA Y SOLUCIONES Puente de hidrógeno Puentes de H: Se forman entre un átomo de hidrógeno unido covalentemente a un átomo electronegativo y otro átomo electronegativo con pares de electrones no enlazantes 1 08/04/2010 Formación de puentes de hidrógeno en biomoléculas Otros tipo de interacciones no covalentes 1) Interacciones iónicas: atracción entre grupos con cargas opuestas 2) Interacción ión-dipolo: atracción entre un ión y el polo opuesto de un dipolo 3) Interacción dipolo-dipolo: atracción entre polos opuestos de un dipolo 4) Fuerzas de Van der Waals: Atracción entre dipolos temporarios inducidos por la fluctuación de los electrones 5) Interacciones hidrofóbicas: Tendencia de grupos no polares de unirse en soluciones acuosas Interacciones iónicas Na+ R-COO- Interacción ión-dipolo: Cl+ NH3-R Interacciones hidrofóbicas 2 08/04/2010 Clasificación de los solutos según su solubilidad en agua Unidades de concentración 1) Unidades físicas • compuestos hidrofílicos – Polares (sin carga neta) – Iónicos (cargados) • Compuestos hidrofóbicos • Compuestos anfipáticos a) % m/v = masa (g) de soluto cada 100 mL de solución b) g/l = masa (g) soluto/ Vol (L) solución c) % v/v = vol (soluto) / vol (sol) *100 2) Unidades químicas a) Molaridad (M) = moles de solutos/Vol (L) solución b) Normalidad (N) = equiv. de soluto/ Vol (L) solución c) Osmolaridad = moles de partículas disueltas/ Vol (L) solución Osmolaridad y presión osmótica 3