PREGUNTA (Módulo Electivo) En el año 1924, Louis De Broglie
Anuncio

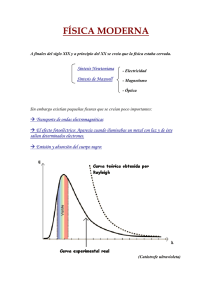
PREGUNTA (Módulo Electivo) En el año 1924, Louis De Broglie postuló que la radiación y las partículas presentan un comportamiento dual. De acuerdo a dicha hipótesis, es correcto afirmar que el electrón I) II) III) A) B) C) D) E) puede perder toda su masa. presenta un movimiento ondulatorio. se mueve a la velocidad de la luz. Solo I Solo II Solo I y II Solo I y III Solo II y III COMENTARIO La hipótesis de Louis De Broglie surge de la idea que se había instalado en aquel tiempo respecto a la naturaleza dual de la radiación electromagnética (luz). Se planteaba que bajo ciertas condiciones experimentales, la luz podía comportarse como una partícula y además poseer características de onda. En la siguiente tabla se muestran algunos antecedentes históricos que convergieron en la hipótesis que De Broglie planteó en su tesis doctoral, en 1924, titulada “Investigaciones sobre la teoría de los cuantos”. Max Planck Albert Einstein Louis De Broglie 1900 Propone que la energía de un cuanto* de radiación electromagnética es proporcional a la frecuencia de la radiación. 1905 Aplicó lo propuesto por Planck, para explicar el efecto fotoeléctrico**. Propuso que la luz tiene propiedades corpusculares, surgiendo así el concepto de fotón. Además, propuso que la energía de un fotón es directamente proporcional a su masa y a la velocidad de la luz. 1923 Tomando las ideas de Planck y de Einstein, se planteó lo siguiente: si en condiciones apropiadas la energía radiante se comporta como onda y como partícula, en condiciones especiales, ¿la materia podría tener el mismo comportamiento dual? Científico Año Aportes de su trabajo * Paquete de energía que se comporta como partícula Ecuación relacionada ** Fenómeno que consiste en la emisión de electrones al hacer incidir luz sobre la superficie de una placa metálica Lo que se resume en la ecuación: Lo que se refleja en la ecuación: E = h × E=m×c 2 Entonces propuso que, en el átomo de hidrógeno, el electrón debería tener, asociado a su trayectoria, un comportamiento de onda. Pudiendo, por lo tanto, asociarse a él una determinada frecuencia y longitud de onda. Combinando y desarrollando las ecuaciones de Planck y de Einstein, se obtiene: = Donde: h constante de Planck frecuencia de la radiación Donde: m masa c velocidad de la luz v Donde: longitud de onda v velocidad p momento Efecto fotoeléctrico Intensidad Cálido Teoría Clásica e le . U. V Longitud de onda de la radiación emitida os Frío z Lu Templado ay or Esquema de su trabajo Planck Metal o ctr ne λ s r p De la hipótesis de De Broglie se concluye que para partículas pequeñas, como el electrón, las longitudes de onda pueden ser medibles. Observándose experimentalmente que cuando un flujo de electrones pasa a través de un cristal, este experimenta difracción. Por lo que, los electrones tienen un comportamiento similar a la radiación electromagnética, es decir ondulatorio. Es importante destacar que los electrones se comportan, en algunas ocasiones como ondas y en otras, como partículas. Tanto fotones como electrones muestran una clara dualidad, aunque no son el mismo tipo de entidad. Los fotones se mueven a la velocidad de la luz (c) y tienen una masa en reposo nula; mientras que los electrones siempre tienen una velocidad (v) menor a la velocidad de la luz (c) y una masa en reposo definida. Respecto de las afirmaciones de la pregunta, relacionadas con el enunciado: “Louis De Broglie postuló que la radiación y las partículas presentan un comportamiento dual”, pode os concluir que: La afirmación I) es incorrecta, pues De Broglie no plantea en su hipótesis que la masa del electrón varía, sino que planteó que en el átomo de hidrógeno, el electrón debería tener, asociado a su trayectoria, un comportamiento de onda. Pudiendo, por lo tanto, asociarse a él una determinada frecuencia y longitud de onda. La afirmación II) es correcta, puesto que, de acuerdo con la hipótesis de Louis De Broglie, el electrón presenta un movimiento ondulatorio. La afirmación III) es incorrecta, ya que la velocidad del electrón es menor a la velocidad de la luz. Por ejemplo, la velocidad del electrón en el átomo de hidrógeno, es del orden de 106 m/s, muy inferior a la velocidad de la luz. Según el análisis anterior, se concluye que la opción correcta es B). FICHA DE REFERENCIA CURRICULAR Eje Temático / Área Temática: Materia y sus transformaciones / Estructura atómica Nivel: I Medio Objetivo Fundamental: Comprender el comportamiento de los electrones en el átomo sobre la base de principios (nociones) del modelo mecano-cuántico. Contenido Mínimo Obligatorio: Descripción básica de la cuantización de la energía, organización y comportamiento de los electrones del átomo, utilizando los cuatro números cuánticos (principal, secundario, magnético y espín). Habilidad Cognitiva: Comprensión Clave: B