Espectroscopía Raman en chorros de gases
Anuncio

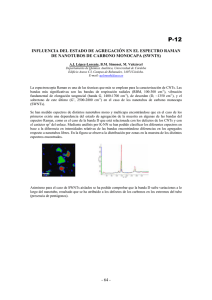
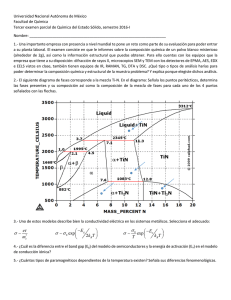
Espectroscopía Raman en chorros de gases José Mª Fernández Laboratorio de Fluidodinámica Molecular Instituto de Estructura de la Materia, CSIC Grupo de Fluidodinámica Molecular Salvador Montero José Mª Fernández Guzmán Tejeda Efecto Raman Scattering inelástico de luz Efecto Raman Scattering a i (Rayleigh) y i+R (Raman) |f> |i> R i f E=0 i incidente Espectroscopía Raman. Propiedades Ventajas Universalidad (todas las especies moleculares dan espectro Raman) Relación lineal entre intensidad espectral y densidad molecular Rango espectral de ~1 a 6000 cm-1 Rango dinámico de intensidades >106 Alta resolución espacial (unas pocas micras) Limitaciones Debilidad intrínseca del efecto Raman Resolución espectral modesta (~0,1 cm-1) Chorros supersónicos. Generalidades M<<1 M>>1 M<1 Chorros supersónicos. Zona de silencio 220 4 1x10 3000 1x10 2800 180 2700 160 2600 2400 2 1x10 2300 2200 n 2100 1x101 2000 v 1900 v (m/s) 2500 Temperature / K 3 n (1022 m-3) 200 2900 2.55 bar 1.28 bar ortho-H2 Rotational 140 para-H2 ortho-H2 para-H2 120 100 1.28 bar 80 2.55 bar 60 Translational 40 1800 0 1x10 100 1000 z (m) 1700 20 1600 0 0 500 1000 z (m) 1500 2000 •Se rompe el equilibrio TD: Ttras ≠Trot ≠ Tvib •El chorro supersónico es un sistema dinámico, condicionado por la cinética de colisiones: congelación Trot Raman spectroscopy in gas jets. Geometry Montaje experimental Turbopump z Rotary Roots y Gate valve Raman signal Laser CCD1 Chamber Spectrometer CCD2 Pr P0 Optical table p-H2 Compressor 1m Ortho-para H 2 Converter n-H2 Montaje experimental Montaje experimental Montaje experimental ¿Qué podemos hacer con espectroscopía Raman en chorros de gases? espectros de moléculas frías espectros de moléculas calientes mapas de temperaturas en chorros de gases mapas de densidades en chorros de gases transferencia de energía en colisiones agregación molecular Espectroscopía Raman a baja temperatura Intensity (cps) 3 2 C2H6, T=295 K P=10 kPa 1 T=23 K 0 1320 1370 1420 1470 1520 Wavenumber (cm-1) 1570 J. M. Fernández and S. Montero, J. Chem. Phys. 118, 2657 (2003) 1620 Espectroscopía Raman de llamas Raman intensity (arbitrary units) a) Observed 3400 H2O a 2000 K llama de CH4/aire b) Calculated 3450 3500 3550 Raman shift (cm-1 ) 3600 Avila et al., J. Mol. Spectrosc. 228, 38 (2004) 3650 3700 Mapa de temperatura rotacional 1.28 CO2 35 0 20 0.96 30 40 0.80 50 0.64 60 0.48 70 80 0.32 90 0.16 100 0.00 110 120 110 120 (c) 30 P0=2 bar 10 1.12 25 20 D=313 m 15 10 5 Experimental r/R e 0 35 (d) 30 25 20 15 10 Calculated 5 0 0 Nozzle 10 20 30 40 50 60 z/Re Maté et al., J. Fluid Mech. 426, 177 (2001) 70 80 90 100 Experimental N2, 313 m nozzle P0= 2 bar, T0=297 K Slit nozzle (0.13x3 mm2) z=300 m dP1 / dt (sec-1) ortho-H2 J=1 3E+5 Rate coefficients for H2:H2 collisions. 10--->30 11--->31 12--->32 13--->33 2E+5 cool 30--->12 33--->13 32--->12 31--->11 30--->10 4E+5 1E+5 spectral analysis of population evolution -6 -4 down -2 0 heat -12 -10 -8 2 4 -1E+5 12--->30 up 6 8 10 12 E hcB 15 3012 collision E/hc = 4B -2E+5 dP0 / dt (sec-1) 4E+5 10 para-H2 J=0 E/hcB 3E+5 2E+5 1E+5 down J=1 up -2 0 2 -1E+5 -2E+5 4 6 8 00--->20 01--->21 02--->22 03--->23 -4 heat -6 30--->12 -12 -10 -8 J=2 5 12--->30 cool 20--->00 23--->03 22--->02 21--->01 J=3 10 12 E hcB 0 J=0 para-H2 ortho-H2 Montero et al., J. Chem. Phys. 125, 124301 (2006) Agregados pequeños de para-H2 4 2 z =1D t =75 ns Ti =12.8 K N=13 876 5 4 3 2 1 5 p-H2 P0=1 bar Tobera: D= 50 m T0=46.5 K Raman intensity 0 4 2 5 0 4 2 0 4 2 Tejeda et al., Phys. Rev. Lett. 92, 223401 (2004) z =3D t =186 ns Ti =3.2 K z =5D t =290 ns Ti =1.7 K 5 z =10D t =546 ns Ti =0.6 K 5 0 4156 4158 4160 Wavenumber (cm-1) 4162 Microchorros de pH2 liquido Kühnel, Fernández, Tejeda, Kalinin, Montero, Grisenti, Phys. Rev. Lett. 106, 245301 (2011) Conclusiones El laboratorio de Fluidodinámica Molecular del IEM ofrece unas posibilidades excelentes de formación en física molecular experimental, con un marcado carácter interdisciplinar, en problemas relevantes de la física molecular actual. Posibles temas de trabajo • estudios colisionales de CO y H2O consigo mismo o con He, H2 o N2 • nucleación y cinética de condensación de H2 • estructura de agregados moleculares pequeños de H2, H2O, O2, CO, etc • dinámica de gases en regímenes críticos o de transición • mapas de T y densidades de llamas, y modelos de combustión