CLASIFICACIÓN DE LA MATERIA Sustancias puras Mezclas
Anuncio
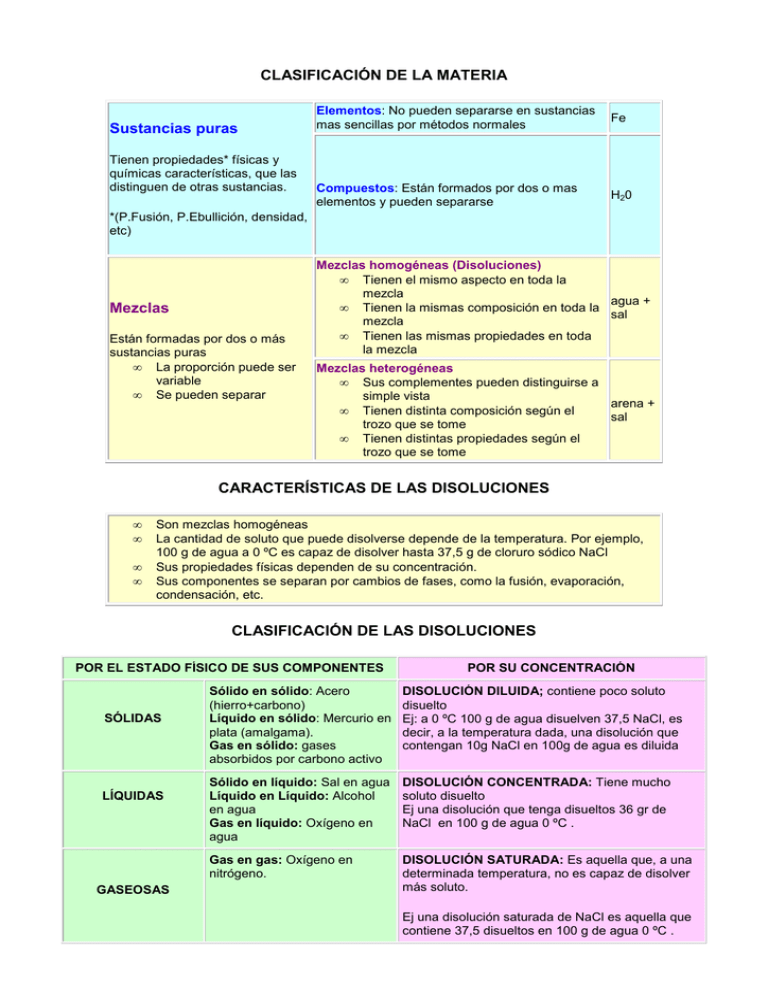
CLASIFICACIÓN DE LA MATERIA Sustancias puras Tienen propiedades* físicas y químicas características, que las distinguen de otras sustancias. Elementos: No pueden separarse en sustancias mas sencillas por métodos normales Fe Compuestos: Están formados por dos o mas elementos y pueden separarse H20 *(P.Fusión, P.Ebullición, densidad, etc) Mezclas Están formadas por dos o más sustancias puras • La proporción puede ser variable • Se pueden separar Mezclas homogéneas (Disoluciones) • Tienen el mismo aspecto en toda la mezcla agua + • Tienen la mismas composición en toda la sal mezcla • Tienen las mismas propiedades en toda la mezcla Mezclas heterogéneas • Sus complementes pueden distinguirse a simple vista arena + • Tienen distinta composición según el sal trozo que se tome • Tienen distintas propiedades según el trozo que se tome CARACTERÍSTICAS DE LAS DISOLUCIONES • • • • Son mezclas homogéneas La cantidad de soluto que puede disolverse depende de la temperatura. Por ejemplo, 100 g de agua a 0 ºC es capaz de disolver hasta 37,5 g de cloruro sódico NaCl Sus propiedades físicas dependen de su concentración. Sus componentes se separan por cambios de fases, como la fusión, evaporación, condensación, etc. CLASIFICACIÓN DE LAS DISOLUCIONES POR EL ESTADO FÍSICO DE SUS COMPONENTES SÓLIDAS LÍQUIDAS GASEOSAS POR SU CONCENTRACIÓN Sólido en sólido: Acero (hierro+carbono) Líquido en sólido: Mercurio en plata (amalgama). Gas en sólido: gases absorbidos por carbono activo DISOLUCIÓN DILUIDA; contiene poco soluto disuelto Ej: a 0 ºC 100 g de agua disuelven 37,5 NaCl, es decir, a la temperatura dada, una disolución que contengan 10g NaCl en 100g de agua es diluida Sólido en líquido: Sal en agua Líquido en Líquido: Alcohol en agua Gas en líquido: Oxígeno en agua DISOLUCIÓN CONCENTRADA: Tiene mucho soluto disuelto Ej una disolución que tenga disueltos 36 gr de NaCl en 100 g de agua 0 ºC . Gas en gas: Oxígeno en nitrógeno. DISOLUCIÓN SATURADA: Es aquella que, a una determinada temperatura, no es capaz de disolver más soluto. Ej una disolución saturada de NaCl es aquella que contiene 37,5 disueltos en 100 g de agua 0 ºC . TÉCNICAS PARA SEPARAR LOS COMPONENTES DE UNA MEZCLA Cuando se utiliza: Ejemplo: Materiales: Filtración Se utiliza para separar un líquido de un sólido que no es soluble agua y arena Embudo Papel de filtro Decantación Se utiliza para separar dos líquidos no miscibles. La separación es por densidad agua y aceite Embudo de decantación Cristalización Se utiliza para separar un agua y sal líquido de un sólido que es soluble. Se deja evaporar el líquido y quedarían los cristales del sólido Cristalizador Destilación Destilador: Matraz, mechero, termómetro y refrigerante Se utiliza para separar dos líquidos que tienen distinto punto de ebullición. agua y alcohol











