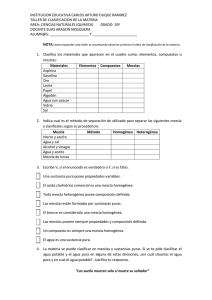
Los niveles de la homogeneidad Cuando clasificamos una
Anuncio

Los niveles de la homogeneidad Cuando clasificamos una mezcla como homogénea o heterogénea podemos hacerlo desde diferentes perspectivas, en diferentes niveles y con diferentes técnicas. Muchas veces el resultado de la clasificación de la mezcla dependerá justamente de la “perspectiva” desde la cual la clasifiquemos. Por lo general no nos es difícil reconocer mezclas típicamente heterogéneas como una mezcla de agua y aceite, la arena, un ladrillo, etc. Sin embargo otros muchos sistemas heterogéneos nos pueden parecer homogéneos a simple vista. Supongamos por ejemplo que queremos saber si el aire constituye una mezcla homogénea o heterogénea. Para ello aislamos una porción de aire y la observamos a simple vista. Seguramente nos parecerá que estamos frente a una mezcla homogénea. Ahora si iluminamos la muestra de aire con una luz intensa y vamos cambiando el ángulo de incidencia de la luz, seguramente llegara un punto en el cual la luz comenzará a reflejarse en las partículas de polvo suspendidas revelando entonces que estamos frente a una mezcla heterogénea: una fase sólida: polvo y una fase gaseosa: mezcla homogénea de gases principalmente, O2, N2, CO2 y H2O. La leche a simple vista nos puede parecer también una mezcla homogénea, sin embargo como vimos es en realidad una mezcla heterogénea en la cual la grasa se encuentra en una fase diferente. Uno de los fluidos más importantes de nuestro cuerpo es la sangre. A simple vista no dudaríamos en clasificar la sangre como un sistema homogéneo, no podríamos diferenciar distintos componentes en distintas fases. Sin embargo simplemente observando en un microscopio vemos que en realidad esa mezcla homogénea no es tal, sino que encontramos una cantidad de elementos que se encuentran “suspendidos” en ella, los glóbulos rojos, los diferentes tipos de glóbulos blancos, las plaquetas, etc. ¿Por qué parece tan difícil en estos casos clasificar las mezclas? Lo que tienen en común estos sistemas es el tamaño de las partículas que constituyen la mezcla. Cuanto más pequeñas son las partículas que constituyen las distintas fases, más ambigua resulta la clasificación de las mezclas, por lo menos sin especificar el instrumental utilizado. Es así que algunos sistemas típicamente heterogéneos nos pueden parecer evidentemente homogéneos. Un ejemplo de la importancia del tamaño de partícula en la clasificación de la mezclas son los coloides o sistemas coloidales. Los sistemas coloidales son mezclas heterogéneas formadas por una fase dispersante continua y una o más fases dispersas. Estos sistemas, a simple vista, parecen soluciones. Sin embargo, difieren de ellas en el tamaño de las partículas de las fases dispersas, el que varía entre 2 y 1000 nm. Son muy pequeñas para ser observadas a simple vista pero dispersan la luz (efecto Tyndall), a diferencia de las soluciones que no lo hacen. No todas las suspensiones (mezcla heterogénea sólido-líquido) o emulsiones (mezcla heterogénea líquido-líquido) constituyen sistemas coloidales. Lo que los diferencia es la estabilidad de las mismas: los sistemas coloidales son más estables y no sedimentan. Algunos ejemplos de sistemas coloidales son: gelatina, leche, sangre, pintura, neblina, shampoo y pegamentos. Efecto Tyndall: la luz que reciben las partículas es desviada de la trayectoria inicial y éstas se hacen visibles.