Práctica 10. Propiedades coligativas. Descenso crioscópico
Anuncio

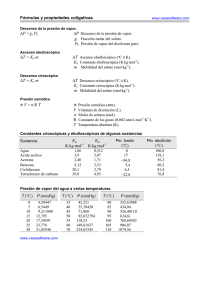
Experimentación Básica en Química. 1º de Química. Grupo 911. INFORME FINAL Curso 2010-2011 Nombre y apellidos: Práctica 10. Propiedades coligativas. Descenso crioscópico 1. Punto de fusión y descenso crioscópico. 1.1.¿Qué es el punto de fusión de una sustancia pura? ¿En qué condiciones se mide? 1.2.¿Qué es el descenso crioscópico? 1.3.¿De qué factores depende el descenso crioscópico? 1.4.¿Qué es la constante crioscópica de un disolvente? ¿Qué unidades tiene? ¿Para qué sirve conocerla? 1.5.¿Qué es una propiedad coligativa? ¿Por qué el descenso crioscópico lo es? ¿Cómo vas a comprobarlo en esta práctica? 1.6.Escribe la expresión que te permite calcular la concentración molal de una disolución a partir de la medida del descenso crioscópico. ¿Qué datos debes medir o conocer? 1.7.Escribe la expresión que te permite calcular el peso molecular de un soluto a partir de medidas del descenso crioscópico que produce cuando se disuelve en un disolvente dado. 2. Rellena la Tabla 1 y presenta las figuras utilizadas para determinar los puntos de fusión del para-dicloro benceno (PDB) puro y de sus dos disoluciones con el soluto problema a la presión del laboratorio. En una figura representa los datos de los experimentos 1, 3 y 5. En una segunda figura, los de los experimentos 2, 4 y 6. 1 Experimentación Básica en Química. 1º de Química. Grupo 911. INFORME FINAL Curso 2010-2011 Tabla 1. Resultados experimentales para la determinación del punto de fusión de para-dicloro benceno (PDB) puro, Tf,PDB, el descenso de su punto de fusión (∆Tf) provocado por un soluto desconocido y el peso molecular del soluto (M). Medidas tomadas a la presión del laboratorio. Constante crioscópica del PDB: kf = 7.10 oC/molal. PDB puro Disolución 1 Disolución 2 Tiempo masa = g masa soluto = g masa soluto = g (min) Exp. 1 Exp. 2 Exp. 3 Exp. 4 Exp. 5 Exp. 6 0.0 0.5 1.0 1.5 2.0 2.5 3.0 3.5 4.0 4.5 5.0 5.5 6.0 6.5 7.0 7.5 8.0 8.5 9.0 9.5 10.0 10.5 11.0 11.5 12.0 12.5 13.0 13.5 14.0 14.5 15.0 15.5 16.0 16.5 17.0 17.5 18.0 18.5 19.0 Obtén los puntos de fusión de las gráficas temperatura – tiempo y tabúlalos abajo. Para cada disolución debes trazar dos rectas: una, que incluya los puntos anteriores al comienzo de la cristalización; otra, que incluya los puntos posteriores. El punto de fusión se lee en la intersección de ambas rectas. Tf (oC) Medias(oC) Descenso crioscópico, ∆Tf (oC) Concentración molal Moles de soluto Peso molecular del soluto (g/mol) 2 Experimentación Básica en Química. 1º de Química. Grupo 911. INFORME FINAL Curso 2010-2011 3. Tabula los siguientes errores de escala, accidentales y totales (no presentes los cálculos) y da el resultado final de peso molecular con su error total, como se indica: a) Error de escala absoluto y relativo de las medidas/datos siguientes. Utiliza las medidas del primer experimento con PDB puro y de la disolución 1. Error de escala Valor Error absoluto Error relativo Constante crioscópica: 7.10 oC/molal ±0.01 oC/molal 0.001 Masa soluto: g ± g Masa disolvente: g ± g o o Descenso crioscópico: C ± C Peso molecular: g/mol ± g/mol b) Error accidental del peso molecular del soluto: Experimento Peso molecular (g/mol) Desviación absoluta (g/mol) 3y4 5y6 Peso molecular promedio = g/mol Error accidental (media de desviaciones absolutas) = ± Peso molecular promedio ± (error de escala+error accidental) = g/mol ± g/mol 4. Teniendo en cuenta lo que has observado en esta práctica, ¿qué es el punto de fusión de una sustancia pura? ¿Cuál es el punto de fusión del para-dicloro benceno (PDB)? ¿permanece constante la temperatura durante la fusión del sólido? 5. Según tus datos, ¿cómo afecta la adición de un soluto al punto de fusión del PDB? Explícalo usando tus resultados (PDB puro, disolución 1 y disolución 2). 6. ¿Qué cantidad de cualquier soluto soluble en PDB deberías utilizar por kg de PDB para hacer descender su punto de fusión 0.36 oC a una persión dada? ¿Crees que debes contestar a esta pregunta calculando la masa de soluto o los moles de soluto por kg de disolvente? Explícalo. 3