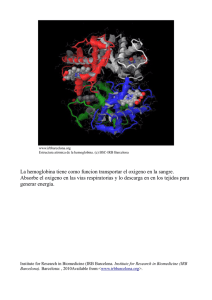
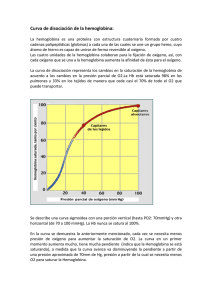
2,3-difosfoglicerato (DPG)
Anuncio

2,3-difosfoglicerato (DPG) El 2,3-difosfoglicerato facilita la liberación de oxigeno a los tejidos. Este ciclo es parte de la vía Embden – Meyerhof y tiene por finalidad evitar la formación de 3 – fosfoglicerato y ATP. El DPG está presente en el eritrocito en una concentración de 1 mol BPG/mol de hemoglobina y se une con fuerza a la desoxihemoglobina, manteniendo a la hemoglobina en estado desoxigenado facilitándose la liberación de oxigeno. El incremento en la concentración de difosfoglicerato facilita la liberación de oxigeno a los tejidos mediante la disminución en la afinidad de la hemoglobina para el oxigeno. De esta manera el eritrocito cuenta con un mecanismo interno para la regulación del aporte de oxigeno a los tejidos. 2,3-DPG (Difosfoglicerato) Se forma a partir del 1,3-DPG (vía glucolítica) y se encuentra en grandes cantidades en el eritrocito. Funciona como efector alostérico para la Hb. La afinidad de la Hb por el O2 está influida por una serie de variables que incluyen: • • • • La concentración de protones (pH) El CO2 La temperatura El 2,3-difosfoglicerato (2,3-DPG) 2,3-DPG (Difosfoglicerato) – Derivación de Rapoport-Luebering En la conformación desoxi de la Hb existe una cavidad lo suficientemente grande como para admitir la 2,3-DPG entre las cadenas β. El 2,3-DPG estabiliza la forma T (la forma tensa de la hemoglobina que tiene menor afinidad por el oxígeno) al formar enlaces cruzados con las cadenas β. Una concentración creciente de ión hidrógeno y de 2,3DPG favorece la conversión de la forma Hb R (forma relajada de la hemoglobina que tiene más afinidad por el oxígeno) a la forma Hb T y por tanto disminuye la cantidad de oxígeno que se une a la Hb en cualquier concentración de oxígeno. Inversamente, cuando 2,3-BPG no está disponible, o no se une en la cavidad central, la Hb puede convertirse más fácilmente a HbO2. Las moléculas de la hemoglobina que se diferencian en la composición de sus subunidades tienen diferentes propiedades de unión al 2,3-BPG con diferentes respuestas alostéricas a 2,3-BPG. Por ejemplo, HbF (la forma fetal de hemoglobina) se une al 2,3-BPG con menor avidez que la HbA (la forma del adulto de hemoglobina) con el resultado que HbF en los fetos de mujeres embarazadas se une al oxígeno con mayor afinidad que a la HbA de las madre, dando así al feto el acceso preferencial al oxígeno llevado por el sistema circulatorio de las madres. Las variaciones de concentración del 2,3-DPG desempeñan un papel fundamental en la adaptación a al hipoxia, de manera que en la hipoxemia aumenta este compuesto y la afinidad por el oxígeno declina y el aporte a los tejidos se facilita. VÍA DE SÍNTESIS DEL 2,3-DPG La 3-fosfoglicerato estimula la bifosfoglicerato mutasa y en consecuencia, incrementa la producción de la 2,3-DPF. Éste es un potente inhibidor de su propia formación. ↑2,3- DPG ↑Temperatura ↓ pH