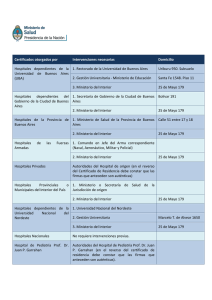
Ciudad Autónoma de Buenos Aires, de Diciembre de 2010
Anuncio

Ciudad Autónoma de Buenos Aires, 21 de mayo de 2010.- VISTO: La actuación nº 727/07, iniciada de oficio por esta Defensoría del Pueblo a fin de investigar presuntas irregularidades relacionadas con las circunstancias en que se conducen y ejecutan estudios farmacoclínicos o de tecnología médica, con patrocinio de empresas privadas en el ámbito de los centros y hospitales de salud dependientes del Ministerio de Salud del Gobierno de la Ciudad Autónoma de Buenos Aires. Y CONSIDERANDO QUE: Se inicia la actuación de oficio, toda vez que se ha tramitado una actuación anterior en la que han quedado acreditados “prima facie” distintos procedimientos irregulares en la conducción y ejecución de estudios clínicos en un hospital de la Ciudad, los que podrían comprometer la responsabilidad de agentes y funcionarios hospitalarios. Se envía oficio al Ministro de Salud del Gobierno de la Ciudad Autónoma de Buenos Aires, a fin de solicitarle se amplíe información relacionada con las condiciones y formas contractuales de las empresas patrocinadoras para realizar estudios farmacoclínicos o de tecnología médica en ámbitos hospitalarios públicos, solicitando el nivel de intervención de la Dirección del hospital o del Ministerio de Salud del Gobierno de la Ciudad Autónoma de Buenos Aires. Asimismo, se solicita información vinculada con los mecanismos de reembolso y/o abono de los insumos hospitalarios y del eventual pago del trabajo de los recursos humanos de agentes dependientes de los hospitales vinculados al desarrollo de los estudios mencionados. En el mismo oficio se solicita información acerca del acceso a documentos fuente, datos sensibles y personales de pacientes atendidos en el ámbito hospitalario; en caso afirmativo, establecer si existen pólizas de seguros de riesgo y cuáles son los beneficios concretos que dichos estudios deparan para el hospital, como así también, para los pacientes que resultan reclutados en los mismos. 1 A fs. 12/13 luce agregada la respuesta del Consejo de Investigación en Salud, mediante la cual se detalla la normativa aplicable en el ámbito de la Ciudad Autónoma de Buenos Aires que regula la realización de Protocolos de Investigación en los hospitales del Gobierno de la Ciudad Autónoma de Buenos Aires: Resolución nº 1914-SS-03, modificatoria de la Resolución nº 1125-SS03 “Registro y Procedimientos aplicables a los proyectos y trabajos de investigación que se efectúan en los hospitales dependientes de la Secretaría de Salud del Gobierno de la Ciudad de Buenos Aires”. La Resolución nº 1914-SS-03 se aplica a todos los profesionales en relación de dependencia con el Gobierno de la Ciudad Autónoma de Buenos Aires que efectúen trabajos en jurisdicción del mismo y a aquellos profesionales sin relación de dependencia con el Gobierno de la Ciudad Autónoma de Buenos Aires que por autorización especial o convenios realicen trabajos dentro de la jurisdicción del mismo, según normas vigentes. El Consejo de Investigación en Salud informa que dentro del Consejo no se dispone de reglamentación respecto a la vinculación contractual entre las Instituciones, laboratorios y el Gobierno de la Ciudad Autónoma de Buenos Aires. Según lo informado por el Consejo, éste cumple funciones de toma de conocimiento y registro de los proyectos y trabajos de investigación, conforme lo establecido por la Resolución nº 1914-SS-03, y agrega que “...El Comité de Docencia e Investigación y el Comité de Etica hospitalarios y el Director del Hospital son los encargados de aprobar los proyectos de investigación y están facultados para monitorear la ejecución del estudio...”. La Dirección de Asistencia Jurídica de ese Ministerio de Salud manifestó a fs. 14 que: “...Desde el punto de vista jurídico sanitario, este Nivel entiende que a los efectos de la finalización de dicho circuito administrativo correspondería a este Ministerio con el dictado del acto administrativo correspondiente, en atención a las competencias que le son propias de conformidad con las disposiciones de la Ley 1925 (B.O. 2407) y Decreto Nº 350/GCBA/06...”. En ese mismo sentido, expresa: “...y siendo el Ministerio de Salud, el órgano de Gobierno que detenta la potestad decisoria en todo lo relacionado con las prestaciones que se brindan en los efectores dependientes del Ministerio en virtud de las garantías que dimanan de la Ley Básica de Salud (Ley 153), se entiende que el procedimiento establecido por la citada norma resulta incompleto; entendiéndose asimismo, la importancia de modificar la Resolución Nº 1914-SS-03 (B.O. 1799) en el sentido de que los Protocolos de Investigación sean registrados por la Máxima Autoridad del Ministerio y comunicados al ANMAT como cierre del proceso previsto en el punto 9 Anexo 1...” (lo subrayado es propio). 2 El Pacto Internacional de Derechos Económicos, Sociales y Culturales reconoce el derecho de las personas al disfrute del más alto nivel posible de salud física y mental, siendo compatible la promoción y desarrollo de la investigación clínica tanto con el Derecho Internacional de los Derechos Humanos como en la Constitución local. La Disposición nº 5330/1997 de la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT), establece que los costos provenientes del ensayo de investigación en Farmacología Clínica, deberán ser soportados por el patrocinador si lo hubiere, o por el grupo investigador. El acceso a los acuerdos financieros está garantizado según la Declaración de Helsinki y la Ley Básica de Salud, asegurando el acceso de la población a toda la información vinculada a la salud colectiva y a su salud individual. La Ley Básica de Salud ha establecido que los convenios de investigación con instituciones públicas o privadas deberán asegurar al subsector estatal una participación en los resultados científicos y económicos. La Resolución nº 1914/SS/2003 de la entonces Secretaría de Salud, modificatoria de la Resolución nº 1125/SS/2003, establece que todo trabajo científico que se efectúe en los organismos sanitarios de la entonces Secretaría de Salud del Gobierno de la Ciudad Autónoma de Buenos Aires, deberá encuadrarse dentro de la metodología que se establece en dicha normativa. La Resolución nº 1125/2003/SS indica que en el ámbito de los hospitales dependientes de la entonces Secretaría de Salud del Gobierno de la Ciudad Autónoma de Buenos Aires se llevan a cabo gran cantidad de trabajos epidemiológicos y de investigación clínica, por lo que corresponde actualizar los procedimientos que los rigen. La Declaración de Helsinki sólo justifica la investigación en la medida en que existan posibilidades razonables de que la población, sobre la que la investigación se realiza, pueda beneficiarse de sus resultados. El Documento de las Américas establece que los aspectos financieros del estudio deberán documentarse en un acuerdo entre el patrocinador y el investigador/institución y que dicho acuerdo debe incluir la evidencia de aceptación/compromiso de la institución/administración hospitalaria para la provisión de las instalaciones y servicios y de los pagos propuestos por el patrocinador. POR TODO ELLO: 3 LA DEFENSORIA DEL PUEBLO DE LA CIUDAD AUTONOMA DE BUENOS AIRES RESUELVE: 1) Solicitar al Jefe de Gabinete de Ministros del Gobierno de la Ciudad Autónoma de Buenos Aires, licenciado Horacio Antonio Rodríguez Larreta, arbitre las medidas tendientes a reglamentar la Ley 3301 a fin de controlar las condiciones y formas en las que se llevan a cabo las investigaciones clínicas en hospitales dependientes del Ministerio de Salud del Gobierno de la Ciudad Autónoma de Buenos Aires, como así también, los acuerdos financieros de los estudios clínicos que se desarrollan en dichos nosocomios y el manejo de los recursos. 2) Poner en conocimiento de la presente Resolución al Ministro de Salud del Gobierno de la Ciudad Autónoma de Buenos Aires, doctor Jorge Daniel Lemus, y al Presidente de la Comisión de Salud de la Legislatura de la Ciudad Autónoma de Buenos Aires, doctor Jorge Guillermo Selser. 3) Registrar, reservar en el Area para su seguimiento y oportunamente, archivar. Código 441 ab./SAL/Nic. gv./D/LDS RESOLUCION Nº 1452/10 4