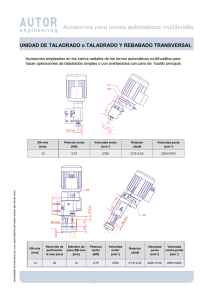
pertensivo y recobró de forma gradual y completa la visión en 48
Anuncio

Documento descargado de http://www.elsevier.es el 18/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. CARTAS AL DIRECTOR pertensivo y recobró de forma gradual y completa la visión en 48 horas por lo que fue dada de alta. Reevaluada posteriormente en la consulta de neurología la paciente continuaba asintomática. En la RM de control al mes del episodio se apreciaba la desaparición de la hemorragia subaracnoidea así como el realce meníngeo, persistiendo la lesión subdural en la fosa craneal media izquierda, que fue considerada previa al episodio. En la bibliografía existen pocos casos documentados de desarrollo de ceguera cortical bilateral reversible tras una punción dural accidental en el contexto de un embarazo y parto normal. La mayoría de los casos de alteraciones neurológicas y ceguera en el embarazo publicados están asociados a estados hipertensivos, apareciendo los transtornos visuales entre el 25-50% de las pacientes con preeclampsia y la ceguera aproximadamente en el 1-15%7,8 pero en este caso no se objetivó en ningún momento del embarazo, ni hipertensión, ni edemas, ni proteinuria, por lo que se dudó de este diagnóstico. La leucoencefalopatía posterior reversible planteada como posible diagnóstico en la prueba de imagen, es una alteración poco frecuente, comúnmente asociada a hipertensión y eclampsia, insuficiencia renal, colagenosis, púrpura, porfiria y a terapia inmunosupresora. Es excepcional que curse sin alteraciones del nivel de conciencia ni convulsiones9. El sustrato anatómico en ese caso, parece ser un edema córtico-subcortical occipital que afecta al centro de la visión por edema vasogénico al perderse la autorregulación cerebral ante el aumento de la presión arterial10. Otras causas a tener en cuenta de cefalea asociada a ceguera cortical incluyen la migraña (el aura precede a la cefalea y su duración es más corta), infarto cerebral, disección de arteria cerebral, trombosis venosa cerebral o esclerosis múltiple. Estas últimas suelen ir asociadas a lesiones en las pruebas de imagen. No se puede descartar como causa de la ceguera en este caso, dados los antecedentes, un trastorno conversivo con déficit sensorial, aunque la presencia de alteraciones en las pruebas de imagen lo hacen menos probable. En el caso planteado nos inclinamos a pensar que la causa de la ceguera cortical, fue desencadenada por la hipotensión de LCR secundaria a la punción dural. Al provocarse la misma durante el periodo expulsivo la pérdida de LCR pudo ser más importante de lo habitual. La baja presión de LCR ocasionaría una pérdida de la suspensión hidráulica del encéfalo, con lo que se pueden producir pequeños desplazamientos que ocasionan distensión de estructuras dolorosas en la dura, el seno sagital, los nervios craneales y las arterias de la base del cráneo que provoca frecuentemente cefalea6. Esta hipotensión intracraneal podría ser también responsable de la tracción mecánica sobre alguna de dichas estructuras craneales lo que provocaría pequeñas hemorragias subaracnoideas, como las observadas en el caso expuesto, que en determinadas áreas podrían ser responsables de la ceguera cortical10. H. Muñoz, M. López-Tafall, I. F. Blanco, E. Barez Servicio de Anestesiología y Reanimación. Hospital Txagorritxu. Vitoria-Gasteiz. 63 BIBLIOGRAFÍA 1. Lybecker H, Djernes M, Schmidt FJ. Postdural puncture headache (PDPH): onset, duration, severity, and associated symptoms. An analysis of 75 consecutive patients with PDPH. Acta Anaesthesiol Scand. 1995;39(5):605-12. 2. Stamer U, Grond S, Hajo S, Wulf H. Surveys on the use of regional anaesthesia in obstetrics. Curr Opin Anaesthesiol. 1999;12(5):565-71. 3. Viale M, Narchi P, Veyrac P, Benhamou D. Chronic tinnitus and hearing loss caused by cerebrospinal fluid leak treated with success with peridural blood patch. Apropos of 2 cases. Ann Otolaryngol Chir Cervicofac. 1996;113(3):175-7. 4. Chordas C. Post-Dural Puncture Headache and other complications after lumbar puncture. J Pediatr Oncol Nurs. 2001;18(6):244-59. 5. Rice I, Mountfield J, Radhakrishnan D, Nelson-Piercy C. Puerperal seizures associated with post dural puncture headache. Int J Obstet Anesth. 2003;12(2):126-9. 6. Valldeperas MI, Aguilar JL. Cefalea post-punción dural en obstetricia: ¿Es realmente una complicación“benigna”?¿Cómo podemos prevenirla y tratarla eficazmente? Rev Esp Anesetesol Reanim. 2006;53(10): 615-7. 7. Lara Torre E, Lee M, Wolf M, Dinesh M. Bilateral retinal occlusion progressing to long-lasting blindness in severe preecalmpsia. Obstet Gynecol. 2002;100(5 Pt 1):940-2. 8. Arteche Andrés MA, Ortiz-Gómez JR, Martín Manso AM, Plaja Martí I, Hernández García S, Sos Ortigosa F. Eclampsia y amaurosis total bilateral en una paciente con diagnostico a posteriori de leucoencefalopatía posterior reversible. Rev Esp Anestesiol Reanim. 2008; 55(5):304-7. 9. Torrillo TM, Bronster DJ, Beilin Y. Delayed diagnosis of posterior reversible encephalopaty syndrome (PRES) in a parturient with preeclampsia after inadvertenet dural puncture. Int J Obstet Anaesth. 2007;16(2):171-4. 10. Schwatrz RB, Mulkern RV, Gudbjartsson H, Jolesz F. Difusion-weighted MR imaging in hypertensive encephalopaty: clues to phatogenesis. Am J Neuroradiol. 1998;19(5):859-62. NEUMOTÓRAX A TENSIÓN COMO COMPLICACIÓN DE LA CIRUGÍA LAPAROSCÓPICA Sr. Director: La enfermedad por reflujo gastroesofágico (ERGE) es un problema frecuente en nuestra sociedad, con un porcentaje de complicaciones evolutivas graves del 10–20%1, siendo la más temida su malignización (esófago de Barret, adenocarcinoma). El tratamiento médico consiste en la administración de fármacos inhibidores de la bomba de protones, antihistamínicos del tipo antagonistas del receptor H2 y procinéticos. A pesar de ello, en muchos casos las medidas higiénico-farmacológicas no son suficientes y se debe recurrir al tratamiento quirúrgico antirreflujo, que restablece la función gastroesofágica de una forma anatómica y funcional, siendo el procedimiento habitual la funduplicatura en sus diversas variantes2,3. La laparoscopia constituye la técnica quirúrgica de elección para el tratamiento de la ERGE. Descrita en los años noventa1, asocia un menor porcentaje de aparición de íleo paralítico, un menor dolor postoperatorio y una menor estancia hospitalaria3,4, en comparación a la cirugía convencional abierta. No obstante, puede asociar complicaciones que pueden llegar a comprometer la vida del paciente, como sucedió en el caso clínico que a continuación presentamos. Paciente mujer de 71 años de edad y 62 Kg de peso, con antecedentes patológicos de ERGE, asma bronquial de larga 123 Documento descargado de http://www.elsevier.es el 18/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. CARTAS AL DIRECTOR evolución (en tratamiento con salbutamol a demanda), hipertensión pulmonar leve, osteoporosis generalizada y un síndrome anémico tratado con hierro oral. Se programó una funduplicatura de Nissen vía laparoscópica para corrección de una hernia de hiato paraesofágica volvulada hacia el tórax. En la analítica preoperatoria destacaba una alcalosis metabólica hipoclorémica secundaria a vómitos y una hemoglobina de 17,5 g dl-1, que confirmaba los signos de deshidratación. En la endoscopia digestiva alta se encontró abundante material de retención con importante esofagitis grado III. La tomografía computerizada tóraco-abdominal mostraba una gran hernia de hiato paraesofágica con ascenso del cuerpo y el antro gástrico. Se atribuyó un riesgo anestésico de grado II, según la clasificación de la American Society of Anesthesiologists (ASA II). A su llegada a quirófano se monitorizó tensión arterial no invasiva (TA), electrocardiograma (ECG), pulsioximetría (SpO2). Se realizó inducción anestésica de secuencia rápida con maniobra de Sellick procediéndose a la intubación orotraqueal sin incidencias. Posteriormente se monitorizó la capnografía (ETCO2) y la presión venosa central (PVC) mediante cateterización de la vena yugular interna derecha sin incidencias. A los 30 minutos de iniciado el neumoperitoneo, presentó de forma rápidamente progresiva una desaturación de hasta el 87% de la SpO2 y ascenso progresivo de valores de ETCO2, incrementándose desde los 30 mmHg iniciales hasta 42 mmHg sin haber modificado los parámetros ventilatorios del paciente. La disminución del valor de la pulsioximetría no se acompañó de cambios en las presiones de vía aérea (Paw < 30 cmH2O siendo la Paw inicial de 23 mmHg), ni en la morfología del ECG y tampoco de la frecuencia cardiaca. Se aumentó la fracción inspiratoria de oxígeno hasta el 100% sin obtener mejoría. La auscultación pulmonar reveló una hipofonesis derecha generalizada y mediante fibrobroncoscopia se comprobó la correcta colocación del tubo endotraqueal. Seguidamente, apareció hipotensión arterial rápidamente progresiva hasta una tensión arterial sistólica (TAS) de 50 mmHg, con pobre respuesta a la administración de fármacos vasopresores y con empeoramiento de la SpO2 hasta el 80%, acompañado de incremento de la frecuencia cardiaca desde 60 latidos min-1 (lpm) iniciales hasta 90 lpm. Se mantuvo PEEP de 6 cmH2O desde el inicio de la intervención. Los fármacos vasopresores administrados fueron efedrina (bolus puntual de 10 mg endovenoso) y posteriomente fenilefrina (dosis total 300 mg endovenoso). Con la sospecha clínica de neumotórax derecho, pese a no existir aumento de la Paw; se detuvo el neumoperitoneo, sin obtener mejoría clínica. Se decidió entonces, colocar un drenaje torácico externo (catéter torácico recto 22G en línea media axilar a nivel del octavo espacio intercostal), resolviéndose la situación de inmediato y confirmando la sospecha diagnóstica de neumotórax a tensión al evidenciar la salida de aire a través del drenaje torácico. La duración del incidente fue de 5 minutos aproximadamente. Debido a dificultades técnicas no pudo realizarse la radiografía de tórax inmediatamente en quirófano, y dada la buena evolución de la paciente, se decidió posponerla hasta la llegada a la unidad de reanimación. Ante la complicación intraoperatoria se decidió revertir la técnica 124 laparoscópica a cirugía abierta. El resto de la intervención, la paciente se mantuvo hemodinámicamente estable sin necesidad de fármacos vasoactivos, pudiendo ser extubada al final de la cirugía sin incidencias. Se trasladó a la unidad de reanimación postquirúrgica, y de manera inmediata se realizó radiografía de tórax de control que mostraba reexpansión del parenquima pulmonar y la correcta colocación del drenaje torácico, siendo dada de alta a las 24 horas sin complicaciones. El drenaje torácico fue retirado a las 48 horas en unidad de hospitalización del servicio de cirugía general. La causa más frecuente de neumotórax como complicación de la técnica laparoscópica es el defecto congénito a nivel del diafragma o un desgarro producido durante el acto quirúrgico, favoreciendo el paso de CO2 hacia la cavidad pleural6. Generalmente, la retirada del neumoperitoneo se acompaña de la resolución del neumotórax5, en nuestro caso no fue así, por lo que pensamos que se creó un mecanismo valvular a nivel pleural que impidió la salida del gas de la cavidad pleural. Esto explicaría la resolución de la inestabilidad hemodinámica y la insuficiencia respiratoria con la colocación de un tubo de drenaje torácico. Se estima que la incidencia de esta complicación oscila entre el 1,6–2%3. Otras complicaciones derivadas de la técnica laparoscópica son: la hemorragia, la embolia aérea, el neumomediastino, el enfisema subcutáneo y la perforación gástrica o esofágica. La hemorragia suele ser secundaria a la lesión esplénica, de vasos adyacentes como la vena cava inferior o la vena hepática izquierda. La embolia aérea presenta una incidencia del 0,75-0,9%7 y se produce por la inyección intravascular de gas a través de la aguja de Verres, que cursaría con un descenso súbito del CO2 espirado. El enfisema subcutáneo tiene una incidencia alta, llegando al 6%, pero no produce repercusiones graves sobre el paciente. Finalmente, la perforación de vísceras tiene una incidencia muy variable (0,2-2,5%)8. Como conclusión, recordar que la amplia utilización de las técnicas laparoscópicas en los programas quirúrgicos en la actualidad nos obliga a realizar un diagnóstico diferencial rápido y exhaustivo y un tratamiento precoz ante una alteración ventilatoria de aparición brusca y deterioro hemodinámico. I. Lavado Flores, R. Arroyo Pérez, L. G. Aguilera Cuchillo, L. Trillo Urrutia Servicio de Anestesiología, Reanimación y Terapia del Dolor. Hospital del Mar-Esperança. IMAS. Barcelona. BIBLIOGRAFÍA 1. Ochando Cerdán F. La cirugía laparoscópica en el tratamiento de la ERGE: Indicaciones y perspectivas en el nuevo milenio. An Med Interna. 2001;18(10):537-42. 2. Dallemagne B, Weers JM, Jehaes C, Markiewicz S, Lombard R. Laparoscopic Nissen Fundoplication: preliminary report. Surg Laparosc Endosc. 1991;1(3):138-43 3. Alcázar MT, Koo M, Ramiro O, Villalonga R, Sabaté A, Montero A. Un hemotórax como complicación de la técnica laparoscópica. Rev Esp Anestesiol Reanim. 2003;50(3):150-3. 4. Albarracín A, Candel MF, Parra P, Ródenas J, Prado R, Martínez de Haro LF, et al. Funduplicatura de Nissen por laparoscopia como técnica de elección para el tratamiento de la enfermedad por reflujo gastroesofágico. Cir Esp. 2001;70:191-4. 64 Documento descargado de http://www.elsevier.es el 18/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. CARTAS AL DIRECTOR 5. Collet D, Cadière GB. Conversions and complications of laparoscopic treatment of gastroesophageal reflux disease. Am J Surg. 1995;169(6): 622-6. 6. Mangar D, Kirchoff GT, Leal JJ, Laborde R, Fu E. Pneumothorax during laparoscopic Nissen fundoplication. Can J Anaesth. 1994;41(9): 854-6. 7. Hughes SG, Chekan Eg, Ali A, Reintgen KL, Eubanks WS. Unusual complications following laparoscopic Nissen fundoplication. Surg Laparosc Endosc Percutan Tech. 1999;9(2):143-7. 8. Boggi U, Bellini R, Pietrabissa A, Mosca F. Laparoscopic Nissen Fundoplication complicated by late gastroesophageal herniation and intrathoracic perforation: a case report with review of the literatura. Surg laparosc Endosc. 1999;9(1):57-9. 9. Sato Y, Miwa T, Hiroki K. Tension pneumothorax during laparoscopic Nissen fundoplication in a child. J Clin Anesth. 2007;19(2):162-3. 10. Wahba RW, Tessler MJ, Kleiman SJ. Acute ventilatory complications during laparoscopic upper abdominal surgery. Can J Anaesth. 1996; 43(1):77-83. SEDO-ANALGESIA PARA ANESTESIA TÓPICA OCULAR EN EL SÍNDROME DE HOLT-ORAM Sr. Director: El síndrome de Holt-Oram1 conocido también como displasia atrio-digital es una anomalía autosómica dominante rara (prevalencia de 1:100.000 nacimientos) que se caracteriza por presentar principalmente malformaciones en las extremidades superiores y corazón. Las malformaciones en miembros superiores más frecuentes son la hipoplasia de dedos, clinodactilia, braquidactilia, sindactilia, hipoplasia o agenesia de radio, húmero o ambos. La malformación cardiaca más habitual es la comunicación interauricular, aunque están descritas en la literatura otras alteraciones y arritmias diversas. Manifestaciones menos frecuentes serían costillas cervicales y anomalías vertebrales, hipoplasia de la clavícula y el pectoral mayor, pecho excavado o hipoplasia de arterias periféricas. Los anestesiólogos podemos encontrar distintos problemas en estos pacientes que pueden ir desde la dificultad para la canalización venosa, la intubación orotraqueal y ventilación, hasta la inestabilidad hemodinámica y aparición de arritmias severas2. Presentamos el caso de un varón de 1 año y 8 meses diagnosticado de síndrome de Holt-Oram. Mostraba aplasia radial izquierda, mano zamba, ausencia de pulgar, disrafia cervical posterior y había sido intervenido de Truncus Arterioso, quedando como secuela tras la reparación quirúrgica, regurgitación a nivel aórtico, mitral y tricuspídeo de carácter leve y una fracción de eyección aceptable. El paciente acudió al hospital por presentar una herida incisa con desgarro conjuntival en el ojo derecho, por lo que el servicio de oftalmología solicitó nuestra colaboración para la sutura de dicha lesión. Se premedicó con una dosis de midazolam intranasal (0,3 mg kg-1) y pasados 5 minutos, se procedió a la monitorización mediante electrocardiograma, pulsioximetría y presión arterial no invasiva, aportándole un flujo de oxígeno 3 l min-1 mediante gafas nasales. Se le administró atropina (0,1 mg kg-1), iniciándose una perfusión de remifentanilo a 0,05 µg kg-1 min-1 junto a la aplicación de anestésico local (lidocaína 2%) en campo quirúrgico. Se esperó 5 minutos para el 65 comienzo de la cirugía manteniéndose la perfusión de remifentanilo a la dosis inicial en todo momento, con lo que se obtuvo una condición idónea para la reparación de la herida. Durante todo el proceso el paciente presentó estabilidad hemodinámica y una adecuada mecánica ventilatoria. La morbimortalidad en anestesia pediátrica varía en relación con ciertos factores, como son la edad, la patología quirúrgica subyacente y la presencia de enfermedades coexistentes. En la población pediátrica, se ha podido demostrar con amplias series de pacientes que el empleo de la sedación está asociado a una baja incidencia de complicaciones, que consisten en pequeños periodos de desaturación arterial, controlables fácilmente con la administración de oxigenoterapia y sin episodios de parada cardiorrespiratoria o aspiración pulmonar3. El midazolam es una benzodiacepina ampliamente utilizada en pediatría y que nos permite titular su dosis en función al efecto deseado (ansiolisis-sedación-hipnosis). Entre las principales ventajas del remifentanilo destaca el adecuado control que ejerce sobre la respuesta hemodinámica, que se relaciona con una mínima respuesta catecolamínica al estrés quirúrgico4. Con dosis de 0,05-0,1 µg kg-1 min-1 se obtiene un adecuado efecto analgésico con mantenimiento de la ventilación espontánea5-7. Para sedo-analgesia en combinación con anestesia locorregional, los estudios multicéntricos aconsejan comenzar con 0,1 mg kg-1 min-1 hasta la realización de la técnica y después disminuir a 0,05 µg kg-1 min-1 tras la realización del bloqueo8,9. Por otro lado, la asociación de remifentanilo y midazolam que se pueden repetir en momentos puntuales, previsibles de estímulo doloroso en los que se necesite mayor sedación, ha demostrado ser muy eficaz y permite una reducción en la dosis de remifentanilo al 50%10. El hecho de que no existan casos infantiles del síndrome Holt-Oram publicados en relación a la anestesia, a pesar de que dichos pacientes son sometidos frecuentemente a la reparación quirúrgica de la cardiopatía congénita asociada, ha sido el motivo por el que hayamos decidido comunicar la sedación realizada en este paciente. En nuestro caso se trató de una situación en la que la anestesia tópica facilitó que se pudiera proceder a la cirugía con una dosis de remifentanilo que no superó en ningún momento los 0,05 µg kg-1 min-1. A. Soriano*, J. Salmerón**, A. Quirantes**, I. Navarro** *Hospital Valle del Nalón. Langrego. Asturias. **Complejo Hospitalario Torrecárdenas. Almería. BIBLIOGRAFÍA 1. Holt M, Oram S. Familial heart disease with skeletal malformations. Br Heart J. 1960;22:236-42. 2. Hernández-Gancedo C, Pestaña D, Burgueño MD, de La Quintana B, Criado A. Anestesia en un caso del Síndrome de Holt-Oram. Rev Esp Anestesiol Reanim. 2001;48(9):434-7. 3. Committee on Drugs, American Academy of Pediatrics. Guidelines for monitoring and management of pediatrics patients during and after sedation for diagnostics and therapeutic procedures. Pediatrics. 1992; 89:1110-5. 4. Howie MB, Kelly WB. Catecholamine response during CABG with remifentanil anesthesia. Anesth Analg. 1996;23:543-7. 5. Reyle-Hahn M, Niggemann B, Max M, Streich R, Rossaint R. Remifentanil and propofol for sedation in children and young adolescents 125