ln G x RT
Anuncio
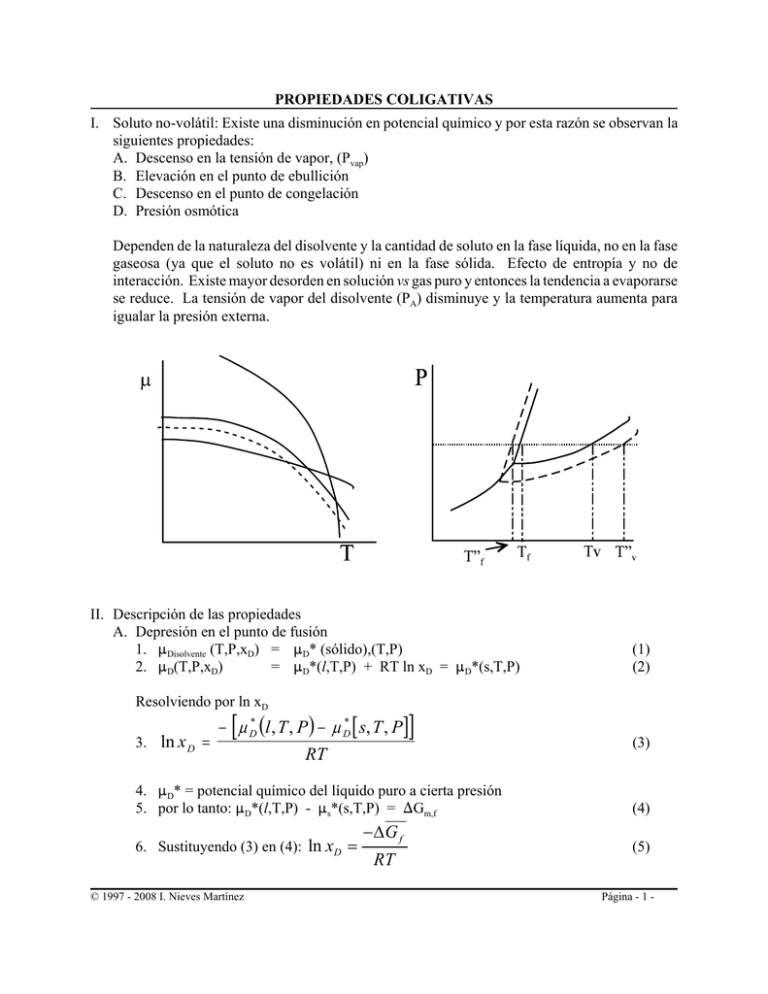
PROPIEDADES COLIGATIVAS I. Soluto no-volátil: Existe una disminución en potencial químico y por esta razón se observan la siguientes propiedades: A. Descenso en la tensión de vapor, (Pvap) B. Elevación en el punto de ebullición C. Descenso en el punto de congelación D. Presión osmótica Dependen de la naturaleza del disolvente y la cantidad de soluto en la fase líquida, no en la fase gaseosa (ya que el soluto no es volátil) ni en la fase sólida. Efecto de entropía y no de interacción. Existe mayor desorden en solución vs gas puro y entonces la tendencia a evaporarse se reduce. La tensión de vapor del disolvente (PA) disminuye y la temperatura aumenta para igualar la presión externa. II. Descripción de las propiedades A. Depresión en el punto de fusión 1. :Disolvente (T,P,xD) = :D* (sólido),(T,P) = :D*(l,T,P) + RT ln xD = :D*(s,T,P) 2. :D(T,P,xD) Resolviendo por ln xD 3. ln x D = [ ] − µ D* (l , T , P) − µ D* [ s, T , P] RT 4. :D* = potencial químico del líquido puro a cierta presión 5. por lo tanto: :D*(l,T,P) - :s*(s,T,P) = )Gm,f 6. Sustituyendo (3) en (4): ln xD = © 1997 - 2008 I. Nieves Martínez −∆G f RT (1) (2) (3) (4) (5) Página - 1 - PROPIEDADES COLIGATIVAS 7. Variación de Tf con concentración: (diferenciado (5) y regla de cadena: ⎛ ∂ ⎡ ∆G f ⎛ ∂ ln xD ⎞ ⎜ ⎣ RT = − ⎜ ⎟ ⎜ ∂xD ⎝ ∂xD ⎠ P ⎝ pero: ⎤⎞ ∂ ⎡ ∆G f ⎦⎟ = 1 ⎣ T ⎟ R ∂T ⎠P ⎤⎛ ⎦ ∂T ⎞ ⎜ ⎟ ⎝ ∂xD ⎠ P ∂ ⎡ ∆ TG f ⎤ ⎣ ⎦ = − ∆H f ∂T T2 (6) (7) 8. Sustituyendo (7) en (6) y resolviendo el lado izquierdo de (6) ⎛ ∆ H f ⎞ ⎛ ∂T ⎞ ⎛ 1 ⎞ ⎜ ⎟ = +⎜ ⎟ 2 ⎟⎜ ⎝ xD ⎠ ⎝ RT ⎠ ⎝ ∂xD ⎠ P 9. Separando variables e integrando: ⎛ dxD ∫1 ⎜⎝ xD xD T ⎛ ∆H f ⎞ ⎞ = + ⎜ ⎟ ∫T ⎝ RT 2 ⎟⎠ dT ⎠ 0 (9) ⎛ ∆H f ⎞ ⎛ 1 1 ⎞ ln xD = ⎜ ⎟⎜ − + ⎟ R ⎝ ⎠ ⎝ T T0 ⎠ 10. Soluciones diluidas (1000g disolvente): ⎛ nD xD = ⎜ ⎝ nD + ns ⎞ ⎞ ⎛ 1000 M ⎟ = ⎜ 1000 ⎟ ⎠ ⎝ M +m⎠ dividiendo (11) por (8) (10) (11) 1000 M 1000 M ⎛ 1 ⎞ xD = ⎜ Mm ⎟ ⎝ 1 + 1000 ⎠ 11. Sacando ln a ambos lados: (12) Mm ln xD = − ln (1 + 1000 ) (13) 12. Diferenciando e ingualando a la ecuación (8): ⎛ M dm ⎞ ⎛ ∆ H f d ( ln xD ) = − ⎜ 1000 Mm ⎟ = ⎜ 2 ⎝ 1 + 1000 ⎠ ⎝ RT © 1997 - 2008 I. Nieves Martínez ⎞ ⎟ dT ⎠ (14) Página - 2 - PROPIEDADES COLIGATIVAS 13. Despejando por dT MRT02 dm = 1000∆ H f M dT = ⎛ ∆H f ⎞ Mm 1000 ⎜ 1 + 1000 ) 2 ⎟( ⎝ RT ⎠ para soluciones diluidas: (15) MRT02 ⎛ ∂T ⎞ −⎜ ≈ = Kf (16) ⎟ ⎝ ∂m ⎠ P , xs →0 1000∆ H f Si definimos θ f = T0 − T entonces dθ f = − dT entonces la ecuación (16) se puede escribir : dθ f dm = Kf separando var iables dθ f = K f dm θf int egrando ∫ dθ (17a ) m f = ∫K 0 f dm (17b) 0 θ f = Kf m (17c) 15. La constante Kf se conoce como la constante crioscópica y solo depende de la naturaleza del disolvente. 16. Aplicación: peso del soluto (Tsoluto), masa molar de soluto (M) y gramos de disolvente (Tdisolvente). Molalidad: m = nsoluto ω disolvente = ω soluto 1000 ωD M soluto 1000 = ω soluto 1000 ω D M soluto (18) La ecuación (18) se sustituye en la ecuación (17c) θ f = Kf m = Kf 1000ω soluto ω D M soluto (19) Esta ecuación se puede usar para determinar la masa molar de un soluto desconocido. La entropía disminuye cuando pasa de la solución a sólido. Se requiere energía y ésta sale de la energía interna. B. Presión Osmótica 1. Definición a. Transferencia de disolvente a través de membrana semipermeable, debido a diferencias en concentración a ambos lados de la membrana. © 1997 - 2008 I. Nieves Martínez Página - 3 - PROPIEDADES COLIGATIVAS b. La diferencia entre la presión sobre el disolvente y la presión sobre la solución (B) c. La presión que tendrá que aplicarle a una solución de cierta concentración para evitar el flujo espontáneo de las moléculas del disolvente a través de la membrana. 2. Derivación de la ecuación A Vm = RT: a. µ D* ( puro) = µ D ( solucion) ( ) b. µ D T , P, x D < µ D* (T , P) c. d. e. Espontáneo µ D − µ D* = RT ln x D P sobre la solución aumenta µ D (T , [ P + Π ], x D ) = µ D* (T , P) En equilibrio µ D (T , [ P + Π ], x D ) = µ D* (T , [ P + Π ]) + RT ln x D = µ D* (T , P) f. A T constante dG = - SdT + V dP = V dP y entonces: dµ D* = Vm* dP µ D* ( T ,[ P + Π ]) * D µ D* ( T , P ) ∫ dµ P+ Π = ∫V * m dP P µ (T , [ P + Π ] ) − µ ( T , P ) = * D * D P+ Π ∫V * m dP = Vm* ([ P + Π ] − P) = Vm* Π P g. La ecuación en (e) se puede re-arreglar: µ D* (T , [ P + Π ]) − µ D* (T , P) = − RT ln x D h. Por lo tanto el resultado de la ecuación en (f) es igual al resultado en la ecuación en (g) y entonces: Vm* Π = − RT ln x D i. Para solución binaria: 1 = x D + x s entonces la ecuación en (h) se puede re-escribir: Π Vm* = − RT ln x D = − RT ln(1 − x s ) ≈ − RT ( − x s ) Π Vm* = RT ( x s ) = RT Π = n ns ≈ RT s nD n D + ns ns RTns RT = = [ s] RT V* Vm* n D para sol dil ya que n DVm* = V * 3. Utilidad a. Remoción de desperdicios b. Plantas c. Osmosis invertida - desalinización © 1997 - 2008 I. Nieves Martínez Página - 4 -







