Tarea 1 Archivo
Anuncio

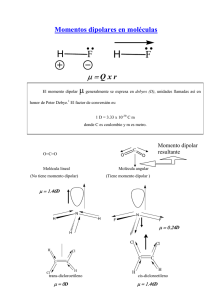
Principios de estructura de la materia. Tarea – 1 1- Las siguientes son conclusiones que un estudiante promedio obtendría después de leer sobre la tabla periódica en un libro de química general. Después de leer los capítulos 2 y 18 de la 4ª ed. del Huheey ¿qué le agregarías o modificarás a cada una de las siguientes afirmaciones? (No dudes en extender tu explicación tanto como lo creas necesario) a- Las afinidades electrónicas aumentan hacia la derecha y hacia arriba en la tabla periódica. b- Las energías de ionización disminuyen hacia abajo en la tabla. c- Los radios atómicos se incrementan hacia abajo en la tabla. d- Las electronegatividades disminuyen hacia la izquierda y hacia abajo en la tabla. 2- El tetracloruro de carbono es inerte en el agua mientras que el tricloruro de boro se hidroliza con la humedad del aire. Sugiere una razón que lo explique. 3- La más simple relación entre electronegatividad y momento dipolar indica que a mayor diferencia de electronegatividad entre dos átomos, mayor momento dipolar tendrá un enlace. ¿Cómo reconciliar esto con el hecho de que el óxido de trimetilamina presenta un momento dipolar de 5.02 D mientras que el del óxido de trimetilfosfina es de sólo 4.37 D? 4- Además de algunos elementos del grupo 14, ¿en qué otros grupos se presenta el llamado efecto del par inerte? 5- ¿Por qué se supone que el compuesto CsAu es iónico y no una aleación metálica si está formado por dos metales? Argumenta bien tu respuesta. 6- Analiza los diagramas de contorno de los obitales 2pz y 3pz del carbono. ¿Qué diferencias encuentras? ¿Cuántos nodos radiales y angulares tiene cada uno? 7- ¿Qué es y a qué se debe la contracción lantánida? 8- ¿Qué es y a qué se debe la contracción boránida? 9- ¿Qué es y a qué se debe la contracción escándida? 10- ¿Por qué el silicio no forma cadenas tan fácilmente como lo hace el carbono?