Panbronquiolitis difusa. Una rara enfermedad en países
Anuncio
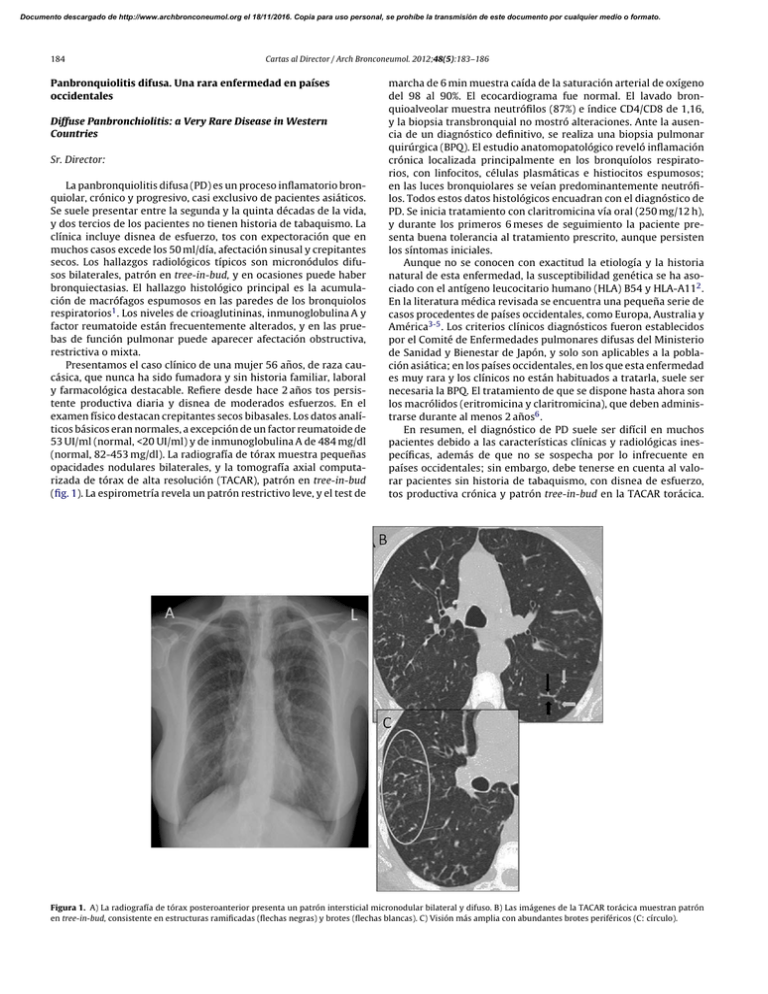
Documento descargado de http://www.archbronconeumol.org el 18/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. 184 Cartas al Director / Arch Bronconeumol. 2012;48(5):183–186 Panbronquiolitis difusa. Una rara enfermedad en países occidentales Diffuse Panbronchiolitis: a Very Rare Disease in Western Countries Sr. Director: La panbronquiolitis difusa (PD) es un proceso inflamatorio bronquiolar, crónico y progresivo, casi exclusivo de pacientes asiáticos. Se suele presentar entre la segunda y la quinta décadas de la vida, y dos tercios de los pacientes no tienen historia de tabaquismo. La clínica incluye disnea de esfuerzo, tos con expectoración que en muchos casos excede los 50 ml/día, afectación sinusal y crepitantes secos. Los hallazgos radiológicos típicos son micronódulos difusos bilaterales, patrón en tree-in-bud, y en ocasiones puede haber bronquiectasias. El hallazgo histológico principal es la acumulación de macrófagos espumosos en las paredes de los bronquiolos respiratorios1 . Los niveles de crioaglutininas, inmunoglobulina A y factor reumatoide están frecuentemente alterados, y en las pruebas de función pulmonar puede aparecer afectación obstructiva, restrictiva o mixta. Presentamos el caso clínico de una mujer 56 años, de raza caucásica, que nunca ha sido fumadora y sin historia familiar, laboral y farmacológica destacable. Refiere desde hace 2 años tos persistente productiva diaria y disnea de moderados esfuerzos. En el examen físico destacan crepitantes secos bibasales. Los datos analíticos básicos eran normales, a excepción de un factor reumatoide de 53 UI/ml (normal, <20 UI/ml) y de inmunoglobulina A de 484 mg/dl (normal, 82-453 mg/dl). La radiografía de tórax muestra pequeñas opacidades nodulares bilaterales, y la tomografía axial computarizada de tórax de alta resolución (TACAR), patrón en tree-in-bud (fig. 1). La espirometría revela un patrón restrictivo leve, y el test de marcha de 6 min muestra caída de la saturación arterial de oxígeno del 98 al 90%. El ecocardiograma fue normal. El lavado bronquioalveolar muestra neutrófilos (87%) e índice CD4/CD8 de 1,16, y la biopsia transbronquial no mostró alteraciones. Ante la ausencia de un diagnóstico definitivo, se realiza una biopsia pulmonar quirúrgica (BPQ). El estudio anatomopatológico reveló inflamación crónica localizada principalmente en los bronquíolos respiratorios, con linfocitos, células plasmáticas e histiocitos espumosos; en las luces bronquiolares se veían predominantemente neutrófilos. Todos estos datos histológicos encuadran con el diagnóstico de PD. Se inicia tratamiento con claritromicina vía oral (250 mg/12 h), y durante los primeros 6 meses de seguimiento la paciente presenta buena tolerancia al tratamiento prescrito, aunque persisten los síntomas iniciales. Aunque no se conocen con exactitud la etiología y la historia natural de esta enfermedad, la susceptibilidad genética se ha asociado con el antígeno leucocitario humano (HLA) B54 y HLA-A112 . En la literatura médica revisada se encuentra una pequeña serie de casos procedentes de países occidentales, como Europa, Australia y América3-5 . Los criterios clínicos diagnósticos fueron establecidos por el Comité de Enfermedades pulmonares difusas del Ministerio de Sanidad y Bienestar de Japón, y solo son aplicables a la población asiática; en los países occidentales, en los que esta enfermedad es muy rara y los clínicos no están habituados a tratarla, suele ser necesaria la BPQ. El tratamiento de que se dispone hasta ahora son los macrólidos (eritromicina y claritromicina), que deben administrarse durante al menos 2 años6 . En resumen, el diagnóstico de PD suele ser difícil en muchos pacientes debido a las características clínicas y radiológicas inespecíficas, además de que no se sospecha por lo infrecuente en países occidentales; sin embargo, debe tenerse en cuenta al valorar pacientes sin historia de tabaquismo, con disnea de esfuerzo, tos productiva crónica y patrón tree-in-bud en la TACAR torácica. Figura 1. A) La radiografía de tórax posteroanterior presenta un patrón intersticial micronodular bilateral y difuso. B) Las imágenes de la TACAR torácica muestran patrón en tree-in-bud, consistente en estructuras ramificadas (flechas negras) y brotes (flechas blancas). C) Visión más amplia con abundantes brotes periféricos (C: círculo). Documento descargado de http://www.archbronconeumol.org el 18/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Cartas al Director / Arch Bronconeumol. 2012;48(5):183–186 185 Finalmente cabe recalcar que, tras la revisión exhaustiva de la bibliografía médica, este sería el primer caso reportado procedente de España, que viene a sumarse a los muy infrecuentes casos descritos en Europa. 5. Anthony M, Singham S, Soans B, Tyler G. Diffuse panbronchiolitis: not just an Asian disease: Australian case series and review of the literature. Biomed Imaging Interv J. 2009;5:e19. 6. Yang M, Dong BR, Lu J, Lin X, Wu HM. Macrolides for diffuse panbronchiolitis. Cochrane Database Syst Rev. 2010:CD007716. Bibliografía Yamilex Urbano Aranda ∗ , Isabel García San José y Encarnación López Gabaldón 1. Poletti V, Casoni G, Chilosi M, Zompatori M. Panbronchiolitis. Eur Respir J. 2006;28:862–71. 2. Keicho N, Hijikata M. Genetic predisposition to diffuse panbronchiolitis. Respirology. 2011;16:581–8. 3. Martinez JA, Guimarães SM, Ferreira RG, Pereira CA. Diffuse panbronchiolitis in Latin America. Am J Med Sci. 2000;319:183–5. 4. Fitzgerald JE, King Jr TE, Lynch DA, Tuder RM, Schwarz MI. Diffuse panbronchiolitis in the United States. Am J Respir Crit Care Med. 1996;154 2 Pt 1:497– 503. Hematoma mediastinal espontáneo como manifestación inicial de adenoma quístico de paratiroides ectópica Spontaneous Mediastinal Hematoma as an Initial Manifestation of Ectopic Parathyroid Cystadenoma Sr. Director Se expone el caso de una mujer de 61 años que consultó por hematoma mediastinal atraumático. Además, refirió picadura de ofidio en brazo derecho 5 días antes, con reacción local. Los estudios por imágenes descartaron lesiones vasculares o cardíacas. En la toracotomía exploradora se observó un gran hematoma mediastinal que infiltraba el tejido mediastinal laxo, sin que se identificaran tumores o vasos sangrantes (fig. 1A). No había lesión de la vena cava superior. Se abrió el pericardio y se exploró la raíz de la aorta y la arteria pulmonar, sin encontrar lesión o sangrado. Se extrajeron múltiples coágulos y tejido adiposo infiltrado por sangre. En el material enviado al servicio de patología se diagnosticó rotura de adenoma quístico de glándula paratiroidea ectópica. En el estudio macroscópico se evidenció tejido extensamente infiltrado por hemorragia. En la microscopia se observó la proliferación de células poligonales, sin atipia, de citoplasma claro, dispuestas en nidos sólidos y rodeadas por un estroma densamente vascularizado, con extensa hemorragia (fig. 1B). Dichas células fueron positivas para CK7, AE1/AE3, SYN y RCC. Los hematomas mediastinales son causados por traumatismos, aneurismas o rotura de grandes vasos o de corazón, y por iatrogenia asociada a procedimientos invasivos o quirúrgicos1 . Entre otras etiologías posibles se encuentran: alteraciones de la coagulación, tumores (benignos y malignos), tos o estornudos (maniobra de Valsalva), uremia, hipertensión renovascular, rotura de quistes tímicos, tiroideos y paratiroideos, metástasis, hematopoyesis extramedular y lipomatosis mediastínica1 . Si clínicamente no se ha podido identificar la causa del hematoma, se debe recurrir a los métodos de diagnóstico. Como regla de oro, se dispone de la aortografía y la exploración quirúrgica. Kodolitsch et al.2 demostraron que la combinación de los estudios tenía mayor rédito que cada uno por separado. Así, el ecocardiograma transtorácico y la tomografía computarizada tenían una sensibilidad del 75% y una especificidad del 99%, y el ecocardiograma transesofágico y la resonancia magnética nuclear contaban con una sensibilidad del 92% y una especificidad del 97%. No hay datos concretos todavía que avalen el uso del PETscan para el diagnóstico. El tratamiento de estos pacientes varía según el estado de los mismos y los resultados de los métodos complementarios. Si el paciente está estable y hay ciertas sospechas de la etiología por los resultados de los estudios, la conducta Servicio de Neumología, Hospital Virgen de la Salud, Toledo, España ∗ Autor para correspondencia. Correo electrónico: yamilexurbano@separ.es (Y. Urbano Aranda). doi:10.1016/j.arbres.2011.12.010 puede ser conservadora. Otra alternativa es la embolización percutánea. Si el paciente está inestable y no se ha podido encontrar la causa, el tratamiento es la exploración quirúrgica (toracotomía o esternotomía)1,2 . Con respecto a los hallazgos histopatológicos, en un estudio publicado en 1995 se estudiaron 97 pacientes con diagnóstico de hiperparatiroidismo renal, detectándose 60 glándulas ectópicas en 34 pacientes. En este estudio, la localización ectópica más frecuente fue mediastinal3 . En otro estudio de 231 pacientes operados por hiperparatiroidismo, el 16% tenía ectopia de las glán- A B Figura 1. A Corte axial de tomografía computarizada con contraste intravenoso: ensanchamiento del mediastino por gran infiltración mediastinal por hematoma. B Tejido paratiroideo con extensa hemorragia y vasocongestión (H/E, ×4).