Guia Nomenclatura BINARIA
Anuncio

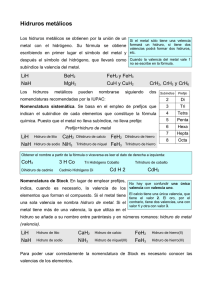
Instituto Inmaculada Concepción Valdivia Departamento de Ciencias y Educación tecnológica Química: Anabella Hurtado Barra GUIA DE APRENDIZAJE NOMBRE: ____________________________________________________________________________ FECHA: JULIO 2013 MEDIO CAPACIDAD: DESTREZAS: VALOR: ACTITUD: CONTENIDOS: PRIMERO RAZONAMIENTO LOGICO Y ANALIZAR Identificar, Aplicar, Expresar y Concluir Fe Coherencia y perseverancia Nomenclatura Binaria Identificar características y reglas de compuestos químicos leyendo y marcando hechos relevantes con un destacador, enfatizando la perseverancia. La nomenclatura es el proceso de poner nombre a los compuestos químicos y estos consisten en dos palabras, un nombre genérico y un nombre específico. El genérico sirve para una gran cantidad de compuestos y el específico para uno solo. Ejemplo: ácido clorhídrico Ácido, es el nombre genérico e incluye a todos los ácidos conocidos. Clorhídrico, es el nombre específico y se refiere sólo a este acido. Un compuesto químico es la unión de dos o más elementos siempre en las mismas proporciones, con pérdida de sus propiedades iniciales y aparición de otras nuevas. Cuando el Hidrógeno se une con el Oxígeno para formar agua, la proporción es siempre de 2H2 y O2 2H2O, cambiando totalmente sus propiedades. Los compuestos binarios se clasifican en: a) Hidrogenados (hídridos) Estos pueden ser: H. básicos H. ácidos H. salinos o hidruros b) Oxigenados (Óxidos) Estos pueden ser: básicos u óxidos Ácidos o anhídridos c) Sales binarias (haluros) Los HÍDRIDOS BÁSICOS: Son aquellos compuestos que en solución acuosa se comportan como bases (contrario al ácido); tiñen azul el papel tornasol rojo y dan rojo con la fenoftaleína (indicador) que es incolora. Se forman cuando el hidrógeno reacciona con alguno de los siguientes elementos C+4 – N+3 – P+3 – As+3 - Sb +3. Ejemplo: C+4 + 4H-1 CH4 gas metano (gas de los pantanos). Todos estos compuestos son conocidos por sus nombres comunes o comerciales. NH3 = amoniaco PH3 = fosfamina AsH3 = arsenamina SbH3 = estibamina Los HÍBRIDOS ACIDOS O hidrácidos: Son compuestos que están formado por el hidrógeno y un no metal, tal como: F, Cl, Br, I, S, Se, Te, actuando con su menor valencia. Se nombran con la palabra ACIDO seguida del nombre del no metal terminado en HIDRICO. Aplicar reglas de nomenclatura de hídridos, colocando frente a cada sustancia dada el nombre correspondiente, enfatizando la perseverancia. a) HF = b) HI = c) H2Se = d) HBr = e) H2 S = f) H2Te = Los HIDRIDOS SALINOS O hidruros: Resultan de la combinación del hidrógeno con la mayoría de los metales. Se nombran con la palabra HIDRURO seguida del nombre del metal. Ejemplo: Na+ + HNaH hidruro de sodio Ca+2 + H- CaH2 hidruro de calcio Si el metal tiene dos valencias, como el Cu, se desarrolla cada valencia por separado. Al que posee la valencia menor Cu+ se le agrega la terminación OSO y el con la valencia mayor Cu++ termina en ICO. Ejemplo: Cu+ + HCuH Hidruro cuprOSO (valencia menor) 2+ Cu + H CuH2 Hidruro cúprICO ( valencia mayor) Expresar la ecuación de formación del hidruro cobaltoso y el hidruro cobáltico, por separado. a) b) Los OXIDOS BASICOS: Estos compuestos se forma cuando un metal reacciona con el oxígeno. Se nombran con la palabra OXIDO seguido del nombre del metal, pero si tiene dos valencias la mayor termina en ICO y la menor en OSO. Ejemplo: Con una valencia K+ + O-2 K2O Óxido de potasio Con dos valencia Hg+ + O-2 Hg2+ + O2- Hg2O HgO Óxido mercurioso Óxido mercúrico Aplicar reglas básicas de nomenclatura de óxidos básicos, haciendo reaccionar los metales dados con el oxígeno y señalando el nombre, enfatizando la coherencia. a) Hierro: b) Estaño: c) Cinc: d) Cadmio: e) Níquel: Los OXIDOS ACIDOS o anhídridos: Son los que se producen cuando un No metal se une al oxígeno. Se obtienen igual que los óxidos básicos, pero usando la palabra ANHIDRIDO. La terminación del No metal depende de la valencia. Una valencia: terminación: ICO Dos valencias: menor OSO mayor ICO Tres valencias: OSO; ICO; PER - ICO Cuatro valencias: hipo - OSO; OSO; Ejemplo: caso Si4+ + N3+ + N5+ + O2O2O2- SiO2 N2O3 N2O5 ICO; per - anhídrido silícico anhídrido nitroso anhídrido nítrico Mn4+ + O2Mn6+ + O2Mn7+ + O2- MnO2 anhídrido manganoso MnO3 anhídrido mangánico Mn2O7 anhídrido permangánico Cl+ Cl3+ Cl5+ Cl7+ Cl2O anhídrido hipocloroso Cl2O3 anhídrido cloroso Cl2O5 anhídrido clórico Cl2O7 anhídrido perclórico + + + + O2O2O2O2- ICO Las SALES BINARIAS o haluros: Son compuestos que resultan de la combinación de un metal con un No metal proveniente de un HIDRACIDO. Para nombrarlos se hace terminar en URO el No metal, seguido del nombre del metal, el que puede terminar en OSO o ICO si tiene dos valencias. Ejemplo: Ag+ + HCl AgCl + H2 Cloruro de plata 2+ Fe + HBr FeBr2 + H2 Bromuro ferroso 3+ Fe + HI FeI3 + H2 Ioduro férrico Expresar la fórmula de los siguientes compuestos, completando la línea adjunta desarrollando la perseverancia. a) Anhidrido yodoso ______________________ b) Óxido estañoso ______________________ c) Hidruro plúmbico ______________________ d) Anhídrido perbrómico ______________________ e) Amoniaco ______________________ f) Metano ______________________ Aplicar reglas de nomenclatura, completando la línea adjunta con el nombre que corresponda a los siguientes compuestos, enfatizando la coherencia. a) AsH3 b) SO3 c) AlH3 d) Li2O e) P2O3 f) FeO g) Cl2O h) MgCl2 Concluir sobre la nomenclatura química binaria, destacando los hechos relevantes que se muestran, enfatizando la coherencia.