Vía del AMPc: Segundo mensajero y la fosforilación de proteínas
Anuncio
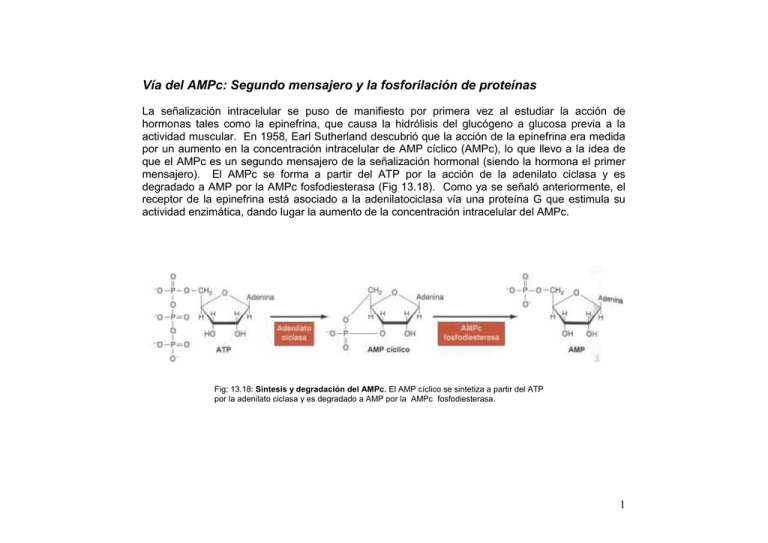
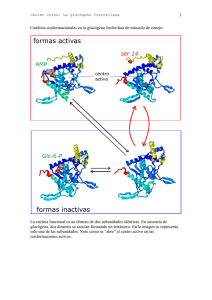
Vía del AMPc: Segundo mensajero y la fosforilación de proteínas La señalización intracelular se puso de manifiesto por primera vez al estudiar la acción de hormonas tales como la epinefrina, que causa la hidrólisis del glucógeno a glucosa previa a la actividad muscular. En 1958, Earl Sutherland descubrió que la acción de la epinefrina era medida por un aumento en la concentración intracelular de AMP cíclico (AMPc), lo que llevo a la idea de que el AMPc es un segundo mensajero de la señalización hormonal (siendo la hormona el primer mensajero). El AMPc se forma a partir del ATP por la acción de la adenilato ciclasa y es degradado a AMP por la AMPc fosfodiesterasa (Fig 13.18). Como ya se señaló anteriormente, el receptor de la epinefrina está asociado a la adenilatociclasa vía una proteína G que estimula su actividad enzimática, dando lugar la aumento de la concentración intracelular del AMPc. Fig: 13.18: Síntesis y degradación del AMPc. El AMP cíclico se sintetiza a partir del ATP por la adenilato ciclasa y es degradado a AMP por la AMPc fosfodiesterasa. 1 Entonces, ¿cómo señaliza el AMPc la rotura del glucógeno? Este y la mayoría de los efectos del AMPc en la célula animal son mediados por la acción del la proteína quinasa del AMPc o proteína quinasa A, una enzima descubierta por Donald Walsh y Ed Krebs en 1968. La forma inactiva de la proteína quinasa A es un tetrámero constituido por dos subunidades catalíticas y dos subunidades reguladoras (fig 13.19). El AMPc se une a la subunidades reguladoras provocando su disociación de las subunidades catalíticas. Las subunidades catalíticas libres son enzimáticamente activas y son capaces de fosforilar residuos de serina de sus proteínas diana. Fig 13.19: regulación de la proteína quinasa A: La forma inactiva de la proteína quinasa A está constituidas por subunidades reguladoras (R) y por dos subunidades catalíticas (C). La unión del AMPc a las subunidades reguladoras induce un cambio conformacional que lleva a la disociación de las subunidades catalíticas, de lo que resulta la activación enzimática de esta. 2 En la regulación del metabolismo del glucógeno, la proteína quinasa A fosforila a dos proteínas diana (Fig 13.20). La primera es otra proteína quinasa, la fosforilasa quinasa que es fosforilada y activada por la proteína quinasa A. La fosforilasa quinasa, a se vez, fosforila y activa a la glucógeno fosforilasa que cataliza la rotura del glucógeno a glucosa -1- fosfato. Además la proteína quinasa A fosforila la enzima glucógeno sintetasa, que cataliza las síntesis del glucógeno. En ese caso, la fosforilación inhibe la actividad enzimática. Por lo tanto el incremento del AMPc y la activación de la proteína quinasa A bloquea la síntesis de glucógeno a la vez que activa su hidrólisis. La cadena de reacciones que conduce desde el receptor de la epinefrina hasta la glucógeno fosforilasa proporciona un buen ejemplo de la amplificación de la señal durante la traducción de las señales intracelulares. Cada molécula de epinefrina activa un único receptor. Sin embargo, cada receptor puede activar hasta cien moléculas de Gs activa a la adenilato ciclasa, que cataliza la síntesis de muchas moléculas de AMPc. La señal continúa amplificándose puesto que cada molécula de proteína quinasa A fosforila muchas moléculas de fosforilasa quinasa, que, a su vez, fosforilan muchas moléculas de glucógeno fosforilasa. Por lo tanto, la unión de la hormona a un pequeño número de receptores da lugar a la actividad del un número mucho mayor de enzimas diana intracelulares. 3 Fig 13.20: Regulación del metabolismo de glucógeno por la proteína quinasa A: La proteína quinasa A fosforila a la glucógeno sintetasa y a la fosforilasa quinasa. Esta fosforilación inhibe a la glucógeno sintetasa (que cataliza la síntesis de glucógeno), mientras que activa a la fosforilasa quinasa. Entonces, la fosforilasa quinasa fosforila y activa a la glucógeno fosforilasa, que cataliza la rotura del glucógeno en glucosa-1-fosfato Tomado de COOPER G. M., 2002, La célula, 2ª edición, Marban 4