QUIMICA AGROPECUARIA (RB8002)
Anuncio

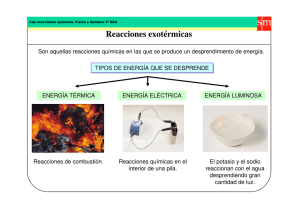
ASIGNATURA: QUIMICA AGROPECUARIA (RB8002) GUÍA N°3: “REACCIONES ENDOTERMICAS Y EXOTERMICAS” I. Presentación de la guía: Competencia: El alumno será capaz de aplicar los principios de termoquímica en reacciones químicas de disolución y descomposición térmica. Evaluación: La evaluación de esta guía tiene carácter formativo lo que permitirá detectar el dominio de los objetivos planteados. Metodología: El docente organizará grupos de trabajo para desarrollar las actividades propuestas. Posteriormente el alumno confeccionará un informe de los resultados obtenidos que será adjuntado en el portafolio semestral. II. Resumen Teórico: Todas las reacciones químicas obedecen a dos leyes fundamentales: La ley de conservación de la materia y la ley de conservación de la energía. Naturaleza de la energía y tipos de energía: “Energía” es un término bastante utilizado a pesar de que representa un concepto muy abstracto. Por ejemplo, cuando alguien se siente cansado, se suele decir que no tiene energía; es común leer sobre la búsqueda de energía de alternativas a fuentes de energía no renovables. A diferencia de la materia la energía se reconoce por sus efectos. No puede verse, tocarse o pesarse. La energía generalmente se define como la capacidad para efectuar un trabajo. Todas las formas de energía son capaces de efectuar un trabajo (es decir, ejercen una fuerza a lo largo de una distancia), pero no todas ellas tienen la misma importancia para la química y otras disciplinas. Por ejemplo, es posible utilizar la energía contenida en las olas. Los químicos definen trabajo como el cambio de energía que resulta de un proceso. La energía cinética, energía producida por un objeto en movimiento, es una de las formas de energía más importantes. Otras son energía radiante, energía térmica, energía química y energía potencial. La energía radiante, o energía solar, proviene del Sol y es la principal fuente de energía de la Tierra. La energía solar calienta la atmósfera y la superficie terrestre, estimula el crecimiento de la vegetación a través de un proceso conocido como fotosíntesis, e influye sobre los patrones globales del clima. La energía térmica, es la energía asociada con el movimiento aleatorio de los átomos y las moléculas. En general, la energía térmica se calcula a partir de mediciones de temperatura. Cuando más vigoroso es el movimiento de los átomos y de las moléculas en una muestra de materia, estará más caliente y su energía térmica será mayor. Sin embargo, es necesario distinguir con claridad entre energía térmica y temperatura. Una taza de café a 70°C tiene mayor temperatura que una tina llena de agua caliente a 40°C, pero en la tina se almacena mucha más energía térmica porque tiene un volumen y un masa mucho mayor que la taza de café, y por tanto más moléculas de agua y mayor movimiento molecular. R. Endotérmicas y exotérmicas (RB8002). Documento preparado por Marcela Urrutia. Docente Sede La Serena. Página 1 de 4 La energía química, es una forma de energía que se almacena en las unidades estructurales de las sustancias; esta cantidad se determina por el tipo y distribución de los átomos que constituyen la sustancia. Cuando las sustancias participan en una reacción química, la energía química se libera, almacena o se convierte en otras formas de energía. La energía potencial, es la energía disponible en función de la posición de un objeto. Por ejemplo, debido a su altitud, una piedra en la cima de una colina tiene mayor energía potencial y al caer disminuirá su energía potencial. Todas las formas de energía se pueden convertir unas en otras. Cuando se está bajo la luz solar se siente calor porque, en la piel, la energía radiante se convierte en energía térmica. Cuando se hace ejercicio, la energía química almacenada en el cuerpo se utiliza para producir energía cinética. Cuando una pelota empieza a rodar cuesta abajo, su energía potencial se transforma en energía cinética. Sin duda, existen muchos otros ejemplos. Cambios de energía en las reacciones químicas: A menudo los cambios de energía que ocurren durante las reacciones químicas tienen tanto interés práctico como las relaciones de masa. Casi todas las reacciones químicas absorben o producen (liberan) energía, por lo general en forma de calor. Es importante entender la diferencia entres energía térmica y calor. El calor es la transferencia de energía térmica entre dos cuerpos que están a diferentes temperaturas. Con frecuencia se habla de “flujo de calor” desde un objeto más caliente hacia uno frío. La termoquímica es el área de la química que estudia los cambios de calor en las reacciones químicas. Para analizar los cambios de energía asociados con las reacciones químicas, primero es necesario definir el sistema (zona específica del universo de interés). Hay tres tipos de sistemas. Un sistema abierto puede intercambiar masa y energía, generalmente en forma de calor, con sus alrededores. Un sistema cerrado, permite la trasferencia de energía (calor) pero no de masa. Un sistema aislado, impide la transferencia de energía (calor) y masa. Desde el punto de vista del proceso de transferencia de calor, tenemos un proceso endotérmico, en el cuál los alrededores deben suministrar calor al sistema y proceso exotérmico, en el cuál el sistema transfiere energía térmica hacia los alrededores. III. Actividad práctica: Observación de reacciones endotérmicas y exotérmicas. IV. Objetivos: Reconocer los conceptos básicos de la termoquímica. Preparar y determinar la diferencia de temperatura para disoluciones endotérmicas y exotérmicas. R. Endotérmicas y exotérmicas (RB8002). Documento preparado por Marcela Urrutia. Docente Sede La Serena. Página 2 de 4 V. Materiales y reactivos: VI. Vasos de precipitado de 250 mL Tubos de ensayo Termómetros 0 – 100 °C Varilla de agitación Piscetas plásticas de 500 mL Probeta de 100 mL Agua destilada Plancha calefactora Cloruro de sodio, NaCl Hidróxido de sodio, NaOH Acido sulfúrico concentrado, H2SO4 Nitrato de amonio, NH4NO3. Óxido de mercurio (II), HgO. Procedimiento experimental Experiencia N°1: Reacciones exotérmicas (reacciones de disolución) A) Disolución de Hidróxido de sodio, NaOH en agua destilada. Agregar en un vaso de precipitado 20 mL de agua destilada y medir la temperatura con un termómetro adecuado. Registrar los datos en la tabla de resultados. Adicionar al vaso 2,0 g de hidróxido de sodio, NaOH. Agitar con una varilla para disolver. Determinar la temperatura de la nueva disolución. Registrar los datos en la tabla de resultados. En función de sus observaciones y resultados confirme la presencia de una reacción exotérmica. B) Disolución de ácido sulfúrico concentrado, H2SO4 en agua destilada. Agregar en un vaso de precipitado 20 mL de agua destilada y medir la temperatura con un termómetro adecuado. Registrar los datos en la tabla de resultados. Adicionar al vaso 10,0 mL de ácido sulfúrico concentrado, H2SO4. Agitar con una varilla para homogenizar. Determinar la temperatura de la nueva disolución. Registrar los datos en la tabla de resultados. En función de sus observaciones y resultados confirme la presencia de una reacción exotérmica. Experiencia N°2: Reacciones endotérmicas C) Descomposición térmicas de óxidos inestables. Agregar en un tubo de ensayo limpio y seco una punta de espátula de óxido de mercurio (II), HgO. Registrar las observaciones correspondientes del Calentar el tubo de ensayo y su contenido en la llama de un mechero. Registrar los cambios en el sólido. Escribir la ecuación química, del proceso estudiado. D) Disolución de nitrato de amonio, NH4NO3 en agua destilada. Agregar en un vaso de precipitado 10 mL de agua destilada y medir la temperatura con un termómetro adecuado. Registrar los datos en la tabla de resultados. Adicionar al vaso 5,0 g de nitrato de amonio, NH4NO3. Agitar con una varilla para disolver y homogenizar. Determinar la temperatura de la nueva disolución. Registrar los datos en la tabla de resultados. R. Endotérmicas y exotérmicas (RB8002). Documento preparado por Marcela Urrutia. Docente Sede La Serena. Página 3 de 4 VII. Cálculos: Debe desarrollar los cálculos para establecer la concentración molar de las disoluciones analizadas en los puntos A y D del procedimiento experimental VIII. Resultados Registrar los datos obtenidos durante el procedimiento experimental en la siguiente tabla. Experiencia Temperatura Temperatura práctica agua destilada (°C) disolución (°C) Proceso térmico A B D IX. X. Post-Laboratorio: - Redactar un informe de los resultados obtenidos según pauta de evaluación de informes que aparece en la guía para el éxito académico 2009. Universidad tecnológica de ChileInacap. Sede la Serena. Pagina 54. - Investigue el tipo de proceso energético involucrado en los siguientes casos: Urea-agua Cloruro de calcio-agua Acido nítrico – cobre metálico Hielo-Cloruro de sodio Combustión de la madera Bibliografía Química Ciencia Central, Brown, LwMay Bursten, Novena Edición. Editorial Pearson 2004. Química General, Raymond Chang, séptima edición. Editorial Mc Graw Hill 2002. R. Endotérmicas y exotérmicas (RB8002). Documento preparado por Marcela Urrutia. Docente Sede La Serena. Página 4 de 4