LA QUiMiCA DEL CARBONO
Anuncio

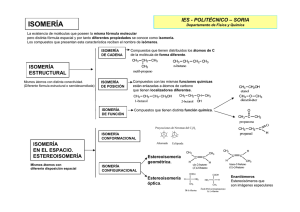
LA QUiMiCA DEL CARBONO • El término Química Orgánica se debe al químico sueco J. Jacob Berzelius, que llamó compuestos orgánicos a las sustancias que se obtenían de la materia viva. • La Química del Carbono incluye todos los compuestos que contienen carbono excepto algunos sencillos como CO, CO2, carbonatos, hidrogenocarbonatos, carburos y cianuros. • División tradicional de la Química: o o o o o o Química Orgánica o Química del Carbono: estudia compuestos del C Química Inorgánica: estudia propiedades de los elementos y compuestos. Química Analítica: estudia la composición y pureza de las sustancias. Química Física: explica fenómenos químicos y cambios energéticos. Química Técnica: describe los procedimientos industriales de obtención de sustancias. Bioquímica: estudia procesos químicos que tienen lugar en los organismos vivos. EL CARBONO COMO UNIDAD ESTRUCTURAL BÁSICA • El carbono permite la formación de muchos compuestos, este comportamiento es único entre los elementos de la tabla periódica. Hay que estudiar las características del átomo de carbono: o El átomo de C (Z=6) tiene 6 electrones que se reparten según la configuración electrónica: 1s22s22p2. o El C puede enlazarse con otros átomos mediante enlaces sencillos, dobles o triples. o Los enlaces C-C son enlaces covalentes puros, fuertes y estables, por lo que los átomos de C pueden unirse entre si y formar cadenas estables (lineales, ramificadas, cíclicas) o El C se puede unir a átomos de otros elementos como H, O, N, etc., formando enlaces covalentes estables. REPRESENTACION DE LAS MOLÉCULAS ORGÁNICAS • En los compuestos orgánicos una misma fórmula puede corresponder a varias sustancias distintas. • Los distintos tipos de fórmulas que se pueden emplear son: o o o o o Fórmulas Fórmulas Fórmulas Fórmulas Fórmulas empíricas: indican qué átomos forman el compuesto y su proporción relativa. moleculares: indican el tipo de átomos que forman la molécula y su número. semidesenvolvidas: constan los enlaces entre átomos de C. desenvueltas: especifican todos los enlaces entre los distintos átomos. estereoquímicas: indican la disposición de los átomos en el espacio. ISOMERÍA Es la propiedad por la que varios compuestos que tienen la misma fórmula molecular presentan propiedades diferentes. Estos compuestos reciben el nombre de isómeros. La isomería es uno de los factores que hace posible la existencia de tantos compuestos orgánicos. Existen varios tipos: Isomería constitucional o estructural: se diferencian en la orden en la que enlazan sus átomos. o Isomería de cadena: cuando se diferencian en el esqueleto. o Isomería de posición: se diferencian en la distinta colocación del grupo funcional. o Isomería de función: tienen la misma fórmula molecular, pero grupos funcionales distintos. Isomería espacial o estereoisomería: idénticas fórmulas moleculares, solo se diferencian en la disposición de los átomos en el espacio. o Isomería conformacional: se acostumbra a suponer que la rotación de un enlace sencillo es libre. o Isomería óptica: se da en compuestos que guardan una relación objeto-imagen. Presencia de un carbono asimétrico. o Isometría geométrica: dos átomos de C están unidos mediante un enlace que tiene imposibilidad de giro.