Josep Maria Mo`dola, Pere Tudelaa,*, Montserrat Giménezb y
Anuncio

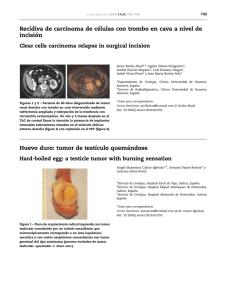
Documento descargado de http://www.elsevier.es el 18/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Cartas al Editor / Med Clin (Barc). 2011;137(9):424–429 2. Cisneros JM, Cobo J, Pujol M, Rodrı́guez J, Salavert M. Guı́a para el diagnóstico y tratamiento del paciente con bacteriemia. Enferm Infecc Microbiol Clin. 2007;25:111–30. 3. Tudela P, Lacoma A, Prat C, Mòdol JM, Giménez M, Barallat J, et al. Predicción de bacteriemia en los pacientes con sospecha de infección en urgencias. Med Clin (Barc). 2010;135:685–90. 4. Catalan B, Vitoria S, Tudela P, Mòdol JM, Prat C, Lacoma A, et al. Clinical predictors of disease severity in patients with infection suspicion in the emergency department. 23th European Society Intensive Care Medicine Annual Congress. Barcelona, 9-13 octubre 2010 (Presentación 1106). 5. Uettwiller-Geiger DL. Clinical applications of procalcitonin. Journal of Clinical Ligand Assay. 2007;30:20–8. 6. Tudela P, Queralt C, Giménez M, Carreres A, Tor J, Sopena N, et al. Detección de bacteriemia en pacientes dados de alta en urgencias: estudio de 61 episodios. Med Clin (Barc). 1998;111:201–4. 7. Tudela P, Mòdol JM, Giménez M, Prat C, Vilaseca B, Tor J. Bacteriemia en pacientes no hospitalizados: tendencias evolutivas en los últimos 10 años. Med Clin (Barc). 2007;129:770–2. 8. Ibero C, Regidor E, Dı́az C, Garcı́a G. Si fiebre, 2010;210:559–66. ? 428 hemocultivos? Rev Clin Esp. Josep Maria Mòdola, Pere Tudelaa,*, Montserrat Giménezb y Cristina Pratb a Unidad de Corta Estancia-Servicio de Urgencias, Hospital Universitari Germans Trias i Pujol, Badalona, Barcelona, España b Servicio de Microbiologı´a, Hospital Universitari Germans Trias i Pujol, Badalona, Barcelona, España * Autor para correspondencia. Correo electrónico: ptudela.germanstrias@gencat.cat (P. Tudela). doi:10.1016/j.medcli.2011.01.014 Estatus epiléptico en un enfermo con anemia falciforme Status epilepticus in a patient with sickle cell disease Sr. Editor: La anemia falciforme es la hemoglobinopatı́a estructural más frecuente, es una alteración producida de una mutación puntual en el gen de la b-globina. La homocigosidad del alelo HbS (SS) es la alteración genética conocida más asociada1. Dicha mutación genera una hemoglobina A (HbA) con dos cadenas b aberrantes, denominada hemoglobina S, que tiene la peculiaridad de polimerizar cuando se encuentra desoxigenada agrupándose en largas fibras proteicas que fuerzan al eritrocito a presentar la forma de hoz caracterı́stica de esta entidad. De esta manera disminuye su deformabilidad, aumenta su fragilidad y se modifican las caracterı́sticas biológicas de su membrana produciéndose una anemia hemolı́tica intra y extravascular crónica con episodios agudos en forma de crisis vasooclusivas que provocan manifestaciones clı́nicas en función del órgano afectado1-3. Presentamos el caso clı́nico de una mujer de 28 años, de raza afroamericana, que presentaba episodios esporádicos de dolor lumbar bilateral irradiados a rodilla de años de evolución. Dı́as previos a su ingreso presentó un nuevo episodio de dolor lumbar que se acompañó en esta ocasión de somnolencia y posterior disminución progresiva del nivel de consciencia. La paciente ingresó con un Glasgow Coma Score de 6 y presentó además flexión anormal al estı́mulo doloroso en extremidades derechas, por lo que se decidió intubación orotraqueal. No existieron alteraciones en la tomografı́a computarizada (TC) simple de cráneo ni en la punción lumbar. En el electroencefalograma se objetivó una actividad eléctrica, sı́ncrona, de alto voltaje y baja frecuencia, frontal bilateral, sin expresividad clı́nica, sugestiva de estatus epiléptico (EE) no convulsivo. Esta actividad cedió parcialmente con clonazepam, pero no se controló con fenitoı́na, ácido valproico y levetiracetam, requiriendo inducción de coma barbitúrico. La resonancia magnética de cráneo mostró varios focos de hiperintensidad de señal en la sustancia blanca de ambos hemisferios cerebrales con un hipocampo izquierdo más hiperintenso que el derecho y una probable morfologı́a alterada. La TC de abdomen evidenció un bazo con contornos irregulares por lesiones hipodensas periféricas posiblemente secundarias a alteraciones vasculares y/o isquémicas a nivel intraesplénico. En el hemograma destacó una hemoglobina de 66 g/L con VCM de 81 fl, HCM de 26 pg, CHCM de 319 g/L, plaquetas 44 x 109/L, LDH 4.381 UI/l. El test de Coombs fue negativo. En la extensión de sangre no se observaron esquistocitos y el marcador ADAMTS-13 fue negativo. La electroforesis de hemoglobinas evidenció un 1,8% de hemoglobina fetal (HbF) (referencia < 1,0), un 70,6% de hemoglobina S y el 20,7% restante de HbA. El fenotipo eritrocitario fue Jsa positivo y Jsb negativo. Se inició tratamiento con hidroxiurea con mejorı́a de las cifras de hemoglobina y plaquetas. Tras retirarse la sedación, la paciente presentó respiración espontánea correcta, extubándose sin incidencias, posteriormente permaneció consciente y orientada con hemiparesia derecha de predominio braquial 2/5 y alteraciones cognitivas de predominio frontal. El presente caso posee importancia clı́nica por la forma poco común de inicio clı́nico como un EE e importancia epidemiológica por el aumento de la incidencia en España de esta patologı́a debido a la inmigración. La prevalencia real de la anemia falciforme en España es desconocida y diversos estudios regionales han comprobado que es muy heterogénea, dependiendo directamente de la cantidad de extranjeros de la comunidad a estudio4,5. El EE es una emergencia neurológica que requiere una atención inmediata. La mortalidad intrı́nseca es del 1-7%, aunque la mortalidad global puede llegar al 20% y en casos de EE refractario hasta al 50%6. El accidente cerebrovascular (ACV) se observa en un porcentaje nada desdeñable de casos de anemia falciforme y se trata en una gran proporción de infartos cerebrales silentes. La posibilidad de un primer ACV antes de los 20, 30 y 45 años es de un 11, 15 y 24% respectivamente en los pacientes con la forma más común de anemia falciforme (SS)7. En la electroforesis de hemoglobina de la paciente destacaba la presencia de HbA, que descartaba la drepanocitosis homocigota. Sin embargo, el inicio con un ACV y el elevado porcentaje de hemoglobina S no sugerı́an que se tratara de un rasgo drepanocı́tico (SA), y se podrı́a orientar como una hemoglobinopatı́a doble heterocigota, como una drepanocitosis con rasgo b-talasémico (bS, btal+). Tal confirmación diagnóstica queda pendiente de estudio genético. Además, la paciente posee un genotipo eritrocitario muy poco común, que es Jsa positivo y Jsb negativo, lo cual es de gran importancia para futuras transfusiones sanguı́neas. El tratamiento de las crisis vasooclusivas es sintomático, excepto para el ictus, que tiene como tratamiento especı́fico la exsanguinotransfusión. La aplicación en esta paciente habrı́a sido de dudosa eficacia, puesto que el estudio de morfologı́a eritrocitaria realizado durante el EE no objetivó drepanocitos en sangre periférica, lo que sugerı́a que la crisis drepanocı́tica ya habı́a Documento descargado de http://www.elsevier.es el 18/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Cartas al Editor / Med Clin (Barc). 2011;137(9):424–429 429 finalizado y la lesión cerebral residual no se hubiera beneficiado de dicho tratamiento. Cada vez es mayor el número de extranjeros residentes en España que acuden a los centros hospitalarios y, por esta razón, la incidencia de patologı́as hasta ahora poco comunes en nuestro medio demanda que el profesional realice un análisis clı́nico más amplio e incluya en el diagnóstico diferencial enfermedades que previamente, por sus caracterı́sticas epidemiológicas, podı́an ser descartadas o consideradas poco probables. 4. Ruano-Ravina A, Jato-Dı́az M, Cerda-Mota T. Cribado neonatal de hemoglobinopatı́as. Una reflexión sobre su aplicación en Espana. Med Clin (Barc). 2006;126:337–40. 5. Dulı́n-Iñiguez E, Cantalejo-López M, Cela-de-Julián M, Galarón-Garcı́a P. Detección precoz neonatal de anemia falciforme y otras hemoglobinopatı́as en la comunidad autónoma de Madrid. Estudio piloto. An Pediatr (Barc). 2003;58: 146–55. 6. Corral-Ansa L, Herrero-Meseguer JI, Falip-Centellas M, Aiguabella-Macau M. Status epilepticus. Med Intensiva. 2008;32:174–82. 7. Ohene-Frempong K, Weiner SJ, Sleeper LA, Miller ST, Embury S, Moohr JW, et al. Cerebrovascular accidents in sickle cell disease: rates and risk factors. Blood. 1998;91:288–94. Bibliografı́a Hernan Aguirre-Bermeo*, Juan Millón, Alejandro Martı́nez-Domeño y Luis Marruecos-Sant 1. De Montalembert M. Management of sickle cell disease. BMJ. 2008;337:a1397. 2. Neonato MG, Guilloud-Bataille M, Beauvais P, Begue P, Belloy M, Benkerrou M, et al. Acute clinical events in 299 homozygous sickle cell patients living in France. French Study Group on Sickle Cell Disease. Eur J Haematol. 2000;65:155–64. 3. Ballas SK. Pain management of sickle cell disease. Hematol Oncol Clin North Am. 2005;19:785–802. doi:10.1016/j.medcli.2010.12.015 Servicio de Medicina Intensiva, Hospital de la Santa Creu i Sant Pau, Barcelona, España * Autor para correspondencia. Correo electrónico: haguirre@santpau.cat (H. Aguirre-Bermeo).