DEGRADACIÓN DE PROTEÍNAS Y Á AMINOÁCIDOS
Anuncio
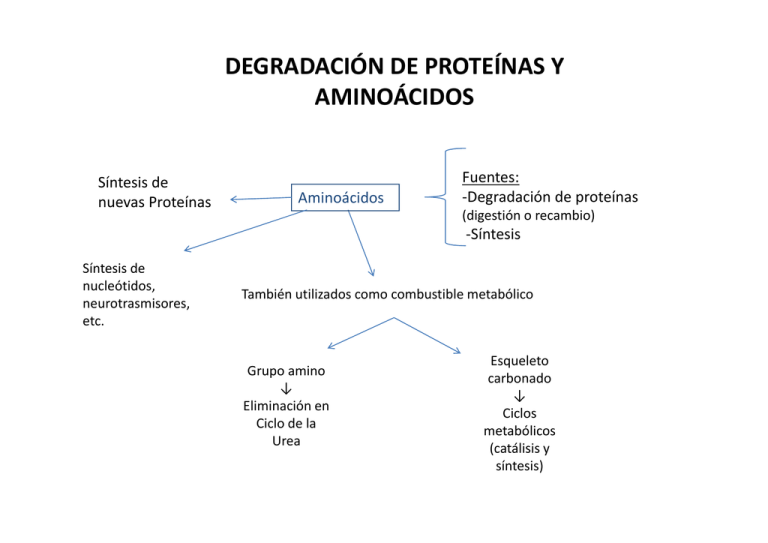
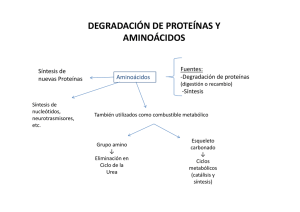
DEGRADACIÓN DE PROTEÍNAS Y AMINOÁCIDOS Á Síntesis de nuevas Proteínas Aminoácidos Fuentes: ‐Degradación de proteínas (digestión o recambio) ‐Síntesis Síntesis de Síntesis de nucleótidos, neurotrasmisores, etc. También utilizados como combustible metabólico Grupo amino ↓ Eliminación en Ciclo de la Urea Esqueleto carbonado ↓ Ciclos metabólicos (catálisis y síntesis) DIGESTIÓN DE PROTEÍNAS INGERIDAS POR LA DIETA Estómago e Intestino RECAMBIO DE PROTEINAS ‐ Detección y eliminación de proteínas dañadas o innecesarias ‐La ubiquitina (UBQT) marca a las proteínas a degradarse La ubiquitina (UBQT) marca a las proteínas a degradarse ‐ Glicina terminal (extremo COO‐) de la UBQT se une a grupos amino laterales de lisinas de la proteina a marcarse (gasto de ATP) ‐ Esta unión isopeptídica requiere 3 enzimas: E1: Enzima activadora de UBQT, el carboxilo terminal de UBQT se une a un grupo sulfhidrilo de la E1 previa interacción con un AMP proveniente de hidrólisis de ATP (activación). (activación) E2: Enzima conjugante de UBQT, luego del paso anterior la UBQT se une a la E2 liberando E1. E3: Ligasa ubiquitina‐proteína, cataliza la transferencia de la UBQT desde E2 al grupo amino lateral de la proteína diana. Proteasoma ‐Complejo proteico (26S) responsable de la hidrólisis de proteínas marcadas con UBQT ‐2 Componentes: a) 20S o Catalítico: 28 subunidades distribuidas en 4 anillos formando un barril → 2 anillos α ext. y 2 β int. Los β llevan los extremos N terminal de sus subunidades con treonina o serina (grupo OH lateral) que atacan los enlaces peptídicos. Libera péptidos é d de d 7‐9 aminoácidos. á d a) 19S o Regulador: reconoce prot. marcadas y las introduce al barril catalizador para su hidrólisis liberando UBQT. Dependiente de ATP. Lo que determina que una proteína sea marcada para su destrucción es principalmente el aminoácido amino terminal (regla del N terminal). Por ej. metionina define una vida media mucho mayor que arginina. La E3 es la responsable de la lectura N terminal. terminal DEGRADACIÓN DE AMINOÁCIDOS - Se lleva a cabo en 2 pasos principales: 1- liberación del grupo amino y, 2- incorporación a alguna vía de producción de energía (ver Destino de átomos de C de aminoácidos). - 1- La aminotransferasa (transaminasa) cataliza la transferencia del grupo amino de un α-aminoácido a un α-cetoácido (α-cetoglutarato para la formación de glutamato): transaminación. El grupo amino ahora en el glutamato se elimina como amonio por desaminación oxidativa por acción de la glutamato deshidrogenasa con utilización de NAD+ o NADP+ y formando una base de Schiff intermediaria: desaminación. Las Aminotransferasas o transaminasas usan piridoxal fosfato (PLP) como grupo prostético. Este es básicamente una piridina con una función aldehido la cual es capaz de unir grupos amino de aminoácidos, separarlos y transferirlos a un cetoácido. Aunque la mayoría de los aminoácidos transfieren los átomos de N al α-cetoglutarato, la serina y la treonina pueden formar directamente NH4 por medio de la serina deshidratasa o la treonina deshidratasa. deshidratasa En los órganos diferentes al hígado, el N a ser eliminado pasa de g glutamato a alanina p para ser transportado p al hígado g donde pasa de nuevo a glutamato CICLO DE LA UREA La mayoría de los vertebrados terrestres elimina el amonio proveniente de la degradación de aminoácidos como urea. urea Organismos: -Urotélicos: eliminan amonio como urea. -Amonotélicos: Amonotélicos: eliminan directamente amonio al medio acuoso (peces) -Uricotélicos: lo eliminan como ácido úrico (aves) P Pasos d l ciclo: del i l 1- Formación de carbamil fosfato entre NH4+ y HCO3- por acción de la carbamil fosfato sintetasa y la utilización de ATP 2- Reacción entre el carbamil fosfato y ornitina para dar citrulina (ornitina t transcarbamilasa) b il ) 3- Unión de citrulina con aspartato en el citoplasma para dar argininsuccinato (argininsuccinato sintetasa) con ruptura de ATP. 4- Escisión de argininsuccinato en arginina y fumarato 5- Hidrólisis de la arginina en urea (eliminación) y ornitina (sigue el ciclo) Ciclo de la Urea DESTINO DE LOS ÁTOMOS DE CARBONO DE AMINOÁCIDOS DEGRADADOS •Objetivo: Objetivo: transformación en intermediarios para i) producir glucosa, glucosa ác. ác grasos o cuerpos cetónicos , u ii) oxidarse en C. de Krebs para producir energía. •Los 20 aminoácidos se transforman en 7 moléculas: acetil-CoA, acetoacetil CoA, piruvato, α-cetoglutarato, succinil-CoA, fumarato y oxalacetato. Los que forman las 2 primeras son cetogénicos (generan ( cuerpos cetónicos o ác. grasos)) y los que generan las demás son glucogénicos (generan glucosa). BIOSÍNTESIS DE AMINOÁCIDOS FIJACIÓN DE NITRÓGENO •El N de aminoácidos, purinas, pirimidinas y otras moléculas tiene su origen en el Nitrógeno atmosférico. •La fijación de N es el proceso por el cual se transforma N2 en NH3 •Sólo algunas bacterias son capaces de la fijación de N, y también se puede producir por algunos procesos artificiales. •Proceso Biológico: -Interviene el complejo nitrogenasa formado por 2 proteínas: reductasa (aporta electrones) y nitrogenasa (utiliza los electrones para reducir N2 a NH3) -En la reducción biológica intervienen 8 electrones -Los 8 e- proceden de la ferredoxina reducida -Por cada e- transferido se hidrolizan 2 ATP N2 + 8e- + 8H+ + 16 ATP + 16 H2O 2 NH3 + H2 + 16 ADP + 16 Pi El componente reductasa transfiere los e- desde la ferredoxina reducida al componente nitrogenasa. La energía de la hidrólisis de ATP se utiliza para el cambio conformacional que acerca ambos componentes y transferir los e- al lugar donde se reducirá el N2. INCORPORACIÓN DE AMONIO A BIOMOLÉCULAS -Se incorpora a aminoácidos a través de glutamato y glutamina -El grupo α-amino de la mayoria de los aminoácidos proviene de transaminación de glutamato -Glutamina aporta el nitrogeno de su cadena lateral para síntesis de compuestos como triptofano e histidina. histidina -El glutamato se forma por la unión de NH4 con α-cetoglutarato catalizada por la glutamato deshidrogenasa. Es la reacción inversa a la de degradación, en este caso con consumo de NADH o NADPH y con la formación de una base de Schiff intermediaria Una 2da molécula de NH3 puede incorporarse al glutamato para formar glutamina por acción de la glutamina sintetasa SÍNTESIS DE LOS ESQUELETOS CARBONADOS DE LOS AMINOÁCIDOS •Los esqueletos carbonados provienen de intermediarios de la glucólisis, de la vía de las pentosas fosfato o del ácido cítrico Esencial No esencial Precursor de otro aminoácido •Los aminoácidos se clasifican en no esenciales i l o esenciales i l según la capacidad o no de ser sintetizados por el ser humano, respectivamente. •Los microorganismos en gral pueden sintetizar los 20. •Los aminoácidos no esenciales requieren simples etapas para su síntesis mientras que los no esenciales necesitan it etapas t más á complejas l j que involucran más pasos. Síntesis de glutamato, aspartato y alanina •El glutamato se forma por aminación reductiva del α-cetoglutarato (glutamato deshidrogenasa) •El El grupo amina del glutamato puede transferirse a otros α α-cetoácidos cetoácidos como el piruvato y el oxalacetato para dar alanina y aspartato, respectivamente. oxalacetato + glutamato Piruvato + glutamato aspartato + α-cetoglutarato alanina + α-cetoglutarato •Estas Estas reacciones son catalizadas por transaminasas asociadas a piridoxal fosfato (como se muestra en la degradación de aminoácidos) Síntesis de Asparragina: p g se forma a p partir de aspartato p con activación e hidrólisis de ATP, siendo el N aportado por el NH3 en bacterias o por la glutamina en mamíferos. Reacción similar a la síntesis de glutamina a partir de glutamato. Síntesis de glutamina, prolina y arginina Todas se forman a partir de glutamato: •Glutamina: se forma por activación con ATP e incorporación de otro grupo amino •Prolina y Arginina: El grupo carboxilo lateral (γ) del glutamato reacciona con ATP y NADPH para dar: a) un semialdehido glutámico que por pérdida de H2O forma un compuesto cíclico precursor de la prolina o, o b) ornitina, ornitina por transaminación con otra molécula de glutamato, la cual formará arginina siguiendo el ciclo de la urea. Síntesis de Serina y Glicina •Serina: se forma a partir de 3-fosfoglicerato por oxidación con NAD+ y transaminación con glutamato •Glicina: se sintetiza por transferencia del grupo metileno lateral de la serina al tetrahidrofolato (un transportador de fragmentos monocarbonados) monocarbonados). Síntesis de Cisteína Se forma a partir de la unión de la homocisteína, precursor de la metionina, con serina para dar cistationina que por desaminación da α-cetobutirato y cisteína. La homocisteína proviene del ciclo de los metilos activados donde se intercambian metilos entre S-adenosil metionina, homocisteína y metionina Síntesis de aminoácidos aromáticos: Fenilalanina, Tirosina y Triptofano • Se condensan fosfoenol piruvato (de Glucólisis) y eritrosa 4-fosfato (de C. de las Pentosas) para dar un azúcar abierta de 7 C que se oxida y vuelve cíclica. Luego se deshidrata y reduce para formar Siquimato el cual forma Corismato por condensación de otro fosfoenol piruvato •El El Corismato es el precursor común de los tres aminoácidos •La tirosina puede formarse a partir de Corismato o por hidroxilación de fenilalanina Triptofano Fenilalanina Tirosina GLIFOSATO (Roundup): •Herbicida de amplio espectro que inhibe a la enz. responsable de la formación del precursor de corismato, el 5-enolpiruvil-siquimato-3-fosfato. •Esta enzima, la 5-enolpiruvil-siquiimato-3-fosfato sintasa (EPSPS), al estar presente sólo en plantas hace teóricamente inocuo al herbicida para los animales. •De todos modos, su utilización debe ser moderada y vigilada ya que por ser un producto químico puede actuar sobre otros mecanismos aún no bien explorados •Estudios recientes lo predisponen como capaz de provocar "trastornos intestinales y cardíacos, malformaciones y alteraciones neuronales“. Modo de acción: •El glifosato actúa como un inhibidor competitivo del Fosfoenol piruvato (PEP) y se combina mas fuertemente al complejo EPSP sintasa-Siquimato-3-fosfato (S3P) de lo que lo hace PEP (el sustrato natural). ) •Sin embargo, al igual que el PEP, el glifosato no presenta afinidad por la enzima aislada; es decir, PEP o glifosato no se combinan con EPSP sintasa sino al complejo EPSP sintasa-S3P. sintasa, sintasa S3P •Una gran diferencia entre PEP y glifosato es que la tasa de disociación del complejo EPSP sintasa-S3P-glifosato es 2300 veces mas lenta que la tasa de disociación de EPSP sintasa-S3P-PEP. Debido a esto, una vez que el glifosato se combina con el complejo EPSP sintasa-S3P la enzima es virtualmente inactivada