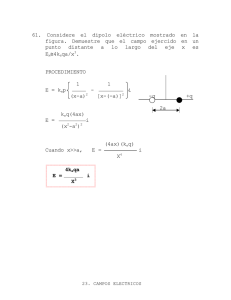
Ejercicios Tema 8
Anuncio

Química I PRÁCTICO DE TEMA 8 Equilibrio Químico Concepto de equilibrio y expresión de la constante de equilibrio 1. Explique lo que tienen de incorrecto los enunciados siguientes: (a) En el equilibrio ya no se transforman reactivos en productos. (b) En el equilibrio la constante de velocidad de la reacción directa es igual a la de la reacción inversa. (c) En el equilibrio hay cantidades iguales de reactivos y productos. 2. Escriba la expresión de la Keq de las reacciones siguientes. Indique en cada caso si la reacción es homogénea o heterogénea. (a) 3 NO (g) ⇌N2O (g) + NO2 (g) (b) CH4 (g) + 2H2S (g) ⇌CS2 (g) + 4 H2 (g) (c) Ni(CO)4 (g) ⇌Ni (s) + 4 CO (g) (d) HF (ac) ⇌ H+(ac) + F‐ (ac) (e) 2 Ag (s) + Zn2+ (ac)⇌ 2Ag+ (ac) + Zn (s) 3. Escriba la expresión de la Keq de las reacciones siguientes. Indique en cada caso si la reacción es homogénea o heterogénea. (a) N2 (g) + O2 (g) ⇌ 2 NO(g) (b) 2 C2H4 (g) + 2H2O (g) ⇌ 2 C2H6 (g) + O2(g) (c) Co (s) + 2H+ (ac) ⇌ Co2+ (ac) + H2 (g) (d) NH3 (ac) + H2O (l) ⇌ NH4+ (ac) + OH‐ (ac) 4. Cuando las reacciones siguientes alcanzan el equilibrio, ¿qué contiene principalmente la mezcla de equilibrio: reactivos o productos? (a) N2 (g) + O2 (g) ⇌2 NO (g); Keq = 1.5 x 10‐10 (b) 2 SO2 (g) + O2 (g) ⇌2 SO3 (g); Keq = 2.5 x 10 9 5. La constante de equilibrio de la reacción: 2 SO3 (g) ⇌2 SO2(g) + O2(g) es Keq = 2.4 x 10 ‐3 a 200°C. (a) Calcule Keq de 2 SO2 (g) + O2 (g) ⇌2 SO3 (g). (b) A esta temperatura, ¿favorece el equilibrio el SO2 y el O2, o el SO3? 6. El óxido de mercurio (I) se descompone en mercurio y oxígeno elementales: 2 Hg2O (s) ⇌ 4 Hg (l) + O2 (g). (a) Escriba una expresión de Keq que incluya todos los reactivos y productos. (b) Explique por qué normalmente se excluyen los sólidos y líquidos puros de las expresiones de constantes de equilibrio. 1 (c) Escriba una expresión de Keq que excluya el sólido y el líquido puros de la expresión de equilibrio. Cálculo de constantes de equilibrio 7. Se pone yoduro de hidrógeno gaseoso en un recipiente cerrado a 425°C, donde se descompone parcialmente en hidrógeno y yodo: 2 HI (g) ⇌ H2(g) + I2(g). En el equilibrio se encuentra que PHI = 0.202 atm, PH2 = 0.0274 atm, y PI2 = 0.0274 atm. ¿Cuál es el valor de Keq a esta temperatura? 8. El metanol (CH3OH) se produce en escala comercial mediante la reacción catalizada de monóxido de carbono e hidrógeno: CO (g) + 2H2(g)⇌ CH3OH(g). Se encuentra que una mezcla de equilibrio en un recipiente de 2.00 L ,contiene 0.0406 mol de CH3OH, 0.170 mol de CO y 0.302 mol de H2 a 500 K. Calcule Keq a esta temperatura. 9. Se coloca una mezcla de 0.10 mol de NO, 0.050 mol de H2 y 0.10 mol de H2O en un recipiente de 1.0 L a 300 K. Se establece el equilibrio siguiente: 2 NO (g) + 2H2 (g) ⇌ N2 (g)+ 2 H2O (g). En el equilibrio PNO =1.53 atm. a) Calcule las presiones parciales en el equilibrio de H2, N2 y H2O. b) Calcule Keq 10. (a) ¿En que difiere un cociente de reacción de una constante de equilibrio? (b) Si Q < Keq, en qué sentido avanzará la reacción para alcanzar el equilibrio? (c) ¿Qué condición se debe satisfacer para Q=Keq ? 11. A 100°C la constante de equilibrio de la reacción: COCl2 (g) ⇌ CO(g) + Cl2(g) tiene un valor de Keq = 6.71 x10‐9. ¿Están en equilibrio las siguientes mezclas de COCl2 , CO y Cl2 a 100°C?. (a) PCOCl2= 6.12 x 10‐2 atm, PCO= 1.01 x 10‐4 atm, PCl2 2.03x10‐4 atm; (b) PCOCl2= 1.38 atm, PCO= 3.37 x 10‐6atm, PCl2= 6.89 x10‐5atm, (c) PCOCl2= 3.06 x 10‐1 atm, PCO= PCl2= 4.53x10‐5atm. De no ser así, indique el sentido en el que se debe llevar a cabo la reacción para alcanzar el equilibrio. 12. A 900 K la reacción siguiente tiene una Keq = 0.345: 2 SO2(g) + O2(g) ⇌ 2SO3(g) En una mezcla de equilibrio las presiones parciales de SO2 y O2 son de 0.165 atm y 0.755 atm respectivamente. ¿Cuál es la presión parcial de equilibrio de SO3 en la mezcla? 13. En el equilibrio: Br2(g) + Cl2(g) ⇌ 2BrCl (g) a 400 K, Keq =7.0. Si se introducen 0.30 mol de Br2 y 0.30 mol de Cl2 en un recipiente de 1.0 L a 400 K, ¿cuál será la presión parcial de equilibrio de BrCl? 14. A 25°C la reacción CaCrO4 (s) ⇌ Ca2+ (ac) + CrO42‐ (ac), tiene una constante de equilibrio Keq = 7.1x10‐4. ¿Cuáles son las concentraciones de equilibrio de Ca+2 y CrO4‐2 en una disolución saturada de CaCrO4? 2 15. 16. 17. 18. Le Châtelier Considere el equilibrio que sigue: 2 SO2(g) + O2(g) ⇌ 2 SO3(g), en el cual ΔH < 0, ¿Cómo afectará cada uno de los cambios siguientes a una mezcla de equilibrio de los tres gases? (a) Se agrega O2(g) al sistema; (b) se calienta la mezcla de reacción; (c) se duplica el volumen de reacción del recipiente ; (d) se agrega un catalizador a la mezcla; (e) se aumenta la presión total del sistema agregando un gas noble; (f) se extrae SO3(g) del sistema. ¿Cómo influyen los cambios siguientes en el valor de la constante de equilibrio de una reacción exotérmica en fase gaseosa? (a) Quitar un reactivo o producto; (b) reducir el volumen; (c) disminuir la temperatura; (d) agregar un catalizador. Indicar que efecto producirá una disminución de presión sobre los siguientes sistemas en equilibrio: a) I2 (g) + H2 (g) ⇌ 2 HI (g) b) N2 (g) + 3 H2 (g) ⇌ 2NH3 (g) Considérese el equilibrio siguiente: N2O4 (g) ⇌ 2NO2(g) ; ΔH° = 58.0 kJ ¿En qué sentido se desplazará el equilibrio al efectuar los cambios siguientes a un sistema en equilibrio? (a) Agregar N2O4; (b) extraer NO; (c) aumentar la presión total agregando N2(g); (d) aumentar el volumen; (e) reducir la temperatura. 3