TRIS, ácido acético, EDTA
Anuncio

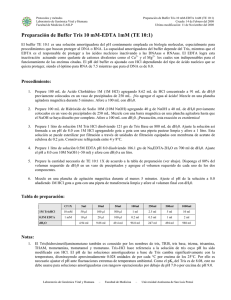
Protocolos y métodos Laboratorio de Genómica Viral y Humana Facultad de Medicina UASLP Preparación de TAE y TBE Creado: 14 de Febrero del 2008 Ultima modificación: 11 de Noviembre del 2008 Preparación de Buffer Tris, Acido acético, EDTA (TAE) y Tris, Acido bórico, EDTA (TBE). El TAE es el buffer más comúnmente empleado para la separación de fragmentos de DNA por electroforésis. Sus aplicaciones electroforéticas incluyen al análisis de productos de PCR, protocolos de purificación de DNA y experimentos de clonación de DNA. Este buffer posee una fuerza iónica baja al igual que una pobre capacidad de amortiguación de pH. El TAE constituye la mejor alternativa (en comparación al TBE) para el análisis electroforético de fragmentos grandes (> 20 kb) de DNA. Una de las desventajas del TAE como buffer de electroforesis es que no permite reciclarlo por más de tres corridas electroforéticas seguidas, a diferencia del TBE cuya efectividad permanece inalterada durante 3 o 4 días, sin importar el número de corridas electroforéticas realizadas. El empleo del TBE como buffer de electroforesis es particularmente útil para discriminar a pequeños fragmentos de DNA (<500 bp) en geles de agarosa (en comparación al TAE). En términos generales los fragmentos grandes (>20 kbp) de DNA tienden a migrar más rápido en el TAE que en el TBE, mientras que los fragmentos pequeños (<300 bp) migran más rápido en el TBE que en el TAE. Esta capacidad discriminatoria ha llevado a establecer parámetros optimizados para la discriminación de fragmentos en base a su tamaño. Así pues, la mejor discriminación de fragmentos de entre 100 y 500 bp de DNA se logra con geles de agarosa al 2% empleando TBE como buffer, mientras que los fragmentos de entre 900 y 2000 bp son mejor separados con geles de agarosa al 0.8% empleando TAE como buffer de electroforesis. Procedimiento: 1. Prepare 100 mL de Acido Clorhídrico 1M (1M HCl) agregando 8.62 mL de HCl concentrado a 91 mL de dH20 previamente colocados en un vaso de precipitados de 250 mL. ¡No agregar el agua al ácido! Mezcle en una plancha agitadora magnética durante 5 minutos. Afore a 100 mL con dH20. 2. Prepare 100 mL de Hidróxido de Sodio 10M (10M NaOH) agregando 40 g de NaOH a 40 mL de dH20 previamente colocados en un vaso de precipitados de 250 mL. Mezcle con una barra magnética en una plancha agitadora hasta que el NaOH se haya disuelto por completo. Afore a 100 mL con dH20. ¡Precaución, esta reacción es exotérmica! 3. Para TBE, prepare 0.5 M EDTA pH 8.0 disolviendo 186.1 g de Na2EDTA-2H2O en 700 ml de dH20, ajustando el pH a 8.0 (de lo contrario no será posible disolver al EDTA) por medio de 10 M NaOH (~50 ml) , afore a 1 L con dH20. 4. Añada las sales a un vaso de precipitados adecuado para el volumen de la solución por preparar. De acuerdo a la Tabla de Preparación mostrada a continuación. 5. Añada el 80% del volumen de dH20 requerido y mezcle encima del agitador magnético hasta diluir las sales. 6. En el caso de soluciones TAE 1X, ajuste el pH a 7.6 con 1M HCl o 10M NaOH (según sea necesario) empleando para ello una pipeta de transferencia de plástico limpia (ver nota #2). Monitoree continuamente el pH con el potenciómetro mientras se añaden las soluciones de HCl o NaOH gota a gota. 7. Afore la solución con dH20 al volumen final requerido. 8. Almacene a temperatura ambiente. 9. Para preparar una solución 1X, mezcle 1 volumen de TBE/TAE 10X con 9 volúmenes de agua y agítese bien. Laboratorio de Genómica Viral y Humana – Facultad de Medicina – Universidad Autónoma de San Luis Potosí Protocolos y métodos Laboratorio de Genómica Viral y Humana Facultad de Medicina UASLP Preparación de TAE y TBE Creado: 14 de Febrero del 2008 Ultima modificación: 11 de Noviembre del 2008 Tabla de preparación (TAE): TAE 10X Tris Acido Acético Cf (1X) 1L 10 L 20 L 40 mM 48.4 g 484 g 968 g — Na2EDTA-2H2O 2 mM dH2O — 11.42 ml 114.2 ml 228.4 ml 7.44 g 74.4 g 148.8 g cbp 1 L cbp 10 L cbp 20 L Tabla de preparación (TBE): TBE 10X Cf (1X) 1L 10 L 20 L Tris 89 mM 108 g 1.08 kg 2.16 kg Acido Bórico 89 mM 55 g 550 g 1.1 kg 0.5 M EDTA, pH 8 2 mM 40 ml 400 ml 800 ml — cbp 1 L cbp 10 L cbp 20 L dH2O Notas: 1. Limpie perfectamente bien la balanza con la brocha para evitar el acarreo de contaminantes y la corrosión de la balanza o de las superficies de acero inoxidable. 2. El Tris(hidroximetil)aminometano también es conocido por los nombres de tris, TRIS, tris base, trizma, trisamina, THAM, trometamina, trometamol y trometano. Tris-HCl hace referencia a la solución de tris cuyo pH ha sido manipulado o modificado con HCl. El pH de las soluciones amortiguadoras a base de Tris cambia significativamente con la temperatura, disminuyendo aproximadamente 0.028 unidades de por cada °C por encima de 25°C. Por ello es necesario ajustar el pH ante fluctuaciones extremas de temperatura operacional. Como el pKa del Tris es de 8.08, este no debe usarse para soluciones amortiguadoras con rangos operacionales por debajo de pH 7.0 o por encima de pH 9.0. 3. Las soluciones 10X de TAE poseen un pH ~8.5 que se corrige automáticamente a pH 7.5 una vez llevadas a 1X. Por ello en el caso de las soluciones 10X, no es necesario ajustar el pH. 4. La vida media de anaquel para soluciones 1X o 10X de TAE y TBE oscila entre 6 y 24 meses a temperatura ambiente. Referencias: 1. 2. Current Protocols in Molecular Biology, Appendix 2, A.2.5, Supplement 40, Frederick M. Ausubel et al. 2003. TBE, or not TBE; that is the question: Beneficial usage of tris-borate for obtaining a higher resolution of small DNA fragments by agarose gel electrophoresis. Yutaka Miura et al, Nagoya Medical Journal 43(1) 1-6, 1999. Laboratorio de Genómica Viral y Humana – Facultad de Medicina – Universidad Autónoma de San Luis Potosí