Equilibrio de solubilidad
Anuncio

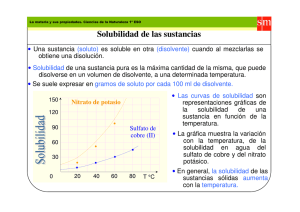
Equilibrio de solubilidad Objetivo: Calcular el producto de solubilidad de una sal, conociendo su solubilidad y viceversa La solubilidad es un fenómeno muy importante. Consideremos los siguientes ejemplos: - El azúcar o la sal se disuelven en agua para dar sabor a las comidas - El sulfato de calcio es menos soluble en agua caliente que en agua fría, por lo tanto se usa en recubrimientos para tuberías de calentadores. - Los alimentos que quedan entre los dientes forman ácidos que disuelven el esmalte dental que contiene Hidroxiapatita, Ca10(PO4)6(OH)2, con el fluor de la pasta dental, se forma Ca5(PO4)3F y Ca2F, los que son menos solubles en los ácidos. Consideraremos el equilibrio de disoluciones de sólidos para formar soluciones acuosas. Cuando un sólido iónico se disuelve en agua, disocia 100% en aniones y cationes, por ejemplo la fluorita : 2 O( l ) CaF2( s ) H → Ca 2+ (ac) + 2F − (ac) Al principio no hay iones disueltos, pero a medida que aumenta la disociación, la concentración de cada ion aumenta y hay mayor probabilidad de que choquen y vuelvan a formar el compuesto original: Ca 2+ ( ac) + 2F − ( ac) → CaF2 ( s ) CaF2 ( s ) ← → Ca 2+ + 2 F − ( ac ) así se alcanza el equilibrio: en ese momento , ya no se disuelve más sólido y se dice que la solución está saturada. La expresión para el equilibrio de esta reaccion K = [Ca 2+ ] [F − ]2 es:donde las concentraciones son en ps mol/L, la K se denomina producto de solubilidad. Esta constante no incluye el sólido puro, ya que este no influye en la cantidad de iones disociados, pues el exceso de sólido se precipita. Ejemplos: Escriba la ecuación balanceada que describe la disolución de los siguientes sólidos en agua, escriba también el producto de solubilidad Kps, para los siguientes compuestos: PbCl2 ( s ) Ag 2 CrO 4 ( s ) Bi 2 S 3 ( s ) Solucion: Ejercicios: haga lo mismo para : BaSO4(s), Ag 3PO4(s), Fe(OH)3(s). [ ][ ] Ag CrO ( s ) ← → 2 Ag ( ac ) + CrO ( ac ); K = [Ag ] [CrO ] Bi S ( s ) ← → 2 Bi ( ac ) + 3S ( ac ); K = [Bi ] [S ] PbCl2 ( s ) ← → Pb 2 + ( ac ) + 2Cl − ( ac ); K ps = Pb 2 + Cl − 4 4 3+ 2 + 2 2− + 2 ps 3+ 2 2− 3 2 2− 4 2− 3 ps Calculo del producto de solubilidad: El bromuro de cobre (I), CuBr, tiene un producto de solubilidad de 2.0x10-4 moles por litro a 25°c. Es decir, cuando se coloca exceso de CuBr(s) en un litro de agua, es posible determinar que se disuelven 2.0x10-4 moles del sólido para producir una solución saturada. Calcule el valor de Kps del sólido. Solucion: Cuando el CuBr entra en contacto con el agua, este se disuelve para formar iones Cu+ y Br-: CuBr ( s ) ← → Cu + (ac ) + Br − ( ac ) donde [ ][ ] Kps = Cu + Br − por lo tanto es posible calcular el valor de Kps, si se conocen las concentraciones de los iones en equilibrio. Se sabe que la solubilidad de CuBr es de 2.0x10-4 moles /L, esto significa que para alcanzar el equilibrio se disuelven 2.0x10-4 moles de CuBr sólido. Así pues, en equilibrio las concentraciones respectivas dada la estequiometría de la reacción son: 2.0x10-4 CuBr producen 2.0x10-4 Cu+ y 2.0x10-4 Br[Cu+]= 2.0x10-4 [Br-]= 2.0x10-4 por lo tanto: Kps=[Cu+][Br-]=(2.0x10-4)( 2.0x10-4)=4.0x10-8 (se omiten las unidades de Kps) Ejercicio: Calcular el valor de Kps para el sulfato de bario BaSO4, que tiene una solubilidad de 3.9x10-5 M a 25°C. Se ha visto que la solubilidad sirve para calcular el Kps de un sólido, pues también es posible hacer el proceso contrario. Ejemplo: El valor de Kps para el sólido AgI(s) es 1.5x10-16 a 25°C, calcular la solubilidad de AgI en agua a 25°C. Solucion: El AgI se disuelve segun la ecuación: AgI ( s) ← → Ag + (ac) + I − (ac) [ ][ ] cuya expresion de equilibrio es : Kps = 1.5 x10 −6 = Ag + I − como no conocemos la solubilidad del sólido, se supone que se disuelven x moles de sólido así la estequiometria de la reacción queda: xAgI ( s ) → xAg + + xI − en el equilibrio : [Ag +]=x y [I-]=x así pues: Kps=1.05x10-16=[Ag +][I-]=(x)(x)=x2 x=√ √ (1.5x10-16)=1.2x10-8 moles /L La solubilidad del AgI es 1.2x10-8 moles /L. Ejercicio: el Kps del cromato de plomo(III) PbCrO 4 es 2.0x10-16 a 25°C, Calcule su solubilidad a 25°C EFECTO D E LA HIDRÓLISIS SOBRE EN LA SOLUBILIDAD La hidrólisis reduce la concentración de los aniones de ácidos débiles, de modo que su efecto se debe tener en cuenta en el calculo de la solubilidad. El efecto del ión común en la solubilidad La solubilidad de un compuesto es menor en una disolución que tiene un ión común del compuesto que en agua pura. El coeficiente de reacción en las reacciones de precipitación El coeficiente de reacción Qps o producto de las concentraciones molares ayuda a conocer las concentraciones máximas de los iones que pueden coexistir en la disolución y define si se precipitará la disolución. Si Qps < Kps No exite precipitación y se puede disolver el sólido Si Qps = Kps La solución esta saturada no hay reacciones favorecidas Si Qps > Kps Existe precipitación La precipitación fraccionada Cuando existen aniones con propiedades similares al tener un ion común se precintarán de acuerdo a sus constantes del producto de solubilidad Por ejemplo: Compuesto AgCl AgBr Ag I Kps 1,8 x 10 -10 3,3 x 10 –13 1,5 x 10 –16 El Ag I es el menos soluble por lo tanto precipita primero por que le ión I– es mas grande y mas polarizable que los iones de bromuro y cloruro. Entonces estos tres especies al recibir iones de plata precipitaran fraccionadamente de acuerdo a su Kps.