Estructura y propiedades de las proteínas
Anuncio

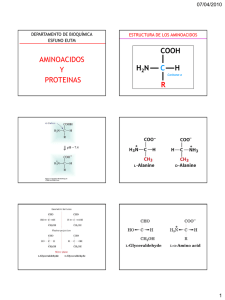
Estructura y propiedades de las proteínas Matilde Julián Seguí Índice ● Introducción ● Aminoácidos ● Enlace peptídico ● Estructura primaria ● Estructura secundaria ● Estructura terciaria ● Estructura cuaternaria Introducción ● ● Expresión de la información genética. Gran variedad de funciones en los seres vivos Aminoácidos ● ● Moléculas orgánicas con grupo amino (NH2) y grupo carboxilo (COOH). Unidades fundamentales de las proteínas: aminoácidos α. Aminoácido α: grupos amino y carboxilo unidos a un mismo C. ●R: cadena lateral. ●Determina las propiedades del aminoácido. ●20 aminoácidos forman todas las proteínas ● Aminoácidos ● ● Los aminoácidos se clasifican según las propiedades de su cadena R En disolución, un aminoácido puede actuar como ácido (cede un protón) o como base (capta un protón) Enlace peptídico ● Unión entre aminoácidos ● Enlace covalente ● ● Se forma por reacción del grupo amino de un aminoácido y el carboxilo del siguiente Forman estructuras lineales (péptidos) Enlace peptídico ● Formación: condensación ● Ruptura: hidrólisis Enlace peptídico ● ● Conformación: disposición espacial de los átomos. Restricción: Todos los átomos unidos al C y N del enlace están en el mismo plano y mantienen distancias y ángulos carácterísticos. Enlace peptídico ● ● Péptidos: – Oligopéptidos – Polipéptidos – Proteínas Proteínas: varios niveles de estructura. – Primaria – Secundaria – Terciaria – Cuaternaria Estructura primaria ● ● ● Secuencia de aminoácidos Determina las demás características y la función de la proteína Residuo: cada uno de los aminoácidos que la forman – Se nombran desde el extremo amino hacia el carboxilo Estructura secundaria ● ● ● Organización espacial de una parte de la proteína Se mantiene por interacciones entre los aminoácidos que la forman: puentes de hidrógeno – Hélice α – Lámina β Puente de hidrógeno: se comparte un protón entre dos moléculas. Enlace débil. Estructura secundaria: hélice α ● ● ● ● Estructura helicoidal apretada Puentes de hidrógeno entre los residuos n y n+4 Cadenas R hacia el exterior Estabilidad por el gran número de interacciones Estructura secundaria: lámina β ● ● ● ● ● Láminas paralelas o antiparalelas Disposición en zig-zag, con giros Puede darse entre zonas alejadas Puentes de hidrógeno entre los residuos n y n+3 Las cadenas R sobresalen en ambos sentidos Estructura secundaria ● Representación – Hélices α : cintas en espiral – Láminas β : flechas paralelas o antiparalelas – Otras: líneas finas (random coil) Estructura terciaria ● Organización espacial de la proteína ● Determina su función ● ● ● Se forma por interacciones entre regiones de la proteína (dominios) No es inmediato. Primero se organizan las estructuras de los dominios Desnaturalización: pérdida de la estructura terciaria sin romper los enlaces peptídicos Estructura terciaria ● Dos tipos – Proteínas fibrosas – Proteínas globulares Estructura terciaria: proteínas fibrosas ● Forma de fibra o lámina ● No solubles en agua ● ● Repetición de estructuras secundarias simples Dan forma y protección a los organismos Estructura terciaria: proteínas globulares ● Solubles en agua ● Estructura terciaria compleja ● ● Residuos apolares (hidrófobos) en el interior, y residuos polares (hidrófilos) en el exterior Diversas funciones (enzimas, proteínas reguladoras, etc) Estructura cuaternaria ● ● Unión entre varias cadenas polipeptídicas para formar una proteína Protómero: cada una de las cadenas peptídicas Estructura cuaternaria