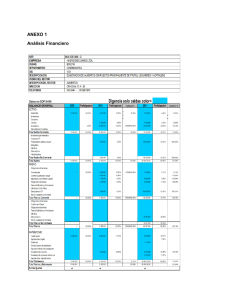
EFECTO DEL AGENTE CAUSAL DE LA MARCHITEZ VASCULAR
Anuncio

EFECTO DEL AGENTE CAUSAL DE LA MARCHITEZ VASCULAR DE LA UCHUVA (Physalis peruviana L.) EL HONGO Fusarium oxysporum SCHLECHT, SOBRE ALGUNAS SOLANÁCEAS Y OTRAS ESPECIES CULTIVADAS AFECTADAS POR FORMAS ESPECIALES DEL MICROORGANISMO HERNANDO ESTUPIÑÁN RODRÍGUEZ JULIANA ANDREA OSSA CANENCIO PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS CARRERA DE MICROBIOLOGÍA AGRÍCOLA Y VETERINARIA Bogotá, D.C Febrero, 07 de 2007 EFECTO DEL AGENTE CAUSAL DE LA MARCHITEZ VASCULAR DE LA UCHUVA (Physalis peruviana L.) EL HONGO Fusarium oxysporum SCHLECHT, SOBRE ALGUNAS SOLANÁCEAS Y OTRAS ESPECIES CULTIVADAS AFECTADAS POR FORMAS ESPECIALES DEL MICROORGANISMO HERNANDO ESTUPIÑÁN RODRÍGUEZ JULIANA ANDREA OSSA CANENCIO TRABAJO DE GRADO Presentado como requisito parcial para optar al título de MICROBIÓLOGO AGRÍCOLA Y VETERINARIO Director: Maria Clemencia Forero La-Rotta Ing. Agr. M. Sc. PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS CARRERA DE MICROBIOLOGÍA AGRÍCOLA Y VETERINARIA Bogotá, D.C Febrero, 07 de 2007 2 EFECTO DEL AGENTE CAUSAL DE LA MARCHITEZ VASCULAR DE LA UCHUVA (Physalis peruviana L.) EL HONGO Fusarium oxysporum SCHLECHT, SOBRE ALGUNAS SOLANÁCEAS Y OTRAS ESPECIES CULTIVADAS AFECTADAS POR FORMAS ESPECIALES DEL MICROORGANISMO HERNANDO ESTUPIÑÁN RODRÍGUEZ JULIANA ANDREA OSSA CANENCIO APROBADO Maria Clemencia Forero La-Rotta Ing. Agr. M. Sc. DIRECTOR ________________________ Luís David Gómez Méndez JURADO _______________________ Gerardo Moreno JURADO 3 EFECTO DEL AGENTE CAUSAL DE LA MARCHITEZ VASCULAR DE LA UCHUVA (Physalis peruviana L.) EL HONGO Fusarium oxysporum SCHLECHT, SOBRE ALGUNAS SOLANÁCEAS Y OTRAS ESPECIES CULTIVADAS AFECTADAS POR FORMAS ESPECIALES DEL MICROORGANISMO HERNANDO ESTUPIÑÁN RODRÍGUEZ JULIANA ANDREA OSSA CANENCIO APROBADO ________________________ Ángela Umaña Decana Académica Facultad de Ciencias ________________________ Luís David Gómez Méndez Director de Carrera Microbiología Facultad de Ciencias 4 “La Universidad no se hace responsable por los conceptos emitidos por sus alumnos en sus trabajos de tesis. Solo velará por que no se publique nada contrario al dogma y a la moral católica y por que las tesis no contengan ataques personales contra persona alguna, antes bien se vea en ellas el anhelo de buscar la verdad y la justicia”. (Artículo 23 de la Resolución N° 13 de Julio de 1946) 5 DEDICATORIA A Dios por la vida, Con especial amor a mis Abuelos y mi Mami por cada momento que han dedicado y por toda su entrega. Juliana. A Dios por permitirme llegar hasta acá, y especialmente a mi Madre a quien debo todo, por su esfuerzo y dedicación. Hernando. AGRADECIMIENTOS Los autores del presente trabajo, manifiestan sinceros agradecimientos a: La Pontificia Universidad Javeriana, por permitirnos adquirir conocimientos adecuados a lo largo de nuestra carrera y tener bases sólidas que nos brindaron las herramientas necesarias para culminar nuestro gran propósito. La Universidad Nacional de Colombia, por su entera colaboración a lo largo de la investigación. Dra. Maria Clemencia Forero La-Rotta, Directora del trabajo, quien con su generoso aporte de buena voluntad, conocimiento y dedicación contribuyo en la culminación exitosa de este gran proyecto Dr. Ricardo Tascón Director del área de Biología Molecular, Carval de Colombia, Laboratorio Animed; por sus aportes, por sus valiosas orientaciones, por su dedicación y apoyo incondicional. A Pablo Andrés, Camilo Andrés, Juan Camilo, Jéferson, Jaime y Guillermo asiduos colaboradores durante la realización de este trabajo. A nuestros padres, abuelos, hermanos, familiares y a cada una de las personas que hicieron posible la realización del presente trabajo; muchas gracias por contribuir en nuestra superación profesional y realización de sueños. Febrero, 07 de 2007 7 TABLA DE CONTENIDO Págs. 0. INTRODUCCIÓN…………………………………………………………..18 1. MARCO TEORICO……………………………………………………….. 20 1.1 FAMILIA DE LAS SOLANACEAS…………………………………..20 1.1.1 GENERALIDADES DE LA UCHUVA…………………………….20 1.1.2 ASPECTOS ECONÓMICOS DEL MERCADO………………….22 1.2 ENFERMEDAD: MARCHITEZ VASCULAR DE LA UCHUVA….24 1.3 GENERALIDADES DEL PATÓGENO……………………………...27 1.3.1 ECOLOGÍA Y EVOLUCIÓN DE F. oxysporum………………...28 1.3.2 FORMAS ESPECIALES DE F. oxysporum…………………….32 2. FORMULACIÓN DEL PROBLEMA Y JUSTIFICACIÓN……………..36 3. OBJETIVOS………………………………………………………………....38 3.1 OBJETIVO GENERAL ……………………………………………….38 3.2 OBJETIVOS ESPECIFICOS…………………………………………38 4. MATERIALES Y MÉTODOS……………………………………………..39 4.1 DISEÑO DE LA INVESTIGACIÓN…………………………………..39 4.2 POBLACIÓN DE ESTUDIO Y MUESTRA………………………….39 4.2.1VARIABLES DE ESTUDIO………………………………………...40 4.3 MÉTODOS……………………………………………………………...40 4.3.1OBTENCIÓN MATERIAL VEGETAL ENFERMO……………….40 4.3.2AISLAMIENTO DEL PATÓGENO………………………………...40 4.3.3 OBTENCIÓN DE LAS FORMAS ESPECIALES DEL MICROORGANISMO……………………………………………………...41 4.3.4IDENTIFICACION DEL PATÓGENO…………………………......41 4.3.5 PREPARACIÓN Y PRODUCCIÓN DEL INÓCULO…………....42 4.3.5.1 INCREMENTO INÓCULO POR AGITACIÓN…………………42 4.3.5.2 PREPARACIÓN DEL MEDIO DE CULTIVO…………………..42 4.3.5.3 INCREMENTO INÓCULO POR SIEMBRA DIRECTA……….43 8 4.3.5.4 CUANTIFICACIÓN NÓCULO…………………………………...43 4.3.6 PREPARACIÓN DEL SUSTRATO PARA LA SIEMBRA DEL MATERIAL VEGETAL…………………………………………………….43 4.3.6.1 CONTROL TRATAMIENTO DEL SUELO……………………..44 4.3.7 OBTENCIÓN DE LAS ESPECIES VEGETALES……………….44 4.3.8PRUEBAS DE PATOGENICIDAD………………………………...46 4.3.9 REAISLAMIENTO DEL HONGO A PARTIR DE MATERIAL VEGETAL INÓCULADO………………………………………………….47 4.4 EVALUACIONES……………………………………………………48 4.4.1 MEDICIÓN DE LA SEVERIDAD DE LA ENFERMEDAD…….48 4.4.2 MEDICIÓN DE LA DECOLORACIÓN VASCULAR…………...49 4.4.3 AVANCE DEL PATÓGENO EN EL TALLO……………………49 4.5 RECOLECCIÓN DE LA INFORMACIÓN…………………………...50 5. RESULTADOS Y DISCUSIÓN………………………………………......51 5.1 AISLAMIENTO DEL PATÓGENO…………………………………..51 5.2 PREPARACIÓN DEL INÓCULO……………………………………53 5.3 CONTROL TRATAMIENTO DEL SUELO………………………….54 5.4 ENFERMEDAD………………………………………………………..54 5.5 REAISLAMIENTO DEL HONGO A PARTIR DE MATERIAL VEGETAL INOCULADO………………………………………………….62 5.6 MEDICIÓN DE LA SEVERIDAD DE LA ENFERMEDAD………..67 5.7 MEDICIÓN DE LA DECOLORACIÓN VASCULAR………………69 5.8 AVANCE DEL PATÓGENO EN EL TALLO……………………….70 6. CONCLUSIONES…………………………………………………………..73 7. RECOMENDACIONES…………………………………………………….75 8. REFERENCIAS BIBLIOGRAFICAS……………………………………..76 9. ANEXOS……………………………………………………………………..82 9 LISTA DE FIGURAS Pgns. Figura 1. Invernadero de la Facultad de Agronomía de la Universidad Nacional de Colombia, en donde se realizo el ensayo bajo condiciones controladas……………………………………………………………………..39 Figura 2. Vivero donde se obtuvo el material vegetal homogéneo y estéril a partir de suelo tratado……………………………………………………….46 Figura 3. Sistema de inoculación de las especies vegetales con los inóculos de clavel, arveja y uchuva………………………………………….47 Figura 4. Estructuras microscópicas de F. oxysporum (40X): a. Abundantes microconidias (en mayor proporción que macroconidias) de forma alargada y de una sola célula. b. Macroconidias en forma de media luna y con dos septas. c. Clamidosporas intercalares y d. Abundantes Monofialides individuales de tamaño corto………………………………….51 Figura 5. Cepa de F. oxysporum f. sp. uchuva, siembra directa en medio PDA a partir de material vegetal enfermo…………………………………...53 Figura 6. a. Aislamientos del hongo F. oxysporum f. sp lulo b. F. oxysporum f. sp. uchuva, siembra directa en medio PDA…………………54 Figura 7. Corte trasversal de tallo de uchuva con decoloración vascular a las tres semanas de inoculación con F. oxysporum f. sp. uchuva, síntomas primarios típicos de la enfermedad…………………………………………..56 Figura 8. Plantas de uchuva en el invernadero, inoculadas con Fou. Las hojas se observan débiles, decaídas, enrolladas, debido a la perdida de turgencia; además presentan una tonalidad que va del verde claro al amarillo………………………………………………………………………….57 10 Figura 9. a. Área foliar de uchuva b. Área foliar del lulo. Síntomas secundarios característicos de la enfermedad, clorosis y amarillamiento foliar progresivo………………………………………………………………57 Figura 10. a. Plántulas de uchuva con síntomas de amarillamiento severo de las hojas bajeras, generado por el patógeno a partir de la cuarta semana de la inoculación, F. oxysporum f. sp. uchuva. b. Plántula control de uchuva sin síntomas, plántula de uchuva inoculada con Fou que presentan envejecimiento prematuro de las hojas y clorosis por el avance de la enfermedad………………………………………………………………58 Figura 11. a. Plántulas de lulo con síntomas de amarillamiento ligero de las hojas bajeras, generado por el patógeno a partir de la cuarta semana de la inoculación, F. oxysporum f. sp. lulo. b. Plántula control de lulo sin síntomas, plántulas de lulo inoculada con Fol que presentan envejecimiento prematuro de las hojas y se observan hojas marchitas secas pero que aun permanecen adheridas a la planta…………………..58 Figura 12. a. Se observa en campo, una clorosis parcial en las hojas de uchuva, un capacho de color verde intenso y el resto cloróticos hacia un lado de la planta, hojas marchitas secas pero que aun permanecen adheridas a la planta. b. Corte longitudinal del tallo de plantas de uchuva, se observa el sistema vascular de color marrón por el avance del patógeno, y se observa en la parte posterior, el avance del patógeno en los vasos conductores en la fase inicial del necrosamiento, se caracteriza por presentar una apariencia blanquecina pulverulenta…………………..60 Figura 13. a. Hojas de uchuva que presentan síntoma foliar característico del desarrollo unilateral de la enfermedad. b. Síntoma foliar en la cuarta semana de inoculación, avance de la unilateralidad de la enfermedad……61 11 Figura 14. a. Sistema radical de las plantas de uchuva inoculadas con Fou a los 30 días de transplantadas b. Planta de lulo inoculada con Fol. Se observa pudrición oscura, atrofiamiento, escasez en los pelos radicales, raíces color marrón necrosadas. Las plantas control de uchuva y lulo presentaron un sistema radical abundante y sin pudrición………63 Figura 15. Crecimiento de las plantas de uchuva inoculadas con Fou, Fol y Fote junto con el control de uchuva, después de ocho semanas de iniciado el ensayo………………………………………………………………64 Figura 16. Crecimiento de las plantas de lulo (A) y tomate de ensalada (B) inoculadas con Fou, Fol, Fote, junto con sus respectivos controles, después de ocho semanas de iniciado el ensayo………………………….65 Figura 17. Crecimiento de las plantas de tomate de árbol (A), Datura (B) y Tabaco (C), inoculadas con Fou, Fol y Fote, después de ocho semanas de iniciado el ensayo…………………………………………………………..66 Figura 18. Tabla de medición de la severidad de la enfermedad (%) en plantas de uchuva con Fou, lulo con Fol y tomate de ensalada con Fote, durante las ocho semanas……………………………………………………68 Figura 19. Tabla de medición de la decoloración vascular en plantas de uchuva con Fou, lulo con Fol y tomate de ensalada con Fote, durante las ocho semanas………………………………………………………………….70 Figura 20. Altura de las plantas de uchuva y su relación con los síntomas de necrosis vascular. ………………………………………………………….70 Figura 21. Diferencia entre el crecimiento de las plantas de lulo (A) y tomate de ensalada (B), inoculadas con sus respectivas formas especiales, durante ocho semanas de evaluación…………………………71 12 LISTA DE ANEXOS Pgns. ANEXO A. Medio de cultivo líquido Kerr …………………………………...82 ANEXO B. Medio Agar papa dextrosa………………………………………82 ANEXO C. Basamid (Dazomet).……………………………………………..83 ANEXO D. Medio de cultivo Komada………………………………………..83 ANEXO E. Tabla de datos de la recolección de la información…………..85 ANEXO F. Tabla de las mediciones del tratamiento de control cada semana......................................................................................................86 ANEXO G. Tabla de las mediciones del tratamiento con inóculo de tomate de ensalada cada semana……………………………………………………87 ANEXO H. Tabla de las mediciones del tratamiento con inóculo de lulo cada semana…………………………………………………………………...88 ANEXO I. Tabla de las mediciones del tratamiento con inóculo de uchuva cada semana…………………………………………………………………...89 13 RESUMEN El cultivo de uchuva (Physalis peruviana L.) en el país se ha convertido en uno de los generadores de mayores divisas, dado el creciente aumento de las exportaciones hacia los mercados Europeos, lo cual ha permitido el desarrollo social en regiones donde la especie es cultivada por pequeños productores; sin embargo, en los últimos años se presenta la enfermedad conocida como “marchitamiento vascular” que ha ocasionado disminución en los rendimientos y ha limitado su cultivo en áreas contaminadas por el agente causal, el hongo Fusarium oxysporum, microorganismo que produce la muerte de la planta y pérdidas económicas a los agricultores. Este agente causal se caracteriza por presentar ciertas formas de infección y colonización, mecanismos de supervivencia y una rápida velocidad de diseminación y propagación que, junto con las formas especiales y la amplitud de hospederos, hacen que la enfermedad sea compleja y de difícil manejo. Por lo tanto, el objetivo principal de esta investigación fue estudiar el rango de hospederos del microorganismo con el fin de conocer si presenta una forma especial especifica para la uchuva y la patogenicidad de aislamientos de diferentes formas especiales de F. oxysporum, procedentes de especies cultivadas en zonas cercanas al cultivo de uchuva, permitiendo así proponer alternativas de manejo de la enfermedad. Inicialmente, se seleccionaron plántulas de uchuva y de diferentes especies cultivadas, incluyendo algunas solanáceas; bajo condiciones controladas se trataron con inóculo aislado de P. peruviana (Fou), así como también de diferentes formas especiales del microorganismo procedentes de lulo, tomate de ensalada, banano, clavel y arveja. La evaluación sobre la forma especial del Fou se estableció mediante la inoculación del patógeno en once especies de plantas. De acuerdo con 14 los resultados obtenidos, se observó que la enfermedad se desarrolló en forma rápida microorganismo en las plántulas de uchuva inoculadas con el procedente de la misma especie vegetal (Fou), demostrando un alto grado de severidad; no obstante, la enfermedad no se presentó en ninguna de las otras solanáceas evaluadas: lulo (Solanum quitoense), tomate de ensalada (Lycopersicon esculentum), tomate de árbol (Cyphomandra. betaceae), tabaco (Nicotiana tabacum), Datura stramonium, como tampoco en las de clavel (Dianthus caryophillus), crisantemo (Dendranthemum morifolium), girasol (Helianthus annum) y arveja (Pisum sativum). Se encontró, además, que los inóculos de F. oxysporum procedentes de lulo, tomate, banano, arveja y clavel no fueron patogénicos sobre la uchuva. De esta manera, se concluye que Fou es específico en la especie P. peruviana, y que ninguno de los otros inóculos evaluados afectan a la especie P. peruviana, lo cual permite sugerir que existe una forma especial de F. oxysporum en uchuva (Fou), y proponer como una de las estrategias de manejo de la enfermedad, la rotación del cultivo con algunas de las especies evaluadas que con frecuencia se cultivan en los sistemas productivos de esta especie frutícola de exportación. 15 ABSTRACT Uchuva crops, in Colombia, have become one of the greatest currency generators due to the increasing rise of exportations to European markets, situation which has allowed social development in regions where the specie is grown by small producers; nonetheless, in the last years, a disease know as “vascular wilt” has been affecting the crops, causing a decrease in the performance and limiting the cultivation of uchuva in areas contaminated by the causal agent: the Fusarium oxysporum fungus, a microorganism that causes death to the plant and economical losses to the farmers; this causal agent is well known for introducing certain forms of infection and colonization, survival mechanisms, and a fast speed of dissemination and propagation, that combined with the special forms and the amplitude of hosts, make this disease complex and of difficult handling. Therefore, the main objective of this research was to study the range of microorganism hosts in order to know if there is a special form, specific to the uchuva, and the pathogenic grade of isolations of different special forms of F. oxysporum coming from cultivated species in nearby zones to the uchuva crops, making it possible to propose alternatives to handle the disease. Initially, uchuva plants were selected, together with plants of different grown species, including some solanaceas; under controlled conditions, they were treated with isolated inoculo of P. peruviana (Fou), as well as of different special forms of the microorganism belonging to Solanum quitoense, Lycopersicon sculentum, Musa paradisíaca, Dianthus caryophillus and Pisum sativum. The evaluation of the special form of Fou was made by the inoculation of the pathogen in eleven plant species. In accordance with the obtained results, it was observed that the disease evolved quickly in the uchuva plants that were inoculated with the 16 microorganism belonging to the same vegetal specie (Fou), demonstrating a very high grade of severity; however, the disease did not appear in any of the other evaluated silences: S. quitoense, L. esculentum, C. betaceae, Nicotiana tabacum, Datura stramonium, D. caryophillus, Dendranthemum morifolium, Helianthus annum y P. sativum. It was also found that the inoculations with F. oxysporum coming from S. quitoense, sculentum, M. paradisiacal, P. sativum y D. caryophillus, were not pathogenic on the uchuva. Thus, it may be concluded that the Fou is specific to the P. peruviana specie, and that none of the other evaluated inoculums affect the P. peruviana; conclusion which leads to suggest the existence of a special form of F. oxysporum in the uchuva, and to propose as one of the strategies to handle the disease, the rotation of the crops with some of the evaluated species that are often cultivated in the productive systems of this exportation-type specie. 17 0. INTRODUCCIÓN El cultivo de uchuva (Physalis peruviana L.), a pesar de ser una especie frutícola que en los últimos tiempos ha tomado gran importancia por ser un producto de exportación y además por ser considerada una fruta tropical exótica, no ha tenido la suficiente acogida por la entidades encargadas de la investigación y generación de tecnología que permita a los pequeños y medianos productores aplicar paquetes tecnológicos encaminados a lograr una mayor rentabilidad del cultivo y de esta forma promover la comercialización de un producto de excelente calidad que sea competitivo en los mercados internacionales. Actualmente, Colombia ocupa el primer puesto como productor mundial; el valor de las exportaciones en el año 2003 alcanzó los ocho millones de dólares, convirtiéndose en la segunda fruta más comercializada después del banano y plátano. En los últimos años, el sector agrícola de Colombia y los cultivos de los pequeños productores se han visto afectados por el hongo Fusarium oxysporum Schlecht, patógeno que afecta una amplia variedad de especies vegetales de importancia comercial dentro de las cuales cabe mencionar la uchuva; la gravedad de la enfermedad conduce a la muerte de la planta, ocasionando pérdidas económicas a los agricultores. La marchitez vascular de la uchuva es una enfermedad que toma importancia debido a la drástica disminución en la productividad del cultivo; pero el mayor daño potencial se refiere a la sobrevivencia del agente causante en los residuos vegetales y en el suelo, que puede extenderse por aproximadamente un periodo de 20 años, ocasionando la inhabilitación en el uso del terreno para nuevas cosecha. Además, debido al desarrollo de la enfermedad, las vías de infección y colonización del hongo, sus mecanismos de sobrevivencia, y la rápida velocidad de 18 diseminación y propagación, hacen que esta enfermedad se convierta en una enfermedad compleja y de difícil manejo. Por lo anterior, el proyecto es una investigación básica que permite proponer estrategias para el sector frutícola que debido a la escasez de medidas de control debe encontrar alternativas rápidas y eficientes para la solución de este problema, por lo tanto en esta investigación se pretende conocer si existe una variante o alguna forma especial de microorganismo causante de la enfermedad en las plantas de uchuva, que posea la capacidad de infectar a otras especies vegetales diferentes a la uchuva, incluyendo plantas de la familia de las solanáceas, o que sea especifico para esta especie; igualmente es necesario saber si otras formas especiales del hongo F. oxysporum, procedente de solanáceas y de especies de otras familias cultivadas en áreas cercanas a los sistemas de producción de uchuva, tienen la capacidad de infectar esta especie vegetal. 19 1. MARCO TEÓRICO 1.1 FAMILIA DE LAS SOLANÁCEAS Las características principales son las de ser plantas generalmente herbáceas, aunque hay especies arbustivas y arbóreas, generalmente susceptibles a daño por heladas y a daño por enfriamiento. Las hojas son alternas y las flores pentámeras perfectas, cuyos pétalos forman una corola tubular, al menos en la base, y los estambres se alternan con los cinco lóbulos de la corona. El ovario generalmente es bilocular, aunque también puede ser multilocular, con muchos óvulos en placentas axilares, y con un estilo terminal. Los frutos pueden ser bayas o cápsulas. En varias especies existe una reconocida producción de alcaloides o compuestos nitrogenados aromáticos (ej.: atropina, nicotina, solanina, tomatina, etc.) los que, en algunos casos, se usan como drogas medicinales o estimulantes pero fácilmente pueden llegar a ser tóxicos para los animales y el hombre. Esto hace que las solanáceas, en general, hayan sido consideradas como especies venenosas y motivo de desconfianza por muchos años. Dentro de esta familia encontramos diferentes ejemplares como el tomate de árbol y de ensalada, el tabaco, lulo, estramonio o datura, uchuva, entre otras, etc. (www.puc.cl). 1.1.1 GENERALIDADES DE LA UCHUVA La uchuva (Physalis peruviana) es una especie vegetal perteneciente al género Physalis de la familia de las solanáceas donde se incluyen muchas especies de importancia comercial. Muchas de estas especies son cultivadas en las mismas regiones que la uchuva o en regiones cercanas a esta que por ser plantas de la misma familia, están biológica y evolutivamente relacionadas con la uchuva. 20 Según Legge, 1974; el genero Physalis de la familia de las solanáceas, incluye unas 100 especies herbáceas, siendo P. peruviana la más utilizada en cultivos por su fruto azucarado. Se reconocen tres ecotipos de P. peruviana, el de Sudáfrica, el de Kenia y el de Colombia. Al compararse con el originario de Colombia; los de África, tienen algunas diferencias en cuanto al fruto; el peso en Kilogramos es mayor en los ecotipos de África, pero la uchuva colombiana se caracteriza por tener una mejor coloración y mayor contenido de azúcares, características que la hacen más apetecible en los mercados (Almanza & Fischer, 1993). En Colombia, la uchuva crece como planta silvestre y semisilvestre en zonas altas entre los 1.500 y 3.000 m.s.n.m. (Fischer & Angulo, 1999). Los suelos más recomendados para el cultivo son los que poseen estructura granular y una textura areno arcillosa y, preferiblemente, que contengan altos contenidos de materia orgánica y un pH entre 5,5 y 6,8. Las tierras con alta fertilidad favorecen el crecimiento de las plantas, mientras que en las de fertilidad baja se registra fructificación temprana y baja calidad de los frutos. La uchuva registra buen comportamiento en las regiones con alta luminosidad, temperaturas promedio entre 13 y 18 grados centígrados, precipitación anual de entre 1.000 y 2.000 milímetros y humedad relativa de 70 a 80 por ciento. La planta es muy susceptible a las bajas temperaturas, a la sequía y a los vientos fuertes (Wolff, 1991). La uchuva se adapta a variadas condiciones agroecológicas, y persiste durante largo tiempo en un mismo lugar, siendo incluso clasificada como una maleza en zonas de tierras frías en Colombia (Pérez, 1986); esto hace que la uchuva sea apta también como planta de cobertura para 21 proteger los terrenos de erosiones, dado su rápido crecimiento y persistencia. La uchuva colombiana continúa siendo un fruto promisorio exportable; en los últimos años el área cultivada aumento significativamente, de 221 hectáreas en 1999 paso a 534 hectáreas en el 2003. El departamento de Cundinamarca es el principal productor (80%), seguido por Boyacá (10%) y Antioquia (10%); no obstante el 20% de los productores trabajan de acuerdo con las exigencias del mercado internacional (Fischer et al, 2005) 1.1.2 ASPECTOS ECONÓMICOS DEL MERCADO En Colombia el cultivo semicomercial de la uchuva, se inició en el año 1985 (Rodríguez et al 2000). Sin embargo, actualmente en el mundo, Colombia es el primer productor de uchuva a nivel mundial (SIM, 2005), lo cual ha colocado al empresario en un lugar de importancia, haciendo que el reto de eficiencia y competitividad sea mayor exigiéndole así, trabajar con base en el mejoramiento de calidad y tecnificación de los sistemas de producción. Las exigencias del mercado internacional obligan a que el empresario garantice la calidad del producto en términos fitosanitarios, además de asegurar la continuidad de la oferta para que haya permanente abastecimiento (López, 2000; Florez et al, 2000). Según Rodríguez et al, 2000 & García, 2003; en el año 2000 Colombia exportó 6325 toneladas de uchuva fresca por un valor de 7,4 millones de dólares. De esta producción, más del 95% se destinó a la Unión Europea, principalmente a Holanda (46% del valor de las exportaciones de uchuva en el año 2000), Alemania (26,8%), Gran Bretaña (11,7%) y Francia (7,2%) (Rodríguez et al, 2000). El desarrollo del cultivo de la uchuva en Colombia ha tenido avances importantes, pero se han cometido errores de gran repercusión, donde los 22 fracasos posiblemente se deban a la confusión entre productores y técnicos por las diferencias en el conocimiento tecnológico del cultivo y a las decisiones apresuradas, causadas fundamentalmente por el crecimiento de la demanda internacional e interna, con precios en ocasiones altos que llevan a los agricultores a dinamizar su producción con estrategias tecnológicamente variadas, pero en la mayoría de los casos con poco fundamento (Fernández, 1979, Arias, 2000; Florez et al, 2000). La problemática fitopatológica asociada a F. oxysporum presente en el cultivo de la uchuva, es solo un componente de un complejo fitosanitario enfermedad – plaga, que lo afecta durante su ciclo vegetativo Se sabe por experiencia que en los monocultivos en plantas nativas se pierde la interacción natural, patógeno-.agente controlador, y las altas densidades de siembra reúnen las condiciones favorables para la multiplicación incontrolada de estos microorganismos dañinos (Fischer et al, 2005). Cuando las pérdidas son críticas, con posibilidades de tener una alta incidencia en los costos de producción, los organismos causantes de tales desórdenes adquieren importancia económica y se vuelven objeto de observación y estudio por fruticultores y técnicos, es entonces cuando el diagnóstico que identifica la causa etiológica de las enfermedades resulta primordial para optar las medidas apropiadas de control (Blanco, 2000). En los sistemas de producción de uchuva, existen varios organismos asociados tales como insectos, moluscos, aves, y diversos hongos patógenos, cuyas poblaciones pueden tener una incidencia dañina sobre los cultivos pudiendo ser esta esporádica o continua. La decisión de utilizar estrategias de control deben realizarse con base en evaluaciones que permitan establecer si en ese momento las poblaciones a manejar son realmente importantes como para potencialmente afectar la productividad del cultivo. Es fundamental entender la dinámica de 23 poblaciones existente dentro del cultivo, el ambiente particular y la plaga considerada, para tomar decisiones racionales de manejo (Ariza, 2000, Zapata et al, 2002). Los cultivos de uchuva son afectados por una gran variedad de plagas de importancia económica que atacan diversos órganos de la planta durante su ciclo de producción. Enfermedades que se relacionan con microorganismos que atacan el tallo, estructuras florales, frutos, follaje y sistema radical (Fischer et al, 2005) La enfermedad vascular de la uchuva, es una de las enfermedades mas importantes que a pesar de observarse desde hace varios años en la zona productora de los municipios de Granada y Silvania, en donde ha ocasionado grandes perdidas, se reportó por primera vez en el año 2005 en el departamento de Cundinamarca (Forero La-Rotta y Quevedo, 2005). 1.2 ENFERMEDAD: MARCHITEZ VASCULAR DE LA UCHUVA Las enfermedades de las plantas son importantes para el hombre debido a que perjudican a las plantas y sus productos. Los marchitamientos vasculares son enfermedades destructivas producidas por diversos agentes etiológicos y se encuentran ampliamente distribuidos en poblaciones y cultivos de un sin número de especies de plantas (Agrios, 2002). Independiente del agente etiológico que lo genere o de la planta afectada, los marchitamientos presentan un grupo común de síntomas; en principio, las hojas pierden su turgencia, se debilitan y adquieren una tonalidad que va de verde claro a amarillo verdoso, decaen y finalmente se marchitan, tomando una coloración amarillenta, luego se necrosan y mueren; estas hojas pueden enrollarse o permanecer extendidas (Gonzáles, 2006). 24 El primer síntoma de este grupo de enfermedades que se observa en campo, es un amarillamiento en las hojas básales que posteriormente se marchitan y secan pero permanecen adheridas a la planta. Esta sintomatología va progresando hacía la parte superior de la planta a veces sólo toma un sector de la misma, es decir generalmente se vuelve una enfermedad unilateral. Al comienzo las plantas muestran marchitez en las horas mas calurosas del día recuperándose al final del mismo pero finalmente se marchitan y mueren. En los estadios finales, las raíces principales y la base del tallo presentan necrosis vascular. Cuando se corta el tallo se observa el sistema vascular de color marrón (Agrios, 2002; Backer, 1978). Los retoños y las hojas se marchitan durante el día, pero ganan turgencia durante la noche. Conforme la infección progresa, los tallos palidecen debido a las toxinas producidas por el hongo que decoloran el tejido y aparece el marchitamiento de las hojas. El xilema es entonces obstruido, causando la muerte de la planta (Deacon, 1990; Barrera & Gómez, 1995). Las raíces y los tallos no presentan daño inicial importante, pero luego se afectan severamente con la formación de cavidades, presentándose una pudrición seca en la base de las plantas y en las raíces (Agrios, 2002) El tallo cortado transversalmente, presenta en los haces vasculares una coloración amarillenta o marrón con la muerte y deshilachamiento de los tejidos, sin afectarse la médula; este es un aspecto muy importante para diagnosticar la enfermedad y distinguirla de otras enfermedades vasculares (Agrios, 2002) La uchuva es atacada por varias plagas, y una de las más importantes debido a las perdidas económicas es la marchitez vascular cuyo agente etiológico es F. oxysporum (Forero de La-Rotta & Quevedo 2005). 25 El ciclo de la enfermedad ocasionada por este hongo se inicia con la presencia del inóculo en el suelo o residuos de cosecha del inóculo constituido por hifas, esporas o clamidosporas que germinan cuando son activadas por los exudados producidos en las raíces fibrosas de la uchuva; los tubos germinativos del hongo penetran la epidermis de las raíces directamente o por heridas, pasan a la corteza y a la endodermis, y una vez dentro del hospedante se mueven por colonización de los vasos del xilema produciendo la oclusión del sistema vascular de la planta. Su diseminación en el campo se produce a través de material de propagación infectado, fragmentos de plantas enfermas y movimientos de suelo infestado con clamidosporas de F. oxysporum las cuales pueden sobrevivir en éste por mas de 10 años (Haglund y Kraft, 2001). El hongo penetra en las raíces a través de heridas y continúa hacia el xilema o por los tejidos conductores de agua. Es activado solamente cuando las raíces de la planta huésped entran en contacto con el micelio o clamidosporas las cuales entonces, invaden las células radicales. La tasa de velocidad de la infección depende de factores como el tiempo de la infección inicial, la virulencia y condiciones climáticas. Dependiendo de la tasa de velocidad de infección, el hongo puede ocasionar pudrición radicular y muerte, incluso en plantas muy jóvenes (Agrios, 2002). El manejo de la enfermedad a nivel mundial se ha orientado al uso de variedades resistentes al patógeno, las cuales impiden el avance del hongo sellando los elementos del xilema por medio de geles o gomas constituidas por polisacáridos de alto peso molecular (Charchar y Kraft, 1989). 26 1.3 GENERALIDADES DEL PATÓGENO F. oxysporum es un hongo imperfecto, que aparentemente ha perdido el estado perfecto o sexual. Estos se reproducen por medio de conidias (una espora asexual formada en el extremo de una hifa). El hongo sobrevive por largos periodos en el suelo como clamidosporas. Las variantes de F. oxysporum están divididas en muchas formas especiales que no pueden ser distinguidas usando criterios morfológicos (Agrios, 2002) El micelio es generalmente aéreo, abundante, algodonoso, con diferentes coloraciones como blancas, durazno, salmón, pero usualmente con un tinte púrpura o violeta más intenso en la superficie del agar. El hongo se caracteriza por producir tres clases de esporas, una de ellas son las microconidias que son esporas unicelulares, aceptadas, hialinas, de forma variable, formadas sobre fiálides laterales o sobre conidioforos poco ramificados. Las microconidias tienen entre 5-12 micras de largo x 2.5-3.5 micras de ancho (Nelson, 1981). Las macroconidias son de pared delgada, fusiformes, largas y moderadamente curvas en forma de hoz, poseen de tres a cinco septas transversales, con la célula basal elongada y la célula apical atenuada. Tienen un tamaño de 27-60 x 3-5 micras (Nelson, 1981)., Las clamidosporas son globosas, de doble pared gruesa, se encuentran solitarias o en pares, formadas a partir de la condensación del contenido de las hifas y las conidias. Con esta estructura el hongo sobrevive en condiciones ambientales desfavorables y en ausencia de plantas hospedantes. Su tamaño varía de 5-15 micras de diámetro (Summerell et al, 2002; Barrera & Gómez, 1995, Nelson, 1981). 27 La morfología de las macroconidias y la presencia y características de las clamidosporas son muy importantes para la identificación de las especies. Las macroconidias y microconidias se producen en los vasos del xilema, pero las microconidias son predominantes en tejidos infectados. Hasta el momento no se conoce la fase perfecta del hongo (Nelson et al, 1983) Esta especie se caracteriza por producir distintas formas especiales, las cuales no se pueden diferenciar por su morfología o por las características culturales de las colonias, sin embargo, son fisiológicamente diferentes por su capacidad de parasitar y ocasionar enfermedades en plantas hospedantes específicas. Esto se debe a que solamente las plantas hospedantes y sus exudados radicales satisfacen los requerimientos nutricionales del hongo y por lo tanto, puede desarrollarse solo en este tipo de plantas (Nelson, 1981; Gordon y Martyn, 1997). 1.3.1 ECOLOGÍA Y EVOLUCIÓN DE F. oxysporum Las cepas de F. oxysporum pueden dividirse de acuerdo a su forma de interactuar con la planta o plantas huésped en cepas no patógenas y patógenas. (Gordon, et al 1989; Taylor, 1965). Ambos tipos de cepas se encuentran distribuidos a nivel mundial en suelos dedicados a la agricultura asociados a plantas de interés comercial. Las cepas no patógenas de F. oxysporum se encuentran dentro de los hongos, más comúnmente aislados de plantas agrícolas sanas. Aunque incapaces de producir enfermedad en estas plantas, estas cepas son colonizadoras muy efectivas de la epidermis y el cortex de la raíz de dichas plantas (Schneider, 1984; Taylor, 1965). El hecho de que estas cepas no produzcan marchitamiento puede deberse a su incapacidad para penetrar en los tejidos del haz vascular, o al hecho de que estas generen una rápida respuesta del huésped a la infección (Gao et al, 28 1995), en cuyo caso se podría hablar de una incapacidad para evadir las respuestas del huésped. A pesar de los escasos estudios realizados en comunidades de plantas silvestres asociados a suelos no agrícolas, siempre han mostrado una asociación muy estrecha de cepas de Fusarium a las raíces de dichas plantas, en ningún caso dicha asociación conduce al desarrollo de patologías independiente de que en muchos casos las poblaciones de Fusarium asociadas a dichas plantas sean numerosas (Burgess et al, 1989; Gordon & Okamoto, 1991; Nash & Snyder, 1965). Dada la ubicuidad de las cepas no patógenas de F. oxysporum es lógico plantear que a lo largo de la historia evolutiva de Fusarium, cepas con características patogénicas hayan surgido en múltiples ocasiones a partir de cepas no patógenas vinculadas a comunidades silvestres de plantas (Gordon y Martyn, 1997). Sin embargo, es muy probable que debido a las características de distribución, abundancia y disponibilidad de las especies de plantas típicas de entornos silvestres, al efecto letal que el hongo tiene sobre las plantas infectadas, incluso antes de que las plantas alcancen a reproducirse, la expansión y perpetuación de cepas con características patogénicas haya fracasado, siendo necesario que mediante la aplicación de las prácticas agrícolas se generaran las condiciones adecuadas para la expansión y perpetuación de las cepas patógenas (Gordon y Martyn, 1997). Otro factor que podría evitar la propagación y perpetuación de las cepas con características patógenas en entornos de comunidades silvestres es la interacción tan estrecha que se requiere para que una cepa sea patógena. A diferencia de las cepas no patógenas comúnmente encontradas que solo colonizan la epidermis y/o el cortex de las raíces de las plantas, las cepas patógenas deben tener la capacidad de introducirse en el haz vascular ubicado en el centro de la raíz y una vez allí, tener la 29 facultad de proliferar exitosamente en buena cantidad sin disparar los mecanismos de detección y defensa del huésped (Beckman & Roberts, 1995) Lo especializado y específico de este rasgo, es evidente al observar los reportes que muestran el rango de plantas tan restringido que desarrollan una patología al entrar en contacto con una cepa patógena particular. Dicho rango va de un grupo de variantes dentro de una especie para algunas cepas, a unas pocas especies de plantas siempre de la misma familia y con una estrecha relación filogenética entre ellas para otras cepas. No se han encontrado cepas con la capacidad de producir patologías en una gama amplia de especies no relacionadas (Gordon y Martyn, 1997). Sin embargo, las cepas patógenas al igual que las no patógenas, son capaces de proliferar en desechos de cosechas y de colonizar el cortex de especies de plantas que no son sus hospederos reconocidos (Banihashemi & Dezeeuw, 1973; Banihashemi & Dezeeuw, 1975; Gordon & Okamoto, 1990; Gordon et al, 1989). Al parecer, la colonización del cortex de las raíces, parece ser un rasgo menos especializado y exigente que la colonización del haz vascular. La conservación de esta capacidad en las cepas patógenas actuales estudiadas, indicaría que la especialización de estas no ha conducido a la pérdida de la posibilidad de colonización del cortex de un rango más amplio de plantas, esto podría deberse o a un origen relativamente reciente de las cepas patógenas que infectan plantas agrícolas (Gordon y Martyn, 1997). El hecho de conservar dicho rasgo, puede deberse también a que este aspecto puede ayudarlo a perpetuarse por otros medios, así se posean rasgos patogénicos desventajosos para ciertas circunstancias. Seria 30 adecuado estudiar la variación en el rango de colonización de plantas a nivel del cortex de las distintas cepas y si existe alguna relación entre la capacidad de colonizarla en determinadas especies y el haz vascular de otras especies. La evolución de cepas patógenas a partir de las no patógenas, puede tener como intermediario cepas endofíticas (Chapela & Boddy, 1988; Sinclair & Cerkauskas, 1996) es decir, aquellas con capacidad moderada de introducirse en el haz vascular, manteniendo una proliferación baja o casi latente que no conduce al desarrollo de patología y que no dispara los mecanismos de detección y defensa del huésped. Es claro que una cepa con comportamiento endofítico, puede perpetuarse en situaciones de comunidades silvestres sin mayores problemas. El desarrollo de una interacción patológica, podría simplemente requerir de cambiar de un comportamiento latente o de baja proliferación, a un comportamiento de proliferación mas activo y tal vez invasivo que podría generar la patología debido a que dicho crecimiento permitiera la obstrucción en los vasos conductores o por la interacción con los mecanismos de defensa del huésped que una vez activados ocasionara dicha obstrucción (Gordon y Martyn, 1997). Es probable que la distinción entre cepas con capacidad de penetrar en el haz vascular y aquellas que solo penetran hasta el cortex se deba en muchos casos a un éxito diferencial de las distintas cepas en la colonización de dichas estructuras. En principio, éstas pueden penetrar hasta el haz vascular, pero debido a su baja adaptabilidad o a los mecanismos de defensa del huésped, desaparezcan rápidamente del haz vascular quedando confinadas exclusivamente al cortex. 31 1.3.2 FORMAS ESPECIALES DE F. oxysporum El termino forma especial, fue ideado por Snyder & Hansen, 1940; para acomodar las variantes patógenas conocidas de F. oxysporum. Este término fue propuesto para describir una capacidad particular que exhiben ciertas cepas del hongo de producir una patología en una determinada especie de planta o grupo discreto de éstas. El concepto de forma especial, ha sido particularmente útil para los fitopatólogos debido a que delimita un grupo de aislamientos importantes para la producción de cosechas susceptibles al marchitamiento por Fusarium (Gordon y Martyn, 1997). Si bien el agrupar una serie de aislamientos de Fusarium como una forma especial con base en su capacidad patológica sobre plantas agrícolas ha sido muy útil para los fitopatólogos, es probable que en muchos casos, estos grupos de aislamientos sean genéticamente muy heterogéneos y posiblemente polifiléticos es decir, de orígenes diferentes. Por tanto, es probable que muchas de las formas especiales posean grupos de aislamientos que no constituyen como tal grupos filogenéticos, lo cual seria aun más aplicable a las formas especiales tomadas como conjunto (Gordon y Martyn, 1997). El grado de relación genética y taxonómica de los distintos aislamientos de una forma especial es importante cuando se pretenden implementar programas de control basados en la posibilidad de aislar e identificar variedades de una especie vegetal que sean resistentes a una forma especial de Fusarium que las afecta (Gordon y Martyn, 1997). Es por tanto necesario tener una colección de aislamientos de una forma especial tanto de cada sitio, como de sitios distintos en el momento de evaluar bancos de germoplasma de especies vegetales respecto a la resistencia de cepas de formas especiales de Fusarium para saber 32 realmente el rango al que tiene resistencia una variante de determinada especie vegetal y en que regiones podría usarse tal resistencia de acuerdo con los aislamientos presentes. Esto es también interesante en el momento de evaluar las formas de no susceptibilidad y de resistencia vegetal, que podrían ser múltiples para este caso. Una pregunta central con respecto al surgimiento de patógenos durante la evolución de F. oxysporum es la frecuencia con la cual han surgido las formas patogénicas y la antigüedad de los eventos. Así, la aparición de patógenos fuese un evento raro, todos las formas patogénicas actualmente conocidas podrían trazar su origen a un genotipo ancestral único y el reservorio del patógenos podría limitarse a cepas relacionadas a este linaje único y constituirían así un agrupamiento mas o menos natural (Gordon y Martyn, 1997). Por otra parte, las distintas formas especiales pueden estar dispuestas en un arreglo de linajes diferentes entre si. Si fuese así, seria el azar mas que la coevolución lo que sustentaría la aparición de las distintas asociaciones patógenas y por tanto serían comunes las formas especiales genéticamente heterogéneas y polifiléticas aunque también habrían formas homogéneas y monofiléticas que serían probables sobre todo a nivel de formas especiales genéticamente muy homogéneas (Tantaoui et al, 1996). En la práctica sin embargo, es actualmente imposible saber cuál es el grado de relación entre el grupo de las distintas formas especiales, por lo que la selección de un grupo externo de referencia sería arbitrario y la filogenia resultante artificiosa. Una posible aproximación a este problema es examinar formas especiales que son patógenos de plantas huéspedes relacionadas bajo el supuesto de que los patógenos de especies estrechamente relacionadas son igualmente relacionados entre sí (Kim et al, 1992; Kim et al, 1993). 33 Con el fin de llevar a cabo tales estudios se han usado marcadores de ADN mitocondrial que posee una herencia típicamente materna. Igualmente se han usado marcadores de ADN nuclear, estudios de este tipo realizados en dos modelos muestran que a nivel de las formas especiales, se puede hablar tanto formas monofiléticas, como polifiléticas (Kim et al, 1993; Koenig et al, 1997; Namiki et al, 1994) En un estudio realizado con marcadores de ADN mitocondrial de aislamientos de cinco formas especiales que infectan cinco plantas estrechamente relacionadas de la familia de las cucurbitáceas reportado por Kim et al 1993, indican que los haplotipos de las cinco formas especiales se encontraban estrechamente relacionados y en algunos casos, los aislamientos de formas especiales de especies distintas eran genéticamente mas relacionados que aislamientos de la misma forma especial. El grado de heterogeneidad genética también variaba; por ejemplo, F. oxysporum f. sp. niveum era genéticamente homogénea, a f. sp. cucumericum, presentaba aislamientos cuyos haplotipos los agrupaban en una sola rama con el resto, igualmente sucedía con uno de los aislamientos de F. oxysporum f. sp. melonis. En conclusión, si bien la mayoría de los aislamientos de las distintas formas especiales de cucurbitáceas, pueden tener un origen monofilético, otras formas especiales pueden considerarse polifiléticas; las diferencias que llevan a esta conclusión pueden estar siendo sobreestimada y por tanto dichas formas especiales pueden no ser en realidad polifiléticas como se concluye. En apoyo a lo anterior un estudio con marcadores nucleares, separaba claramente las formas especiales de cucurbitáceas de otras formas especiales (Namiki et al, 1994) 34 Consistente con estos reportes, en muchos de los estudios de infectividad realizados con formas especiales de esta familia se ha observado patogenicidad cruzada, teniéndose aislamientos de una forma especial que producen la enfermedad en especies distintas asociadas a la misma familia de la planta huésped usual (Armstrong G & Armstrong J, 1978; McMillan, 1986). A diferencia de las formas patógenas de cucurbitáceas, un estudio con marcadores de ADN de F. oxysporum f. sp cubense que ataca el banano, muestran un elevado grado de heterogeneidad genética. Las comparaciones efectuadas con formas especiales de referencia que infectan cucurbitáceas y el tomate de ensalada, muestran que los dos linajes principales de la forma especial cubense, son tan distantes entre sí, como lo son de las formas especiales de referencia. Esto indica que cepas bastante distantes entre si han desarrollado la capacidad de infectar el banano (Koenig et al, 1997). En conclusión, es probable que algunas variantes de F. oxysporum estrechamente relacionadas sean capaces de infectar distintas especies asociadas a una misma familia, lo que aparte de hablar de un origen común indica que ligeras variaciones pueden conducir a cambiar la especificidad de huésped al menos para el caso de formas especiales asociadas a ciertas familias. Igualmente parece ser que en el caso de algunas plantas como el banano, es posible que cepas muy distantes evolutivamente, puedan desarrollar especificidad hacia esta. Esto indicaría que posiblemente dependiendo de la biología y la ecología propia, algunas plantas pueden permitir que cepas de muy distinta proveniencia puedan desarrollar relativamente fácil interacciones patogénicas, mientras que probablemente otras plantas debido a sus características ecofisiológicas admitan que solo un rango estrecho de cepas pueda ser patógeno. 35 2. FORMULACIÓN DEL PROBLEMA Y JUSTIFICACIÓN Uno de los problemas que más afecta a los cultivos de uchuva es la enfermedad conocida como marchitamiento vascular de la uchuva; por otra parte en estudios recientes se ha determinado como agente causal al microorganismo F. oxysporum, hongo que presenta características especiales en cuanto a su patogenicidad y un amplio rango de especies afectadas, este aspecto y la importancia que representa la exportación de este frutal, justifica la necesidad de encontrar el rango de hospederos del agente causal, de manera que los productores puedan establecer medidas de manejo que disminuyan las pérdidas ocasionadas por el marchitamiento vascular. Por otra parte, dado que una de las características mas importantes del microorganismo es su gran especificidad sobre determinada especie vegetal cultivada, es posible que el hongo F. oxysporum pueda tener una forma especial que infecte únicamente las plantas de uchuva. Por lo tanto es necesario establecer también, si la variante del hongo encontrada en la uchuva puede o no infectar otras plantas de importancia comercial que son cultivadas en las zonas productoras. De igual forma es necesario conocer si las variantes del hongo que atacan otras plantas de la familia de las solanáceas (a la que pertenece la uchuva) pueden atacarla, es decir si más de una forma especial del hongo puede causar la enfermedad en las plantas de uchuva. De esta manera es posible conocer el grado de especificidad y el rango de infección del microorganismo, así como también la susceptibilidad de la uchuva a otras formas especiales del hongo ya caracterizadas; establecer cualitativamente las variantes del hongo es importante para el agricultor en el momento de optar por alternativas de rotación de cultivos. 36 Adicionalmente, es necesario constatar que para el hongo, la adaptación al entorno ofrecido por alguno o algunos hospederos puede conducir muchas veces a que éste genere variaciones que a la vez le impiden poder infectar otros hospederos, dando lugar así a cambios en su comportamiento, con rangos restringidos de infectividad. 37 3. OBJETIVOS 3.1 OBJETIVO GENERAL Conocer el comportamiento del hongo Fusarium oxysporum aislado de plantas de uchuva (Physalis peruviana L.) sobre algunas solanáceas y otras especies cultivadas afectadas por diferentes formas especiales del microorganismo. 3.2 OBJETIVOS ESPECÍFICOS 1. Conocer la especificidad del hongo F. oxysporum agente causante del marchitamiento vascular en plantas de uchuva. 2. Evaluar la patogenicidad del microorganismo en algunas de las especies de solanáceas cultivadas en zonas aledañas a cultivos de uchuva. 3. Conocer el efecto de algunas formas especiales de F. oxysporum, aislado de diferentes especies vegetales sobre plantas de uchuva. 4. Determinar el avance de la enfermedad en plantas de uchuva inoculadas con el microorganismo. 5. Evaluar la presencia del hongo sobre plantas que fueron inoculadas y que no presentan los síntomas del marchitamiento vascular. 38 4. MATERIALES Y MÉTODOS 4. 1 DISEÑO DE LA INVESTIGACIÓN Este proyecto de investigación se desarrolló en las instalaciones de la Facultad de Agronomía de la Universidad Nacional de Colombia, sede Bogotá. Para las pruebas bajo condiciones controladas se contó con un invernadero de estructura metálica, con cubierta de polietileno y polisombra 70, camas de concreto elevadas, bajo una temperatura aproximada de 18 a 20ºC (Figura 1). Las pruebas de laboratorio, se efectuaron en el Laboratorio de Fitopatología. Figura 1. Invernadero de la Facultad de Agronomía de la Universidad Nacional de Colombia, en donde se realizo el ensayo bajo condiciones controladas. 4.2 POBLACIÓN DE ESTUDIO Y MUESTRA Gran parte de las especies vegetales utilizadas en el trabajo, forman parte de la familia de aquellas solanáceas, que se encuentran cultivadas bajo las condiciones de clima y topografía similares a las de la zonas productoras de uchuva ubicadas en los municipios de Granada y Silvania (Cundinamarca) y algunas especies que estando en regiones diferentes a la principal zona de producción del país, son cercanas a una de las áreas 39 en donde se presentan algunos cultivos de uchuva, en la Sabana de Bogotá. 4.2.1 VARIABLES DE ESTUDIO Con el fin de evaluar el efecto del microorganismo sobre las especies vegetales inoculadas y comprobar su grado de patogenicidad, se realizaron varias mediciones a través del tiempo, en las que se incluyeron las plantas que se usaron como testigo; se evaluaron parámetros, como: 1 Altura de la plántula 2 Coloración de las hojas 3 Presencia o ausencia de necrosis vascular 4 Apariencia del sistema radical 4.3 MÉTODOS 4.3.1 OBTENCIÓN MATERIAL VEGETAL ENFERMO El material vegetal de uchuva con los síntomas típicos de la enfermedad del marchitamiento vascular, se recolectó en los cultivos de las zonas productoras de los municipios de Granada y Silvania, ubicados a una altura sobre el nivel del mar de 1700 metros y a una temperatura promedia entre 18 a 22ºC. 4.3.2 AISLAMIENTO DEL PATÓGENO Para el aislamiento del microorganismo se tomaron tallos de plantas de uchuva que presentaban síntomas de necrosis del sistema vascular; luego en condiciones totalmente asépticas y bajo una cámara de flujo laminar se realizaron cortes del tejido enfermo, se sometieron a una desinfestación preliminar con jabón y agua estéril, se colocaron en hipoclorito de sodio al 2.6% por espacio de tres minutos, se sumergieron en agua destilada estéril durante 3 minutos para eliminar los excesos del 40 desinfestante; posteriormente, los trozos se tomaron con una pinza estéril y se colocaron sobre el medio de cultivo papa-dextrosa-agar (PDA), para luego ser incubados durante ocho días a una temperatura de 22ºC. Las cepas obtenidas, se almacenaron durante ocho meses en nevera a una temperatura aproximada de 4 a 8ºC, estas se reactivaron cada 15 días para evitar alguna perdida de patogenicidad, realizando repiques en medio PDA a partir de la cepa de referencia. 4.3.3 OBTENCIÓN DE LAS FORMAS ESPECIALES DEL MICROORGANISMO Para los ensayos se emplearon cepas del hongo F. oxysporum aislados de plantas de lulo, clavel, banano, tomate de ensalada y arveja, facilitadas por los laboratorios de Clínica de plantas de la Facultad de Agronomía de la Universidad Nacional de Colombia y el de control biológico de CORPOICA. Todos los aislamientos fueron conservados asépticamente en cajas de petri con PDA, en el laboratorio de Fitopatología en la Facultad de Agronomía de la Universidad Nacional de Colombia a una temperatura de 4ºC. Las cepas de referencia se mantuvieron activas realizando repiques cada 15 días en medio Agar PDA durante ocho meses, luego se incubaron durante ocho días a una temperatura de 22ºC y de nuevo se almacenaron en nevera a una temperatura aproximada de 4ºC. 4.3.4 IDENTIFICACIÓN DEL PATÓGENO La identificación de los hongos se efectúo mediante la observación al microscopio óptico (40X) con tinción de azul de lactofenol; se determino la morfología del micelio, tipo de esporas, conidias, monofiálides y clamidosporas producidas. Para constatar que los aislamientos crecidos 41 en PDA correspondían a F. oxysporum, se observaron además características macroscópicos como, tipo de colonia, producción de pigmentos y color del micelio; mediante la ayuda de claves taxonómicas especializadas en la identificación de especies del genero Fusarium, se comprobaron las características anotadas anteriormente. 4.3.5 PREPARACIÓN Y PRODUCCIÓN DEL INÓCULO 4.3.5.1 INCREMENTO INÓCULO POR AGITACIÓN Para la preparación e incremento del inóculo se ensayaron dos métodos: el de agitación en el cual se emplearon 20 erlenmeyer de vidrio por cada inóculo, (uchuva, lulo, tomate de ensalada, arveja, banano y clavel), para un total de 120 que contenían el medio de cultivo líquido Kerr (Ver anexo A), que previamente se esterilizo en autoclave a 121ºC por 15 libras de presión durante 25 minutos; luego se tomaron 100 ml en cada frasco y se suspendió un fragmento del hongo, (para cada aislamiento se usaron seis frascos), para un total de 600 ml de medio; se dejaron en agitación continua a 120 r.p.m durante 15 días a temperatura ambiente, luego se cuantificó el volumen de cada inóculo obteniendo una concentración adecuada de 106 conidios/ml, que posteriormente se uso en el proceso de inoculación sobre las diferentes especies evaluadas. 4.3.5.2 PREPARACIÓN DEL MEDIO DE CULTIVO En este caso se utilizaron 120 g de PDA (ver anexo B), para preparar 3.0 Lts de medio, que se esterilizó en autoclave a 121ºC a 15 lbs de presión por 25 minutos; previamente se esterilizaron durante una hora cajas de petri en un horno calibrado a 250ºC, y en cada una se vertieron 25 ml de medio de cultivo PDA; se sirvieron un total de 120 cajas. Por cada inóculo trabajado se emplearon 20 cajas para su aislamiento y purificación, realizándose dos repeticiones por cada inoculación. 42 4.3.5.3 INCREMENTO INÓCULO POR SIEMBRA DIRECTA Para realizar la purificación del hongo y el incremento del inóculo, se tomó una porción del micelio de cada cepa de referencia con un asa recta, se sembró en el agar PDA y se dejó incubando durante ocho días a una temperatura aproximada de 22ºC. 4.3.5.4 CUANTIFICACIÓN INÓCULO La cuantificación del inóculo se estableció por medio de diluciones con agua destilada estéril hasta obtener una concentración de 106 conidios/ml; el conteo se realizó con cámara de Newbauer. La concentración de inóculo utilizada se considera como la presión de inóculo que asegura una infección y un desarrollo adecuado de la enfermedad (Hood y Steward, 1957). 4.3.6 PREPARACIÓN DEL SUSTRATO PARA LA SIEMBRA DEL MATERIAL VEGETAL Para eliminar la flora microbiana presente en el sustrato usado para la siembra del material vegetal, se aplicó un fumigante del suelo cuyo ingrediente activo es Dazomet, conocido comercialmente como Basamid (ver anexo C), que es un producto de fácil aplicación y de residualidad limitada; el desinfestante se esparce sobre el sustrato y se sella con polietileno oscuro por espacio de ocho días, luego se destapa y durante 15 días se realizan varios volteos, luego se deja airear por espacio de 20 días, de manera que permita la liberación de los vapores emitidos y no queden residuos que además de ocasionar toxicidad en el material vegetal, inhiban la colonización por el microorganismo estudiado; las especies evaluadas se sembraron después de los 20 días de iniciada la aireación. 43 4.3.6.1 CONTROL TRATAMIENTO DEL SUELO Con el fin de comprobar que en el suelo esterilizado con Dazomet no se encontraba inóculo del microorganismo en estudio, se utilizó el medio de cultivo Komada (Ver anexo D), selectivo para F. oxysporum; para tal fin se tomo un gramo del suelo y se suspendió en 125 ml de agua destilada, posteriormente se sembraron cinco gotas en tres cajas de petri que contenían el medio seleccionado, para dejarlas en incubación por ocho días, al cabo de los cuales se realizaron las respectivas lecturas, de acuerdo con la recomendación sugerida por Komada et al (1975). 4.3.7 OBTENCIÓN DE LAS ESPECIES VEGETALES Se realizaron dos ensayos, el primero con todas las especies vegetales seleccionadas y el segundo con aquellas que pertenecen a la familia de las solanáceas para de esta manera corroborar los resultados del primer ensayo. Éste primer ensayo permitió corroborar la viabilidad de las cepas y tener un conocimiento preliminar de la especificidad de las formas especiales estudiadas con sus respectivos hospederos. Para este ensayo se emplearon 70 plántulas de 15 a 20 días de edad de 11 especies diferentes, para un total de 770 plantas, las cuales se distribuyeron en 7 tratamientos diferentes, inoculando 10 ejemplares por cada uno y se dejaron 110 plantas testigo (de cada una de las especies vegetales ensayadas) que no fueron inoculadas. Las especies vegetales empleadas para conocer el comportamiento del aislamiento de F. oxysporum procedente de uchuva, fueron plántulas de importancia comercial pertenecientes a la familia de las solanáceas; además de las plántulas de uchuva (Physalis peruviana), se incluyeron las 44 siguientes especies: tabaco (Nicotiana tabacum), lulo (Solanum quitoense), tomate de ensalada (Lycopersicon esculentum), tomate de árbol (Cyphomandra betaceae) y Datura (Datura stramonium); y plantas de géneros diferentes como clavel (Dianthus cariophyllus), arveja (Pisum sativum), crisantemo (Dendrathemun morifolium), girasol (Helianthus annuus) y granadilla (Passiflora edulis-ligularis). Los inóculos empleados fueron aislados a partir de plantas de uchuva, lulo, tomate de ensalada, arveja, banano y clavel, los cuales fueron enfrentados con las 11 especies vegetales. Para el segundo ensayo, se utilizaron 32 plántulas de 15 a 20 días de edad de 6 especies diferentes, para un total de 192 plantas, las cuales se distribuyeron en 4 tratamientos diferentes, inoculando 8 ejemplares de cada especie por tratamiento y se dejaron 48 plantas testigo. Las especies vegetales empleadas para conocer el comportamiento del aislamiento de F. oxysporum procedente de uchuva, fueron plántulas de importancia comercial pertenecientes a la familia de las solanáceas; además de las plántulas de uchuva (Physalis peruviana), se inocularon las siguientes especies: tabaco (Nicotiana tabacum), lulo (Solanum quitoense), tomate de ensalada (Lycopersicum esculentum), tomate de árbol (C. betaceae) y Datura (Datura stramonium). Los inóculos empleados fueron aislados a partir de plantas de uchuva, lulo y tomate de ensalada, los cuales fueron enfrentados con las 6 especies vegetales. Las plantas fueron adquiridas en viveros debidamente registrados en el ICA y en donde se realizan prácticas de esterilización del suelo, también se aseguró la homogeneidad del material en cuanto a edad, tamaño y aparentemente libre de alguna enfermedad de origen parasitario, procedente del municipio de Silvania (Cundinamarca) (Figura 2). 45 Figura 2. Vivero donde se obtuvo el material vegetal homogéneo y estéril a partir de suelo tratado. 4.3.8 PRUEBAS DE PATOGENICIDAD La preparación del inóculo se realizó a partir de las diferentes cepas del hongo activo, siguiendo un protocolo especifico, según Ribeiro & Hagedorn (1979), teniendo en cuenta que la suspensión conidial debe tener una concentración de 1x106 ufc/ml. Posteriormente, el sistema radical de las plántulas se lavó cuidadosamente con el fin de eliminar el suelo adherido, luego con el fin de permitir la entrada de las conidias del microorganismo, se cortó un centímetro del ápice de la raíz; posteriormente se realizó una inmersión de la raíz en un recipiente plástico profundo con inóculo, durante un lapso de 30 minutos; las plántulas testigo se sumergieron en agua destilada estéril (Figura 3). Al finalizar el procedimiento las plántulas fueron transplantadas a bolsas de polietileno negro con un 1 Kg. de suelo estéril, que se ubicaron en los mesones del invernadero; las plantas testigo se ubicaron separadas de las inoculadas con el hongo F. oxysporum. 46 Figura 3. Sistema de inoculación de las especies vegetales con los inóculos de clavel, arveja y uchuva. A partir de los ocho días se realizaron la primeras evaluaciones, que permitieron conocer el periodo de incubación del microorganismo inoculado y de esta manera determinar si el hongo inoculado es capaz de ocasionar los síntomas de marchitamiento y necrosis vascular. La severidad de la enfermedad se evaluó cada ocho días, de acuerdo con los parámetros seleccionados. El riego se realizó día de por medio durante el tiempo necesario de la fase de experimentación. Para prevenir la contaminación entre las plantas inoculadas, se colocaron platos individuales que permitían recoger el agua de riego sobrante y demás lixiviados. 4.3.9 REAISLAMIENTO DEL HONGO A PARTIR DE MATERIAL VEGETAL INOCULADO. Este proceso permitió establecer claramente que los síntomas observados en las plantas de algunos de los tratamientos eran ocasionados por la patogenicidad del microorganismo. Igualmente, el reaislamiento a partir de material vegetal de plántulas asintomáticas, de la zona vascular, permitió conocer si alguna de las especies de plantas de la 47 familia se las solanáceas ensayadas pueden presentar una infección leve del hongo en la parte basal del tallo, constituyéndose así en un posible portador asintomático. Para su aislamiento, se tomaron porciones de los vasos conductores del cuello de las plántulas usadas en los ensayos de infección, tanto de las sintomáticas como de las asintomáticas y de los controles; se sometieron a una desinfestación preliminar para eliminar los contaminantes ubicados en las partes superficiales de la planta, con jabón y agua estéril, se colocaron en hipoclorito de sodio al 2.6% durante 3 minutos, luego se sumergieron en agua destilada estéril durante 3 minutos; posteriormente, se tomaron los trozos de material vegetal y con una pinza estéril se colocaron sobre el agar PDA, se dejaron incubando a una temperatura de 22º C durante ocho días. El crecimiento del microorganismo en las cajas con agar PDA, se confirmó por medio de identificación microscópica y macroscópica, con ayuda de claves taxonómicas. 4.4 EVALUACIONES 4.4.1 MEDICIÓN DE LA SEVERIDAD DE LA ENFERMEDAD La severidad de la infección se registró a diferentes intervalos de tiempo (cada ocho días durante ocho semanas), usando la escala del CIAT, 1987. SEVERIDAD 1 3 PORCENTAJE 0 10 5 25 CARACTERISTICAS No manifestación de síntomas No más del 10% del follaje total esta marchito y/o clorótico Hojas están marchitas y/o cloróticas. 7 50 Hojas están marchitas y/o cloróticas. 9 100 Plantas muertas o severamente infectadas que muestran prácticamente todo su follaje marchito, con clorosis, necrosis y/o defoliación prematura 48 4.4.2 MEDICIÓN DE LA DECOLORACIÓN VASCULAR Al final de las evaluaciones, cada plántula fue retirada de la bolsa, los haces vasculares fueron seccionados transversalmente para evaluar la decoloración o necrosis vascular. Según Corrales & CIAT 1987, la escala usada para medir la decoloración vascular incluye como categorías ninguno, ligera, intermedia y severa; adicionalmente, la decoloración es evaluada por separado para porciones correspondientes a distintas alturas que van desde la raíz al tallo (parte baja, intermedia y alta). GRADO DECOLORACIÓN VASCULAR DESCRIPCIÓN 0 Ninguno 1 Ligera 2 Intermedia 3 Severa CARACTERISTICAS 4.4.3 AVANCE DEL PATÓGENO EN EL TALLO El avance del microorganismo se evaluó mediante mediciones a partir de la primera semana hasta el día que finalizó el ensayo en la octava semana. Las mediciones se realizaron, por medio de un corte trasversal en el tallo, en donde se midió la decoloración vascular de cada tejido de las plantas inoculadas que presentaron síntomas de la enfermedad. 49 4.5 RECOLECCIÓN DE LA INFORMACIÓN La información se recolectó por medio de una libreta de campo, documento que permitió anotar las observaciones semanales de los síntomas y mediciones de las variables a estudiar (altura, desarrollo foliar y radical clorosis), durante un periodo de ocho semanas. (Ver anexo E) Se realizaron muestreos destructivos, eliminando una de las plántulas inoculadas y un control por cada lectura, permitiendo obtener datos de la necrosis vascular y presencia del hongo dentro de los tejidos de la planta, así como también datos del reaislamiento. Con el fin de establecer una relación mas clara entre el tiempo de aparición de síntomas y el agravamiento de estos, con los efectos observados en los parámetros de desarrollo de la plántula; se realizó un comparación del progreso en las escalas de severidad de la enfermedad propuestas por el CIAT, 1987; y los efectos observados sobre el desarrollo de las plántulas. Para tal propósito, como ya se estableció, los parámetros que se observaron con el fin de hacer la comparación fueron: amarillamiento foliar, clorosis, necrosis vascular y/o defoliación prematura. 50 5. RESULTADOS Y DISCUSIÓN 5.1 AISLAMIENTO DEL PATÓGENO De los análisis de material vegetal con síntomas de marchitez vascular, realizados en las principales zonas productoras de uchuva de los departamentos de Cundinamarca, se obtuvieron aislamientos de Fusarium oxysporum f. sp. uchuva. Los aislamientos de las colectas se seleccionaron debido que en medio de cultivo PDA y mediante las claves taxonómicas utilizadas, presentaron las características morfológicas y de crecimiento características de F. oxysporum (Figura 4 y 5). a c. b d Figura 4. Estructuras microscópicas de F. oxysporum (40X): a. Abundantes microconidias (en mayor proporción que macroconidias) de forma alargada y de una sola célula. b. Macroconidias en forma de media luna y con dos septas. c. Clamidosporas intercalares y d. Abundantes Monofialides individuales de tamaño corto. 51 El organismo causal es el hongo perteneciente a la clase deuteromiceto denominado F. oxysporum. Este presentó hifas finas e hialinas, esporodoquios donde se agrupan las esporas y gran cantidad de conidios; en medio de cultivo, inicialmente se desarrolló una colonia blanca que al envejecer se torno de color violeta o púrpura (Figura 5 y 6). Presento microconidios unicelulares y macroconidios alargados con 2-3 septos y con un tamaño de 25-35 micras de largo y de 3-6 micras de ancho, rectos, dorsiventrales o ligeramente falcados, formo células de paredes engrosadas que actúan como estructuras de resistencia denominadas clamidosporas que pueden ser terminales o intercalares, característica que se observa en la Figura 4 y que coinciden con los descrito por Nelson (1983) & Nelson (2002). Además, se caracterizo por tener clamidosporas sin septos, las cuales miden de 6-15 micras de largo y 2-4 micras de ancho. Estas poseen una o dos células redondeadas, de pared gruesa y se producen terminal o intercalarmente en el micelio viejo o en las macroconidias. Las clamidosporas son estructuras de supervivencia y pueden sobrevivir en el suelo durante más de 5 años, lo cual depende del clima. Las clamidosporas germinan y penetran a través de las heridas que se forman al emerger las raíces laterales o penetran directamente al tejido joven en la zona de elongación. El micelio avanza intercelularmente y alcanza la región del xilema. El hongo se desarrolla en las traqueidas, vasos y células parenquimatosas. El micelio se ramifica y produce microconidias, las cuales se desprenden y son arrastradas hacia arriba por corriente de savia, vuelven a germinar y producen más micelio y microconidias. (Summerell et al, 2002) 52 Figura 5. Cepa de F. oxysporum f. sp. uchuva, siembra directa en medio PDA a partir de material vegetal enfermo. 5.2 PREPARACIÓN DEL INÓCULO El hongo que es un habitante del suelo que penetra en la planta a nivel del sistema radical o en la base del tallo por heridas naturales o inducidas, luego avanza hacia los haces vasculares y es traslocado a toda la planta. En las pruebas preliminares para evaluar los dos medios de cultivo (Kerr y PDA) se observó que en medio PDA el crecimiento del microorganismo fue rápido, obteniéndose una mayor concentración de inóculo en menor tiempo que en el medio líquido. Las colonias de F. oxysporum obtenidas a partir de aislamientos de tejidos de uchuva y lulo sobre PDA, se presentan en la Figura 6, en donde se observa que su apariencia, crecimiento y coloración es semejante. 53 B A Figura 6. a. Aislamientos del hongo F. oxysporum f. sp lulo b. F. oxysporum f. sp. uchuva, siembra directa en medio PDA. 5.3 CONTROL TRATAMIENTO DEL SUELO En el medio de cultivo Komada no se evidenció crecimiento del microorganismo a partir de las muestras de suelo después del tratamiento de esterilización con el producto, nos indicó que el proceso de desinfestación y completa esterilidad fue óptimo para llevar a cabo la inoculación en un sustrato libre de patógenos. 5.4 ENFERMEDAD De acuerdo con numerosas investigaciones, los marchitamientos vasculares son enfermedades que se encuentran ampliamente distribuidas y son muy destructivas y alarmantes, ya que se manifiestan en un marchitamiento mas o menos rápido, empardecimiento y muerte de hojas y rebrotes suculentos de algunas plantas, lo cual da como resultado la muerte de estas ultimas, tal como aparece registrado en uchuva por Forero de La Rotta et al, (2005). Los marchitamientos se deben a la presencia y actividades del patógeno en los tejidos vasculares xilémicos de las plantas; en pocas semanas el patógeno puede ocasionar la muerte de las plantas y de sus órganos que se localizan arriba del punto del invasión vascular en la mayoría de las plantas anuales y algunas perennes, aunque algunas plantas de este ultimo grupo no mueren sino 54 hasta después de varios años a partir del momento en que fueron infectadas por el hongo (Agrios, 2002). Después de que el patógeno penetra el tejido vegetal, continúa propagándose internamente en forma de micelio o conidios a través de los vasos xilémicos hasta que muere toda la planta; las que logran continuar su ciclo de vida, permiten que el patógeno siga viviendo y produzca marchitamientos vasculares que se limita a los tejidos vasculares (xilema) y a algunas células circunvecinas (traqueidas) y nunca sale a la superficie de la planta incluso tampoco produce esporas. Solo cuando la enfermedad ocasiona la muerte de una planta infectada, el hongo se propaga hacia otros tejidos y esporula en la planta muerta o sobre la superficie de ésta tal como lo reportan numerosas investigaciones realizadas por Rodríguez (2006) en plantaciones de clavel cultivado en la Sabana de Bogotá. Como se presenta en la Figura 7, en la prueba de patogenicidad, F. oxysporum procedente de uchuva mostró síntomas de necrosis vascular en las plantas inoculadas, donde se observa que los vasos conductores de nutrimentos se encuentran bloqueados, estos son los síntomas primarios del grupo de enfermedades conocidas como “marchitamientos vasculares”. Las traqueidas del xilema se obstruyen, impidiendo la comunicación entre las células de los vasos conductores y el transporte de sustancias, lo que genera una necrosis pronunciada (Barrera & Gómez, 1995). 55 A b. Figura 7. Corte trasversal de tallo de uchuva con decoloración vascular a las tres semanas de inoculación con F. oxysporum f. sp. uchuva, síntomas primarios típicos de la enfermedad. Todos los marchitamientos vasculares, sin considerar el tipo de patógeno que lo ocasione, tienen ciertas características en común generalmente las hojas de plantas infectadas o de partes de plantas infectadas pierden su turgencia, se debilitan, adquieren una tonalidad que va del verde claro al amarillo verdoso, decaen y finalmente se marchitan, se tornan amarillas, empardecen y mueren. Las hojas pueden estar extendidas o bien enrolladas (Figura 8). Los retoños tiernos y jóvenes también se marchitan y mueren; los cortes trasversales que se hacen de tallos y ramitas infectados muestran varias zonas cafés decoloradas, tal como se presentan en la Figura 7. En los vasos xilémicos de tallos, raíces y otros órganos infectados, puede haber micelio y esporas del hongo. Algunos de los vasos xilémicos son obstruidos por el micelio, las esporas o bien los polisacáridos que produce el hongo. (Barrera et al, 1995) 56 Figura 8. Plantas de uchuva en el invernadero, inoculadas con Fou. Las hojas se observan débiles, decaídas, enrolladas, debido a la perdida de turgencia; además presentan una tonalidad que va del verde claro al amarillo. La expresión de los síntomas internos y externos de la enfermedad se pudo observar en las plantas de uchuva y lulo inoculadas, con formas especiales del patógeno; se observa como es el efecto de la interacción planta-patógeno en las hojas a medida que se produce la colonización del microorganismo (Figura 9). a. b. Figura 9. a. Área foliar de uchuva b. Área foliar del lulo. Síntomas secundarios característicos de la enfermedad, clorosis y amarillamiento foliar progresivo. En Colombia esta enfermedad ha causado grandes pérdidas en los cultivos de uchuva debido al deterioro que presentan las plantas; la marchitez severa por la necrosis en los tejidos vasculares y muerte celular, impide el transporte de sustancia a otras partes de la planta, ocasionando amarillamiento y debilitamiento general, que finalmente conduce a la muerte de la planta. 57 Los síntomas del daño se inician con un amarillamiento de las hojas inferiores de la planta, tal como se observa en la figura 10.a y 11.a, la cual progresa hacia la parte superior de la misma produciendo un envejecimiento prematuro de las hojas (Figura 10.b y 11.b). La infección se efectúa en las raíces e hipócotilos de las plantas, donde su sistema vascular se puede decolorar tomando un color café-rojizo. a. . b. Figura 10. a. Plántulas de uchuva con síntomas de amarillamiento severo de las hojas bajeras, generado por el patógeno a partir de la cuarta semana de la inoculación, F. oxysporum f. sp. uchuva. b. Plántula control de uchuva sin síntomas, plántula de uchuva inoculada con Fou que presentan envejecimiento prematuro de las hojas y clorosis por el avance de la enfermedad. a. b. Figura 11. a. Plántulas de lulo con síntomas de amarillamiento ligero de las hojas bajeras, generado por el patógeno a partir de la cuarta semana de la inoculación, F. oxysporum f. sp. lulo. b. Plántula control de lulo sin síntomas, plántulas de lulo inoculada con Fol que presentan envejecimiento prematuro de las hojas y se observan hojas marchitas secas pero que aun permanecen adheridas a la planta. 58 Igualmente es necesario tener en cuenta que la enfermedad ha aumentado considerablemente en los últimos años llegando a ser una de las más limitantes en las zonas de producción ubicadas en los municipios de Granada y Silvania (Cundinamarca). Una de las causas ha sido por que los productores siembran continuamente esta especie vegetal sin tener en cuenta algún tipo de rotación del cultivo, que junto con las características de sobrevivencia que presenta el hongo tanto en el suelo como en restos de cultivo hacen que pueda perdurar por espacio superior a los 6 años. En el primer ensayo realizado, al inocular Fou sobre las 11 especies previamente seleccionadas, únicamente se obtuvieron síntomas típicos de la enfermedad sobre las plantas de uchuva; los síntomas observados presentaron características similares a las que se presentan en el campo. De igual manera las formas especiales inoculadas sobre diferentes hospederos presentaron síntomas solamente sobre los hospederos de donde fueron obtenidos, esta especificidad la registran varios investigadores en numerosos trabajos publicados (Agrios, 2002; Nelson, (2002). Lo primero que se observa en campo es un amarillamiento en las hojas básales, posteriormente se marchitan se secan pero permanecen adheridas a la planta (Figura 12.a). Esta sintomatología va progresando hacía la parte superior de la planta a veces sólo toma un sector de la misma. Al comienzo las plantas muestran marchitez en las horas más calurosas del día recuperándose al final del mismo pero finalmente se marchitan y mueren. Las raíces principales y el tallo presentan necrosis vascular, cuando se corta el tallo se observa una necrosis de color marrón en los vasos conductores de xilema, lo cual avanza desde el nivel del suelo hasta la parte más alta de la planta (Figura 12 b.) (Forero de La. Rotta y Quevedo, 2005) 59 a. b. Figura 12. a. Se observa en campo, una clorosis parcial en las hojas de uchuva, un capacho de color verde intenso y el resto cloróticos hacia un lado de la planta, hojas marchitas secas pero que aun permanecen adheridas a la planta. b. Corte longitudinal del tallo de plantas de uchuva, se observa el sistema vascular de color marrón por el avance del patógeno, y se observa en la parte posterior, el avance del patógeno en los vasos conductores en la fase inicial del necrosamiento, se caracteriza por presentar una apariencia blanquecina pulverulenta. La enfermedad es favorecida por temperaturas cálidas (20ºC) asociada a alta humedad relativa, características del clima que son comunes en las zonas de producción que se encuentran afectadas por la enfermedad. Otro síntoma característico, es la necrosis vascular unilateral que coincide con el amarillamiento del follaje, puesto que inicialmente se manifiesta en las hojas y tejidos de un solo lado de la planta (Figura 13). Cuando las raíces y tallos son invadidos por el hongo, los síntomas se muestran como una pudrición oscura, particularmente sobre las raíces laterales más pequeñas. Después que la planta muere, y bajo condiciones de ambiente húmedo, el hongo fructifica sobre la superficie del tallo. (Rodríguez, 2006) 60 a. b Figura 13. a. Hojas de uchuva que presentan síntoma foliar característico del desarrollo unilateral de la enfermedad. b. Síntoma foliar en la cuarta semana de inoculación, avance de la unilateralidad de la enfermedad. Fusarium puede reducir fuertemente el rendimiento en campo donde la incidencia de este hongo es alta. Éste sobrevive por muchos años en el suelo, la enfermedad es favorecida por climas cálidos y suelos con textura arenosa. En regiones templadas es muy severo en cultivos desarrollados bajo condiciones de invernadero. Los daños se presentan con mayor severidad cuando la planta es sometida a periodos de estrés en la etapa de floración y fructificación. (Fischer et al, 2005) Por otro lado, Fusarium puede ser diseminado en semilla vegetativa, estacas, plántulas infectadas, maquinaria agrícola, herramientas, agua de riego y cualquier medio que facilite el movimiento de suelo. Por ser uno de los cultivos de mayor importancia en Colombia, es una enfermedad que debe ser estudiada con precaución con el fin de tener elementos que permitan proponer estrategias de manejo y control de la enfermedad. 61 5.5 REAISLAMIENTO DEL HONGO A PARTIR DE MATERIAL VEGETAL INOCULADO Bajo las condiciones del ensayo, el microorganismo se recupero de las plantas de uchuva, lulo y tomate que presentaron síntomas de la enfermedad, pero no de los tejidos vegetales procedentes de plantas asintomáticas inoculadas, de igual forma a partir de las plantas testigo no se evidencio crecimiento del patógeno. Otro resultado importante que cabe mencionar, fueron las características del sistema radical. Se presentó mayor severidad de agresión en las plantas de uchuva y de lulo que en tomate de ensalada con sus respectivos inóculos. Las plantas de uchuva inoculadas con Fou, mostraban escasez en los pelos radicales al igual que las plantas de lulo con Fol. El tomate de ensalada con Fote presentó un sistema radical medianamente escaso. Esto, debido a la presencia del patógeno en el interior, afectando el proceso fotosintético en toda la planta por la clorosis, amarillamiento y pérdida de turgencia en las hojas que disminuye la captación de luz solar. Además, se bloquea la traslocación de productos hacia las raíces y demás partes de la planta (Barrera & Gómez, 1995). Por lo anterior, se detiene el crecimiento y desarrollo radical, se observa una escasez de los pelos radicales, disminución en la elongación de las raíces, atrofiamiento, necrosis (color marrón) y una leve pudrición oscura en las plantas inoculadas. Las plantas control presentaban un sistema radical abundante y sin pudrición (Figura 14 a. y b.). 62 a. b. Figura 14. a. Sistema radical de las plantas de uchuva inoculadas con Fou a los 30 días de transplantadas b. Planta de lulo inoculada con Fol. Se observa pudrición oscura, atrofiamiento, escasez en los pelos radicales, raíces color marrón necrosadas. Las plantas control de uchuva y lulo presentaron un sistema radical abundante y sin pudrición. De acuerdo con lo anterior se confirmó que el patógeno produce distintas formas especiales, las cuales no se pueden diferenciar por su morfología o por las características culturales de las colonias, sin embargo, son fisiológicamente diferentes por su capacidad de parasitar y ocasionar enfermedades en plantas hospedantes específicas. Esto se debe a que solamente las plantas hospedantes y sus exudados radicales satisfacen los requerimientos nutricionales del hongo y, por lo tanto, éste puede desarrollarse solamente en este tipo de plantas (Nelson, 1981; Gordon y Martyn, 1997). En el segundo ensayo permitió corroborar que dentro de las solanáceas únicamente Fou afecta las plantas de uchuva y en la misma forma los inóculos de las formas especiales (lulo y tomate de ensalada), no tienen ningún grado de patogenicidad sobre las plantas de uchuva. Como se observa en la figura 15, no se presentan diferencias en crecimiento de las plantas de uchuva inoculadas con aislamientos de F. oxysporum, procedentes de lulo, tomate de ensalada y el control sin inocular, sin embargo las plantas de uchuva no alcanzaron su desarrollo ya que a la séptima semana se observaron totalmente marchitas y necrosadas (Ver 63 anexo F, G, H, I). Se encontró que las plantas de uchuva disminuyen su crecimiento a partir de la tercera semana de la inoculación, lo cual permite indicar que el periodo de incubación de la enfermedad empieza a partir de las tres semanas de iniciado el ciclo de la enfermedad. Este resultado es de gran importancia para los productores ya que si el inóculo se encuentra en el suelo es probable que estos síntomas pasen desapercibidos por los cultivadores, o que se presente una especie de enmascaramiento de la enfermedad en las plántulas que se adquieren en los viveros encargados de su producción y venta. DIFERENCIACIACION DEL CRECIMIENTO DE LA UCHUVA EN SUS CUATRO TRATAMIENTOS 60 50 ALTURA TALLO (cm) 40 CONTROL INOCULO TOMATE INOCULO UCHUVA INOCULO LULO 30 20 10 0 1 2 3 4 5 6 7 8 SEMANAS Figura 15. Crecimiento de las plantas de uchuva inoculadas con Fou, Fol y Fote junto con el control de uchuva, después de ocho semanas de iniciado el ensayo. Los resultados obtenidos con los inóculos de las formas especiales de lulo y tomate de ensalada se presentan en la figura 16, que muestran que únicamente el inóculo de lulo o tomate de ensalada fueron patogénicos sobre cada una de las especies que procedían. Se observa que el periodo de incubación en las plantas de lulo se inicia a partir de la cuarta semana y después de tres semanas la planta muere; en tomate de ensalada el 64 periodo de incubación se manifiestan a partir de la quinta semana de la inoculación, sin embargo después de las ocho semanas la planta aun no presenta muerte de tejidos, únicamente se presento amarillamiento foliar y poco desarrollo. En relación con los resultados encontrados sobre las plantas de uchuva, es necesario mencionar que la patogenicidad de Fou sobre su hospedero es mayor que la forma especial de cada una de las dos solanáceas mencionadas con anterioridad; dado el corto periodo de incubación que presenta, es posible que este relacionado con algunas de las características de las plantas de uchuva, como la suculencia que presenta lo cual facilita no solamente la penetración del microorganismo sino también su colonización. DIFERENCIACION DEL CRECIMIENTO DEL LULO EN SUS CUATRO TRATAMIENTOS DIFERENCIACION DEL CRECIMIENTO DEL TOMATE DE ENSALADA EN LOS CUATRO TRATAMIENTOS 25 30 20 A L T U R A T A L L O (c m ) 25 CONTROL INOCULO TOMATE INOCULO UCHUVA INOCULO LULO 10 A L T U R A T A L L O (c m ) 20 15 CONTROL INOCULO TOMATE INOCULO UCHUVA INOCULO LULO 15 10 5 5 0 0 1 2 3 4 5 6 7 8 1 2 3 4 5 SEMANAS SEMANAS A B 6 7 8 Figura 16. Crecimiento de las plantas de lulo (A) y tomate de ensalada (B) inoculadas con Fou, Fol, Fote, junto con sus respectivos controles, después de ocho semanas de iniciado el ensayo. En los ensayos realizados sobre las otras solanáceas (C. betaceae, D. stramonium y N. tabacum), se encontró que ninguno de los inóculos ensayados presento algún grado de patogenicidad sobre este grupo de plantas, como se observa en la Figura 17. El crecimiento de las plantas 65 fue semejante al de las plantas sin inocular, a pesar de que en el caso de D. stramonium el control tuvo una altura mayor que el de las plantas inoculadas con las formas especiales del microorganismo, pero no se observaron síntomas de amarillamiento, marchitamiento o necrosis vascular, posiblemente su mayor altura pudo ser debido a factores del ambiente, como ubicación en un lugar donde la cantidad de luz era mayor (Ver anexo F, G, H, I). Este resultado también permite concluir que el inóculo procedente de las plantas de uchuva con los síntomas de “marchitamiento vascular”, solo es patogénico en plantas de uchuva, pero no tiene la capacidad de afectar el grupo de las solanáceas que forman parte de este trabajo. DIFERENCIACION DEL CRECIMIENTO DEL TOMATE DE ARBOL EN LOS CUATRO TRATAMIENTOS DIFERENCIACION DEL CRECIMIENTO DE DATURA EN LOS CUATRO TRATAMIENTOS 30 30 25 25 20 15 A L T U R A T A L L O (c m ) A L T U R A T A L L O (c m ) 20 CONTROL INOCULO TOMATE INOCULO UCHUVA INOCULO LULO CONTROL INOCULO TOMATE INOCULO UCHUVA INOCULO LULO 15 10 10 5 5 0 0 1 2 3 4 5 6 7 8 1 2 3 4 SEMANAS 5 6 7 8 SEMANAS A B DIFERENCIACION DEL CRECIMIENTO DEL TABACO EN LOS CUATRO TRATAMIENTOS 30 ALTURA TALLO (cm) 25 20 CONTROL INOCULO TOMATE INOCULO UCHUVA INOCULO LULO 15 10 5 0 1 2 3 4 5 6 7 8 SEMANAS C Figura 17. Crecimiento de las plantas de tomate de árbol (A), Datura (B) y Tabaco (C), inoculadas con Fou, Fol y Fote, después de ocho semanas de iniciado el ensayo. 66 5.6 MEDICIÓN DE LA SEVERIDAD DE LA ENFERMEDAD De acuerdo con la evaluación realizada teniendo en cuenta la escala de severidad utilizada por el CIAT, 1987; sobre el grupo de solanáceas ensayadas, únicamente las plántulas de uchuva, presentaron un marchitamiento generalizado y clorosis de casi el 25% a la tercera semana de inoculación. Al cabo de la sexta semana, presento una necrosis vascular severa y un amarillamiento generalizado. Las demás plantas no presentaron ningún síntoma (Figura 18). Las plantas de lulo inoculadas con las formas F. oxysporum f. sp. lulo, presentaron clorosis de casi el 15% a la tercera semana de inoculación. Al cabo de la séptima semana, presento una necrosis vascular severa y un amarillamiento generalizado. Las demás plantas no presentaron ningún síntoma (Figura 18). Las plantas de tomate de ensalada inoculadas con F. oxysporum f. sp. lycopersici, presentaron clorosis de casi el 10% a la quinta semana, una necrosis vascular intermedia, el desarrollo foliar y radical disminuyo pero no se observo marchitez generalizada. Las demás plántulas no presentaron ningún síntoma (Figura 18). Las plantas de tomate de árbol, datura y tabaco inoculadas con F. oxysporum f. sp. lycopersici, F. oxysporum f. sp. lulo y F. oxysporum f. sp. uchuva, no presentaron ningún síntoma. Además tanto las plantas inoculadas como las no inoculadas tuvieron un óptimo crecimiento (Ver anexo F, G, H, I) La severidad de la enfermedad y la defoliación prematura fue directamente proporcional a el avance del tiempo, demostrando que las plantas de uchuva inoculadas con F. oxysporum f. sp. uchuva, a la primera semana mostraron una severidad del 0% y a la sexta semana fue del 100%; las plantas de lulo inoculadas con F. oxysporum f. sp. lulo, a la 67 primera semana mostraron una severidad del 0% y a la séptima semana fue del 100%; las plantas de tomate de ensalada inoculadas con F. oxysporum f. sp. lycopersici, a la primera semana mostraron una severidad del 0% y a la octava semana fue del 25% (Figura 18). SEMANA 1 Severidad Uchuva+Fou (%) 0 Severidad Lulo+Fol (%) 0 Severidad Tomate de ensalada+Fote (%) 0 2 10 5 0 3 25 15 0 4 50 25 0 5 75 50 10 6 100 75 15 7 - 100 20 8 - - 25 Figura 18. Tabla de medición de la severidad de la enfermedad (%) en plantas de uchuva con Fou, lulo con Fol y tomate de ensalada con Fote, durante las ocho semanas. Demostrando así que las plantas que mas patogenicidad presentaron fueron las de uchuva con su inóculo respectivo, continuando las plantas de lulo y finalmente el inóculo que menos patogenicidad presentó fue el de tomate de ensalada. Esto puede deberse a las características fisiológicas de las plantas de uchuva, que por su tallo más suculento, permite la penetración y colonización del microorganismo de una forma más fácil y rápida. 68 5.7 MEDICIÓN DE LA DECOLORACIÓN VASCULAR Teniendo en cuenta la escala propuesta por Corrales & CIAT, 1987; la decoloración en plantas de uchuva con Fou en la segunda semana fue ligera, aumentando progresivamente cada semana hasta que finalmente la planta presentó una decoloración vascular severa en la sexta semana de inoculadas. Además se observó clorosis progresiva, finalmente un amarillamiento severo, un porcentaje de defoliación alto, marchitez aguda y generalizada (Figura 19). De igual forma, las plantas de lulo con Fol, presentaron una decoloración vascular severa a la séptima semana de inoculadas, pero la defoliación prematura fue evidenciada en menor tiempo en las plantas de uchuva, demostrando así que la agresión del patógeno en las plantas de uchuva fue mayor que en las de lulo y tomate de ensalada. Se observó clorosis progresiva, finalmente un amarillamiento intermedio, un porcentaje de defoliación medio, marchitez aguda y generalizada (Figura 19). Las plantas de tomate de ensalada con Fote, presentaron una decoloración vascular intermedia a la octava semana de inoculadas, y aún no presentaba marchitez severa ni defoliación prematura, ni un amarillamiento generalizado (Figura 19). 69 SEMANA 1 Decoloración Decoloración Uchuva+Fou Lulo+Fol(%) (%) Ninguno Ninguno decoloración Tomate de ensalada+Fote(%) Ninguno 2 Ligera Ligera Ninguno 3 Intermedia Ligera Ninguno 4 Severa Intermedia Ligera 5 Severa Intermedia Ligera 6 Severa Severa Ligera 7 - Severa Intermedia 8 - - Intermedia Figura 19. Tabla de medición de la decoloración vascular en plantas de uchuva con Fou, lulo con Fol y tomate de ensalada con Fote, durante las ocho semanas. Ninguno Ligera Intermedia Severa 5.8 AVANCE DEL PATÓGENO EN EL TALLO Al evaluar mediante muestreo destructivo el avance del patógeno en los tejidos internos de las plantas inoculadas, se encontró que el inóculo que tuvo la mayor capacidad de avanzar fue el procedente de uchuva (Fou) tal como se presenta en la Figura 20. UCHUVA vs INOCULO 35 30 25 20 ALTURA (cm) UCHUVA INOCULO 15 10 5 0 1 2 3 4 5 6 SEMANAS Figura 20. Altura de las plantas de uchuva y su relación con los síntomas de necrosis vascular. 70 Al comparar el avance de Fou respecto a las otras las especies vegetales con formas especiales conocidas (Fol, Fote), se encontró que el inóculo procedente de uchuva avanzo en promedio 5 cms cuando las plantas presentaban 32 cms de altura (Figura 20), mientras que Fol solo alcanzó un total de 3.7 cms en plantas de 15 cms, a pesar de que el microorganismo presenta mayor colonización respecto a la altura, los síntomas externos en las plantas de lulo no son tan evidentes; F. oxysporum f. sp. lycopersici avanzo un total de 3 cms a los 21 cms de altura, lo cual puede explicar que después de las ocho semanas de la inoculación las plantas de tomate aun no se ven afectadas por la obstrucción parcial en los vasos de conducción de nutrimentos (Figura 21) (Ver anexo F, G, H, I). TOMATE E. vs INÓCULO LULO vs INOCULO 25 16 14 20 12 10 15 ALTURA (cm) ALTURA (cm) 8 TOMATE E. LULO INOCULO INÓCULO 10 6 4 5 2 0 0 1 2 3 4 SEMANAS A 5 6 7 1 2 3 4 5 6 7 8 SEMANAS B Figura 21. Diferencia entre el crecimiento de las plantas de lulo (A) y tomate de ensalada (B), inoculadas con sus respectivas formas especiales, durante ocho semanas de evaluación. De acuerdo a la decoloración vascular presente en los vasos conductores de las plantas, se pudo determinar el avance del patógeno en el tejido vegetal, mostrando que las plantas de uchuva con Fou presentaron una decoloración vascular severa en la parte intermedia del tallo en las ultimas semanas del ensayo, las plantas de lulo con Fol presentaron una decoloración vascular severa en la parte alta del tallo y las plantas de 71 tomate de ensalada con Fote presentaron una decoloración vascular intermedia en la parte baja del tallo. Así, la decoloración en las plantas de uchuva se presente en la parte intermedia del tallo comparado con las plantas de lulo, la severidad de la enfermedad fue mayor en las plantas de uchuva; además que las plantas de uchuva adquirieron mayor altura que las plantas de lulo, lo que permitió al microorganismo avanzar mas rápido en el tallo mas corto. Los resultados de la presente investigación, si bien contribuyen a la identificación de la forma especial de la uchuva, F. oxysporum f. sp. uchuva (Fou) en las principales zona productoras de uchuva de los departamentos de Cundinamarca, abren también la necesidad de investigar la problemática de la marchitez vascular que como pudimos evaluar, trae consigo pérdidas económicas y en la producción del producto, además de crear alternativas paralelas como la rotación de cultivos con otras especies que fueron evaluada de igual forma en el estudio. 72 6. CONCLUSIONES El agente causal de esta enfermedad, F. oxysporum, es un patógeno parásito facultativo, habitante del suelo que penetra los tejidos por heridas y puede causar grandes daños en un cultivo por los síntomas que trae a la planta de uchuva, además de las estructuras de resistencia que presenta (clamidosporas), que le permiten estar en el suelo durante varios años, dificultando así la erradicación en un terreno. Las inoculaciones y el amplio rango de hospederos evaluados permitieron ampliar el conocimiento acerca de qué especies vegetales que en determinado momento pueden ser afectadas por el patógeno. Al estudiar el rango de hospederos afectados por el microorganismo obtenido a partir de plantas de uchuva con síntomas de “marchitamiento vascular”, se encontró que sobre esta especie vegetal se esta presentando una forma especial, que no tiene la capacidad de atacar algunas de las especies que con frecuencia se cultivan en los sistemas de producción de este frutal. De acuerdo con los resultados en este estudio el microorganismo procedente de uchuva (Fou), no presenta ningún grado de patogenicidad sobre el grupo de solanáceas evaluadas y que son cultivadas en las zonas dedicadas a la producción de uchuva. Los resultados obtenidos en el estudio permiten proponer una nueva forma especial de F. oxysporum, específico en plantas de uchuva; existen evidencias bibliográficas que indican que las formas especiales del hongo pueden encontrarse en hospederos específicos. También se encontró que las formas especiales de F. oxysporum procedentes de especies de clavel, arveja, banano, lulo, tomate de 73 ensalada, no presentaron algún grado de patogenicidad sobre uchuva, lo cual permite sugerir que los productores de uchuva cuentan con especies que sirve como cultivos de rotación, que contribuyan a disminuir la concentración de inóculo en el suelo. Se determinó que el periodo de incubación de la enfermedad es de 3 semanas lo cual reviste gran importancia en la diseminación de la enfermedad dado que los síntomas no son evidentes en el momento de comercialización del material de propagación. 74 7. RECOMENDACIONES Adelantar trabajos de investigación sobre biología molecular que permita no solo caracterizar posibles fuentes de resistencia al microorganismo, sino identificar posibles razas o variantes. Adelantar campañas encaminadas a transferir la tecnología que se ha desarrollado alrededor de las investigaciones relacionadas con esta especie vegetal de manera que los productores conozcan la importancia de la enfermedad y puedan integrar medidas preventivas sobre el manejo de la enfermedad. Realizar investigaciones encaminadas a que el material de propagación que se comercializa garantice una excelente calidad fitosanitaria. 75 8. REFERENCIAS BIBLIOGRÁFICAS 1. AGRIOS, GEORGE; 2002. Fitopatología. Segunda edición. Limusa. Grupo Noriega Editores. México. 425-431 pp 2. ALMANZA, P.J, FISCHER, G. 1993. Nuevas tecnologías de la uchuva Physalis peruviana L. Agro desarrollo 4 (1-2). 292-304 pp 3. Anónimo. SIM: Sistema de Inteligencia de Mercados. Ministerios de Agricultura y desarrollo rural. Corporación Colombiana Internacional. 2005. Perfil de producto No. 13. ( en línea):12 pp http://www.agronet.gov.co/www/docs_agronet/200511316613_UCH UVA-13.pdf 4. Anónimo: (en línea): http://danac.org.ve/indice/detalle_productos.php 5. Anónimo: (en línea): http://www.merck.cl 6. Anónimo:(http://www.puc.cl/sw_educ/hortalizas/html/solanaceae.ht ml 7. ARIZA O. RUBÉN D. 2000. Manejo de plagas de la Uchuva. UNIBIBLOS. Universidad Nacional de Colombia, facultad de Agronomía. 67-71 pp 8. ARMSTRONG G.M, ARMSTRONG J.K. 1978. Formae speciales of Fusarium Oxysporum causing wilts of the Cucurbitaceae. Phytophatology 13:95-103 pp 9. BACKER, R.P. 1978. Inoculum potencial. In J.D. Horsfall and E.B. Cowling (Eds). Plant Pathology: an advance treatise. Vol II. Academic Press. New York. 137-157 pp 10. BANIHASHEMI Z, DEZEEUW D.J. 1973. Saprophytic activities of Fusarium Oxysporum f. sp. melonis in soil. Trans. Br. Mycol. Soc. 60:205-210 pp 11. BANIHASHEMI Z, DEZEEUW D.J. 1975. The behavior of Fusarium Oxysporum f. sp. melonis in the presence and absence of host plants. Phytophatology. 65:1212-17 pp 12. BARRERA J.A, GÓMEZ S. 1995. Determinación de razas fisiológicas de Fusarium oxysporum f. sp. dianthi de clavel en ocho 76 fincas del grupo Chia localizadas en la Sabana de Bogotá. Ingeniero Agrónomo. Universidad Nacional de Colombia. Facultad de Agronomía. Bogotá, Colombia. 57 pp 13. BECKMAN C.H, ROBERTS E.M. 1995. On the nature and generic basis for resistance and tolerance to wilt diseases of plants. Advanced Botanical Research. 21:35-77 pp 14. BLANCO V.J.O. 2000. Manejo de enfermedades de la Uchuva. UNIBIBLOS. Universidad Nacional de Colombia, facultad de Agronomía. 57-65 pp 15. BURGESS LW, NELSON PE, SUMMERELL BA. 1989. Variability and stability of morphological characters of Fusarium Oxysporum isolated from soils in Australia. Mycol. Res. 96:780-84 pp 16. CHAPELA IH, BODDY L. 1988. Fungal colonization of attached beech branches. II. Spatial and temporal organization of communities arising from latent invaders in bark and functional sapwood, under diferent moisture regimes. New Phytol. 110:47-57 17. CHARCHAR M.; KRAFT, M. 1989. Response of near- isogenic pea cultivars to infection by Fusarium oxysporum f. sp. pisi, races 1 and 5. Canadian urnal of Plant Science 69, 1335-1346. 18. CIAT. Anónimo.1987. Standard system for the evaluation of bean germless. COAT, Cali, Colombia. 20 pp 19. CORRALES, PASTOR, M. A., AND ABAWI, G. S. 1987. Reactions of selected bean germ plasm to infection by Fusarium oxysporum f. sp. phaseoli. Plant Disease 71-11: 990-993 pp 20. DEACON, JIM. 1990. Institute of Cell and Molecular Biology, The University of Edinburgh. (en línea): http://helios.bto.ed.ac.uk/bto/microbes/panama.htm 21. FERNANDEZ VALIELA 1979. Introducción a la Fitopatología. INTA. B. Aires. Argentina. 435-440 22. FISCHER, G, A, R. 1999. Los frutales de clima fríos en Colombia. La uchuva. Ventana al Campo Andino 2 (1). 3-6 pp 77 23. FISCHER, G, MIRANDA D, PIEDRAHITA W, ROMERO J. 2005. Avances en cultivo, poscosecha y exportación de la uchuva Physalis peruviana L. en Colombia. UNIBIBLOS. Universidad Nacional de Colombia, facultad de Agronomía. Primera edición. 1221pp 24. FLOREZ R. V.J, FISCHER G, SORA R.D. 2000. Producción, Poscosecha y Exportación de la Uchuva (Physalis peruviana L.). UNIBIBLOS. Universidad Nacional de Colombia, facultad de Agronomía. 9-22 pp 25. FORERO LA-ROTTA, M.C.I. K. QUEVEDO E. 2005. Marchitamiento vascular por F. oxysporum en plantas de uchuva (Physalis peruviana L.) En resúmenes 30º Congreso De Fitopatología y Ciencias afines. Palmira, Valle. 80pp 26. GAO H, BECKMAN C.H, MUELLER W.C.1995. The rate of vascular colonization as a measure of the genotypic interaction between various cultivars of tomato and various formae speciales of Fusarium Oxysporum. Physiol. Mol. Plant Pathology. 46:29-43 pp 27. GARCIA M.C. 2003. Uchuva Cosecha y Postcosecha. CORPOICA. Tibaitata-Mosquera. 9-59 pp 28. GONZALES, P MSC.2006. (en línea): http://www.pv.fagro.edu.uy/fitopato/enfermedades/Fusarium_tom.ht ml 29. GORDON TR, OKAMOTO D. JACOBSON D.J.1989. Colonization of muskmelon and nonhost crops by Fusarium Oxysporum f. sp. melonis and others species of Fusarium. Phytophatology. 79:1095100 pp 30. GORDON TR, OKAMOTO D. 1990. Colonization of crop residue by Fusarium Oxysporum f. sp. melonis and others species of Fusarium. Phytophatology. 80:381-86 pp 31. GORDON TR, OKAMOTO D. 1991. Vegetative compatibility groupings in a local population of Fusarium Oxysporum. Canadian Journal of Botany. 69:168-72 pp 78 32. GORDON T. R, MARTYN R. D. 1997. The evolutionary biology of Fusarium oxysporum. Phytopathology 35: 111-128 pp 33. HAGLUND, W.A.; KRAFT, J. M. 2001. Fusarium wilt.. En: Kraft, J. M.; Pfleger, F.L. (ed.). Compendium of Pea Diseases and Pests. The American Phytopathological Society Press.St. Paul, Minnesota. USA. 14-16-84pp. 34. HOOD, R., and R.N. STEWARD.1957. Factors affecting symptoms expression in Fusarium wilt of Dianthus. Phytopathology 47:173178. 35. Kerr, A. 1963. The root Fusarium wilt complex of peas. Aust. J. Biol. Sci., 16, 55-69; Dhingra, O.D.; Sinclair, J.B. 1985. Basic plant pathology methods. CRC press. Florida, USA. 372p. 36. KIM DH, MARTYN RD. MAGILL.C.W. 1992. RFLP groups and physical map of the mtDNA from Fusarium oxysporum f sp. niveum. Phytophatology. 82:346-53 pp 37. KIM DH, MARTYN RD. MAGILL.C.W.1993. Mitochondrial DNA relatedness among formae speciales of Fusarium oxysporum in the Cucurbitaceae. Phytophatology. 83:91-97 pp 38. KOENIG RL, PLOETZ RC, KISTLER HC.1997. Fusarium oxysporum f sp. cubense consists of a small number of divergent and globally distributed clonal lineages. Phytophatology. 87:in press 39. KOMADA, H. 1975. Development of a selective medium for quantitative isolation of Fusarium oxysporum from natural soil. Rev. Plant. Res. 8, 114-125. 40. LEGGE, A.P. 1974. Notes on the history, cultivation and uses of Physalis peruviana L, en Journal of the Royal Horticultural Society. 310-314 pp 41. LÓPEZ F. A. 2000. Mercado internacional de la uchuva. UNIBIBLOS. Universidad Nacional de Colombia, Facultad de Agronomía. 165-175 pp 79 42. MCMILLAN RT.1986. Cross pathogenicity studies with isolates of Fusarium oxysporum from either cucumber of watermelon pathogenic to both crop species. Ann, Appl. Biol. 109:101-5 pp 43. NAMIKI F. SHIOMI T, KAYAMURA T, TSUGE T. 1994. Characterization of the formae speciales of Fusarium oxysporum causing wilts of cucurbits by DNA fingerprinting with nuclear repetitive DNA sequences. Appl. Environ. Microbiol. 60:2684-91 pp 44. NASH SM, SNYDER W.C. 1965. Quiantitative and qualitative comparisons of Fusarium population in cultivated fields and noncultivated parent soils. Can. J. Bot. 43:939-45 pp 45. NELSON, P.E. 1981. Life cycle and epidemiology of F. oxysporum. M.E. Mace, A.A. Bell and C.H. Beckman (Eds.). Fungal wilt diseases of plants. Academic Press. New York. 51-80pp 46. NELSON, P.E, T.A. TOUSSOUN AND W.F.O.MARASAS. 1983. Fusarium species. An illustrated manual for identifcation. The Pennsylvania University Press. University Park and London. 47. NELSON E. PAUL. 2002. Fusarium: Memorial symposium. Second printing. The American Phytopathological Society. St. Paul, Minnesota, U.S.A. 71-89 pp 48. PÉREZ, A. E.1986. Plantas utiles de Colombia. Editorial Sucesores vadeneira. Madrid. 707-708 pp 49. RIBEIRO, R. DE L. D, AND HAGEDORN, D. J. 1979. Screening for resistance to and pathogenic specialization or Fusarium oxysporum f. sp. phaseoli, the casual agent of bean yellows. Phytopathology 69:272-276 pp 50. RIBEIRO, R. DE L. D, AND HAGEDORN, D. J. 1979. Inheritance and nature of resistance in beans to Fusarium oxysporum f. sp. phaseoli. Phytopathology 69:859-861 pp 51. RODRÍGUEZ C., BOTIA B.Y. 2000. Economía y gestión de la producción de Uchuva. UNIBIBLOS. Universidad Nacional de Colombia, facultad de Agronomía. 91-108 pp 80 52. RODRÍGUEZ A. M.H. 2006. Determinación de razas fisiológicas de fusarium oxysporum f. sp. pisi en las principales zonas productoras de arveja de Cundinamarca y Boyacá. UNIBIBLOS. Universidad Nacional de Colombia, facultad de Agronomía. 3-25 pp 53. SCHNEIDER RW.1984. Effects of nonpathogenic strains of Fusarium oxysporum on celery root infection by Fusarium oxysporum f sp. appi and a novel use of the lineweaver-Burk double reciprocal plot technique. Phytophatology. 74:646-53 pp 54. SUMMERELL A. B, LESLIE F. J , BACKHOUSE D., BRYDEN L. WAYNE, BURGESS W. L. 2002. Fusarium Paul E. Nelson Memorial symposium. Second printing. The American Phytopathological Society. St. Paul, Minnesota, U.S.A. 15-23 pp 55. SINCLAIR JB. CERKAUSKAS RF.1996. Latent infection vs. endophytic colonization by fungi. In endophytic fungi in Grasses and Woody Plants, ed. SCRedlin. LM Carris, pp.3-29, St. Paul, MN: APS.223pp 56. SNYDER W.C. HANSEN HN. 1940. The species concept in Fusarium oxysporum. Am.J.Bot. 27:64-67 pp 57. TANTAOUI A, OUINTEN M, GEIGER JP, FERNANDEZ D. 1996. Characterization of a single lineage of Fusarium oxysporum f sp. albedinis causing Bayoud disease of date palm in Morocco. Phytophatology. 86:787-92 pp 58. TAYLOR GS.1965. Studies on fungi in the root region. IV Fungi associated with the roots of Phaseolus vulgaris. Plant soil. 22:1-20 pp 59. WOLFF,X,Y.1991. Species, cultivar, and soil amendments influence fruit production of tow Physalis species. HortScience 26 (12). 15581559 pp 60. ZAPATA P.J.L, SALDARRIAGA C., LONDOÑO B., DIAZ D. CIPRIANO. 2002. Manejo del Cultivo de Uchuva en Colombia. Impresos Begón Ltda. CORPOICA. Boletín 14. Rionegro-Antioquia. 7-38 pp 81 9. ANEXOS ANEXO A MEDIO LÍQUIDO DE CULTIVO KERR Empleado para incrementar poblaciones de especies de Fusarium sp e inducir producción de Microconidias y Macroconidias. KH2PO4 1.0 g FeSO4 10 mg NaNO3 2.0 g KCL 0.5 g MgSO4*7H2O 0.5 g KNO3 1.0 g Dextrosa 35 g Agua 1000 ml. Tomado de Kerr, A. 1963. The root Fusarium wilt complex of peas. Aust. J. Biol. Sci., 16, 55-69; Dhingra, O.D.; Sinclair, J.B. 1985. Basic plant pathology methods. CRC press. Florida, USA. 372p. ANEXO B PDA (PAPA DEXTROSA AGAR) Medio para el cultivo y enumeración de levaduras y mohos a partir de alimentos y otros materiales. Los hidratos de carbono y la infusión de papa favorecen el crecimiento de levaduras y hongos, en tanto que por el bajo rango de pH, la flora acompañante se reduce significativamente. Agar -15g, Dextrosa - 20g, Infusión papa - 4g Tomado de http://www.merck.cl 82 ANEXO C Indole: Fumigantes. Grupo químico: Tiocianatos Ingrediente activo: Dazomet Empresa distribuidora: Basf Descripción: Desinfectante granulado que al humedecerse libera unos gases tóxicos, que al entrar en contacto con insectos, hongos, nematodos y la mayoría de la semilla de malezas las controla. Puede ser utilizado en la desinfección de semilleros de la mayoría de las hortalizas, suelo para ornamentales, tabaco, frutales y para sustrato de plantas de transplante. Dosificación: Almácigo o semilleros de 50 a 60 g/metro cúbico. Sustrato de 200 a 300 g/metro cúbico. Esperar 7 días después de aplicado y remover el suelo para liberar los gases y esperar de 5 a 7 días antes de sembrar. Presentación: Envase de un 1 kg y Sacos de 25 kg. http://danac.org.ve/indice/detalle_productos.php?ps=478283&listado=t ANEXO D MEDIO DE CULTIVO KOMADA Empleado para aislamiento de Fusarium oxysporum de suelo y tejido de plantas. K2HPO4 1.0 g KCL 500 mg MgSO4*7H2O 500 mg Fe-Na-EDTA 10 mg L-asparagina 2.0 g D-galactosa 20 g Agar 15 g 83 Agua 1000 ml. Pentacloronitrobenzeno 1.0 g (PCNB, 75% WP) Oxgall 500 mg Na2B4O7*10H2O 1.0 g Sulfato de streptomicina 300 mg Se ajusta el pH a 3.8, adicionando 10% de solución de ácido fosforico. Tomado de Komada, H. 1975. Development of a selective medium for quantitative isolation of Fusarium oxysporum from natural soil. Rev. Plant. Res. 8, 114-125. 84 ANEXO E TABLA DE DATOS DE INFORMACION ESPECIE COLOR AREA FOLIAR VEGETAL FECHA CLORO AMARI NORM ALTURA SISTEMA RADICAL NECROSIS TALLO CMS VASCULAR CMS ABUN MED ESCAS PRESE AUSENT ANEXO F. TABLA DE LAS MEDICIONES DEL TRATAMIENTO DE CONTROL CADA SEMANA TRATAMIENTO 1: CONTROL 10 6 6 7 7 8 16 3 5 10 7 7 16 7 9 11 10 10 22 4 6 19 10 9 23 10 13 13 12 12 25 4 8 22 12 10 31 13 17 16 15 14 28 5 10 25 14 12 37 16 19 18 17 16 31 5 12 30 15 13 42 18 23 23 19 19 37 6 15 31 15 16 48 6 25 26 22 22 Nº De Hojas Semana 8 Altura Tallo (cm.) Nº De Hojas Semana 7 Altura Tallo (cm.) Nº De Hojas Semana 6 Altura Tallo (cm.) Nº De Hojas Semana 5 Altura Tallo (cm.) Nº De Hojas Semana 4 Altura Tallo (cm.) Nº De Hojas 9 3 5 9 3 6 Semana 3 Altura Tallo (cm.) 5 3 3 4 3 4 Nº De Hojas Nº De Hojas UCHUVA LULO TOMATE DE ARBOL TOMATE DE ENSALADA DATURA TABACO Semana 2 Altura Tallo (cm.) VARIEDAD Altura Tallo (cm) Semana 1 39 6 17 35 16 17 86 ANEXO G TABLA DE LAS MEDICIONES DEL TRATAMIENTO CON INÓCULO DE TOMATE DE ENSALADA CADA SEMANA TRATAMIENTO 2: INÓCULO TOMATE ENSALADA 12 5 5 8 7 7 12 3 6 8 9 7 18 7 9 11 9 10 18 4 8 11 10 10 26 10 13 13 13 12 23 4 12 15 11 13 34 12 16 15 15 16 30 5 14 16 13 15 41 15 18 16 18 18 35 6 16 17 16 17 45 18 22 19 19 21 38 6 18 17 18 18 52 20 25 21 20 23 Nº De Hojas Semana 8 Altura Tallo (cm.) Nº De Hojas Semana 7 Altura Tallo (cm.) Nº De Hojas Semana 6 Altura Tallo (cm.) Nº De Hojas Semana 5 Altura Tallo (cm.) Nº De Hojas Semana 4 Altura Tallo (cm.) Nº De Hojas 8 3 4 6 4 7 Semana 3 Altura Tallo (cm.) 5 3 3 4 3 4 Nº De Hojas Nº De Hojas UCHUVA LULO TOMATE DE ARBOL TOMATE DE ENSALADA DATURA TABACO Semana 2 Altura Tallo (cm.) VARIEDAD Altura Tallo (cm.) Semana 1 41 6 20 18 20 19 87 ANEXO H TABLA DE LAS MEDICIONES DEL TRATAMIENTO CON INÓCULO DE LULO CADA SEMANA TRATAMIENTO 3: INÓCULO LULO 11 5 5 8 7 8 14 3 5 7 6 7 17 7 8 12 9 11 19 3 6 20 8 8 25 10 13 15 12 13 23 4 8 22 12 10 33 12 17 17 14 16 29 4 10 26 13 15 39 13 20 19 16 18 34 3 12 31 15 16 43 15 23 23 18 22 38 3 15 35 17 18 48 26 27 20 25 Nº De Hojas Semana 8 Altura Tallo (cm.) Nº De Hojas Semana 7 Altura Tallo (cm.) Nº De Hojas Semana 6 Altura Tallo (cm.) Nº De Hojas Semana 5 Altura Tallo (cm.) Nº De Hojas Semana 4 Altura Tallo (cm.) Nº De Hojas 10 3 4 6 4 5 Semana 3 Altura Tallo (cm.) 5 3 3 4 3 4 Nº De Hojas Nº De Hojas UCHUVA LULO TOMATE DE ARBOL TOMATE DE ENSALADA DATURA TABACO Semana 2 Altura Tallo (cm.) VARIEDAD Altura Tallo (cm.) Semana 1 44 18 27 20 22 88 ANEXO I TABLA DE LAS MEDICIONES DEL TRATAMIENTO CON INÓCULO DE UCHUVA CADA SEMANA TRATAMIENTO 4: INÓCULO UCHUVA 10 4 6 8 7 6 13 3 5 9 7 8 15 6 9 12 10 9 15 4 5 15 10 11 22 9 14 17 14 12 20 4 6 23 12 14 28 12 17 19 17 15 24 5 9 29 14 15 32 16 18 22 20 17 22 5 11 30 16 18 19 23 25 23 19 5 11 34 17 18 21 26 28 25 21 Nº De Hojas Semana 8 Altura Tallo (cm.) Nº De Hojas Semana 7 Altura Tallo (cm.) Nº De Hojas Semana 6 Altura Tallo (cm.) Nº De Hojas Semana 5 Altura Tallo (cm.) Nº De Hojas Semana 4 Altura Tallo (cm.) Nº De Hojas 10 3 4 7 4 6 Semana 3 Altura Tallo (cm.) 6 3 3 4 3 4 Nº De Hojas Nº De Hojas UCHUVA LULO TOMATE DE ARBOL TOMATE DE ENSALADA DATURA TABACO Semana 2 Altura Tallo (cm.) VARIEDAD Altura Tallo (cm.) Semana 1 5 13 36 18 19 89