fisicoquimica capítulo ii. sistemas ideales
Anuncio

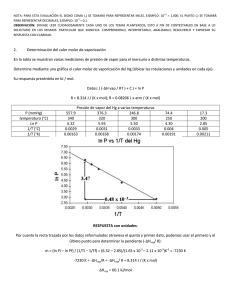
Ing. Federico G. Salazar fisicoquimica@fsalazar.bizland.com FISICOQUIMICA CAPÍTULO II. SISTEMAS IDEALES Contenido 1. EQUILIBRIO DE FASES PARA SUSTANCIAS PURAS 1.1 ECUACIÓN DE CLAUSIUS-CLAPEYRON 1.2 REGLA DE TROUTON 1.3 ECUACIÓN DE ANTOINE 1.4 REGLA DE CRAFTS 1.5 REGLA DE GIBBS 2. PROPIEDADES COLIGATIVAS PARA MEZCLAS BINARIAS IDEALES CON UN SOLO COMPONENTE VOLÁTIL 2.1 CONSTANTE EBULLOSCÓPICA 2.2 CONSTANTE CRIOSCÓPICA 2.3 SOLUBILIDAD 2.4 PRESIÓN OSMÓTICA 3. EQUILIBRIO DE FASES PARA MEZCLAS IDEALES CON TODOS LOS COMPONENTES VOLÁTILES 3.1 ECUACIÓN DE RAOULT 3.2 GRÁFICAS DE EQUILIBRIO LÍQUIDO-VAPOR ECUACION DE CLAUSIUS-CLAPEYRON Y REGLA DE TROUTON ECUACION DE ANTOINE La temperatura de ebullición normal del eter dietílico es de 34.6°C. Calcule la presión de vapor a 25°C. CASTELLAN, GILBERT. Prob. No. 12.2 Tb := ( 34.6 + 273.15) ⋅ °K Ref.: Tb = 307.75 °K Solución: Utilizando la expresión integrada de la Ec. de Clausius Clapeyron (Ec. 5.16 Laidler), y la Regla de Trouton (Ec. 5.18 Laidler): ⎛ P2 ⎞ ∆Hvap ⎛ 1 1 ⎞ = ⋅⎜ − ⎜ P1 R T T 2⎠ ⎝ ⎠ ⎝ 1 ln⎜ ∆Hvap Tb = 88⋅ J mol⋅ °K Sabiendo que para P° = 1 atm corresponde la Tb (temperatura de ebullición normal) y sustituyendo la Regla de Trouton: ⎞ = ∆Hvap ⋅ ⎛ 1 − 1 ⎞ ⎜ R ⎝ P° ⎠ ⎝ Tb T ⎠ ln⎛⎜ P ln( P) = ln( P°) + ---> ∆Hvap ⋅ ⎛⎜ 1 − ⎝ R⋅ Tb Tb ⎞ T ⎠ = ⎞ ⋅ ⎛ 1 − Tb ⎞ ⎜ R ⎝ mol⋅ °K ⎠ ⎝ T ⎠ 88 ⋅ ⎛⎜ J se obtiene la expresión aplicable para evaluar la presión de vapor (en atmósferas) para cualquier temperatura: ln( P) = 10.585⋅ ⎛⎜ 1 − ⎝ Tb ⎞ T ⎠ Nota: Esta ecuación es válida únicamente para sustancias que siguen la Regla de Trotuon. Aplicando para lnPvap := 10.585⋅ ⎛⎜ 1 − T := ( 25 + 273.15) ⋅ °K ⎝ Pvap := exp( lnPvap) ⋅ atm Pvap = 0.711 atm Tb ⎞ T ⎠ lnPvap = −0.341 Pvap = 72.057 kPa Existe por otro lado, la Ecuación de Antoine de tres parámetros que es válida para cualquier sustancia pura, y evalúa la Presión de Vapor en función de la temperatura. Para el Eter dietílico, los parámetros de Antoine son: A := 4.10962 B := 1090.64 C := 231.20 logPvap := ⎛⎜ A − Ecuación de Antoine ⎝ ( logPvap) Pvap := 10 ⋅ bar %diferencia := ⎛⎜ 1 − ⎝ 71.222 ⎞ 72.057 ⎠ (Pvap en bar) B ⎞ C + T − 273.15 ⎠ Pvap = 0.703 atm logPvap = −0.147 Pvap = 71.222 kPa %diferencia = 1.159 % ECUACION CLAUSIUS-CLAPEYRON ⎛ 200 ⎞ ⎜ ⎜ 250 ⎟ t := ⎜ 300 ⎟ ⋅ °C ⎜ 320 ⎟ ⎜ ⎝ 340 ⎠ Se muestran varias mediciones de presión de vapor para el mercurio a distintas temperaturas. Determine su calor molar de vaporización. Solución: Utilizando la Ec. de Clausius-Clapeyron, (Ec. 5.16 Laidler): ⎞ = ∆Hvap ⋅ ⎛ 1 − 1 ⎞ ---> ⎜ P° R ⎝ ⎠ ⎝ Teb T ⎠ ln⎛⎜ P ln( Pvap) = ⎛ 17.3 ⎞ ⎜ ⎜ 74.4 ⎟ Pvap := ⎜ 246.8 ⎟ ⋅ mmHg ⎜ 376.3 ⎟ ⎜ ⎝ 557.9 ⎠ ⎛ P2 ⎞ ∆Hvap ⎛ 1 1 ⎞ = ⋅⎜ − ⎜ P1 R T T 2⎠ ⎝ ⎠ ⎝ 1 ln⎜ ⎛ −∆Hvap ⎞ ⋅ ⎛ 1 ⎞ + ∆Hvap ⋅ ⎛ 1 ⎞ ⎜ ⎜ ⎜ R ⎝ R ⎠ ⎝ T⎠ ⎝ Teb ⎠ Esta expresión corresponde a una línea recta con pendiente - ∆Hvap / R. Si correlacionamos los datos experimentales de presión de vapor contra temperatura podemos obtener el valor del calor de vaporización. i := 1 .. 5 T := t + 273.15 i X := i i ⎛ 1 T Y := ln⎜ i ⎞ ⎝ 760 ⋅ mmHg ⎠ i i Pvap Buscando una correlación lineal: corr( X , Y) = −100 % 0 Pend := slope ( X , Y) Pend = −7.198 × 10 Inter := intercept ( X , Y) Inter = 11.433 3 1 Yi ∆Hvap := Pend⋅ R ∆Hvap = −59.847 2 3 kJ 4 0.0016 0.0017 0.0018 0.0019 0.002 0.0021 0.0022 mol Xi Teb := −∆Hvap Teb = 629.611 °K R⋅ Inter comparando con la bibliografía: %error := 1 − 356.461 356.73 %error = 0.075 % Teb − 273.15 = 356.461 °C Teb := 356.73⋅ °K ∆Hvap := −58.155⋅ %error := 1 − −58.155 −59.847 kJ mol %error = 2.827 % REGLA DE CRAFTS. Se utiliza para calcular la variación de la temperatura de ebullición de una sustancia con variaciones en la presión del sistema: ∆P ∆T = ∆Hvap Teb ⋅ P R⋅ Teb Ilustracion. Como ejemplo, para el mercurio, cuya temperatura de ebullición normal es 356.73°C y el calor normal de vaporización 58.155 kJ/mol, se desea calcular la elevación de la temperatura de ebullición, cuando la presión aumenta desde el punto de ebullición normal hasta 2.5 atm: P° := 1 ⋅ atm Teb := 356.73⋅ °C + 273.15⋅ °K P := 2.5⋅ atm ∆P := P − P° ∆T := ∆P⋅ entonces: R P ∆Hvap := −58.155⋅ kJ mol ∆P = 1.5 atm 2 ⋅ Teb ∆T = 34.032 °C ∆Hvap REGLA DE GIBBS Se utiliza para evaluar la variación de la presión de vapor con cambios en la presión externa del sistema. ⎞ = Vml ⋅ ( Ptotal − Pvap°) ⎝ Pvap° ⎠ R⋅ T ln⎛⎜ donde Pvap Pº := 1 ⋅ atm Pvap° es la presión de vapor de la sustancia pura sin presión externa Ptotal es la presión efectiva sobre la superficie del líquido Vml es el volumen molar del líquido saturado, asumido constante en un intervalo de temperatura Ilustración. Como ejemplo, para el mercuruio a las siguientes condiciones --> T := 523.15⋅ °K Ptotal := 303.0 ⋅ kPa El volumen molar se puede hallar si se conoce la densidad a las condiciones dadas, ρ := 13.645⋅ gr cm PM := 200.59⋅ 3 lnPvap° := 10.585⋅ ⎛⎜ 1 − ⎝ de la Regla de Gibbs: Teb ⎞ T ⎠ gr mol ρ Pvap° := exp( lnPvap° ) ⋅ atm Pvap := Pvap°⋅ exp⎡⎢ La presión de vapor varía muy poco. Vml := PM Vml ⎣ R⋅ T ⋅ ( Ptotal − Pvap°)⎤⎥ ⎦ Vml = 14.701 cm 3 mol Pvap° = 11.691 kPa Pvap° = 87.692 mmHg Pvap = 11.702 kPa Pvap = 87.778 mmHg PROPIEDADES COLIGATIVAS DE SOLUCIONES PARA SOLUTOS NO VOLATILES CONSTANTE EBULLOSCOPICA (Atkins) Calcular la Constante Ebulloscópica cuando 10 gr de un sólido se disuelven en 100 gr de benceno. Se encontró que el punto de ebullición aumentó de 80.10°C a 80.90°C. Evaluar la masa molar del soluto. Teb_Solv := 353.1 ⋅ °K Datos para el Benceno: ∆Hvap_Solv := 30.8⋅ kJ PM_Solv := 78.11 ⋅ mol 2 Keb := De la ec. 5.126.a Laidler: R⋅ Teb_Solv ⋅ PM_Solv mol °K ⋅ kg Keb = 2.629 ∆Hvap_Solv gr mol Este resultado indica que para una concentración 1 molal de soluto, el punto de ebullición de la solución aumentará 2.63°K (si la solución permanece ideal a esa concentración) Para evaluar el peso molecular del soluto disuelto, se tiene que: mS = molalidad [mol soluto/kg solvente] = masa [gr soluto] / PM [ gr soluto/mol soluto] masa [kg solvente] mS := Por la ec. 5.126 Laidler: Entonces: 80.90 ⋅ °C − 80.10 ⋅ °C Keb 100 ⋅ gr PM_Soluto := mS = 0.304 PM_Soluto = 328.6 ( 1 ⋅ kg) ⋅ mS mol kg gr mol CONSTANTE CRIOSCOPICA (Atkins) Calcular la Constante Crioscópica cuando 10 gr de un sólido se disuelven en 100 gr de benceno. Se encontró que el punto de fusión disminuyó de 5.50°C a -0.74°C. Evaluar la masa molar del soluto. Datos para el Benceno: Tf_Solv := 278.6 ⋅ °K ∆Hfus_Solv := 9.84⋅ kJ PM_Solv := 78.11 ⋅ mol 2 De la ec. 5.120 Laidler: Kf := R⋅ Tf_Solv ⋅ PM_Solv ∆Hfus_Solv Kf = 5.123 gr mol °K ⋅ kg mol Este resultado indica que para una concentración 1 molal de soluto, el punto de ebullición de la solución aumentará 2.63°K (si la solución permanece ideal a esa concentración) Para evaluar el peso molecular del soluto disuelto, se tiene que: mS = molalidad [mol soluto/kg solvente] = masa [gr soluto] / PM [ gr soluto/mol soluto] masa [kg solvente] mS := Por la ec. 5.121 Laidler: Entonces: PM_Soluto := 5.50⋅ °C − ( −0.74) ⋅ °C 100 ⋅ gr ( 1 ⋅ kg) ⋅ mS Kf mS = 1.218 PM_Soluto = 82.09 gr mol mol kg SOLUBILIDAD EN SOLUCIONES IDEALES (Atkins) Estime la solubilidad del naftaleno en benceno a 25°C, asumiendo comportamiento ideal. Datos para el Naftaleno: ∆Hfus_soluto := 19.0⋅ kJ Teb_soluto := 353.4 ⋅ °K mol ∆T := ( 298.15⋅ °K − Teb_soluto ) El intervalo de temperatura considerado: T := 298.15⋅ °K ∆T = −55.25 °K Para el análisis de la solubilidad en una solución ideal saturada, la composición del soluto puede hallarse a través de la siguiente ecuación: ⎡ ∆Hfus_soluto ⋅ ( T − Teb_soluto)⎤ ⎥ 2 ⎣ R⋅ ( Teb_soluto ) ⎦ x_soluto := exp⎢ Para el soluto: n_soluto x_soluto = --> n_Solv + n_soluto x_soluto⋅ n_soluto := En 1,000 gr de benceno: x_soluto = 0.364 n_soluto = ( 1 − x_soluto) 1000⋅ gr PM_Solv n_soluto = 7.323 mol ( 1 − x_soluto) n_soluto m_soluto := La concentración de la solución a 25°C es: x_soluto⋅ n_Solv m_soluto = 7.323 1.0⋅ kg mol kg La respuesta anterior asume comportamiento de solución ideal. El resultado experimental (solución no ideal) es de 4.6 mol/kg. Es de notar que la fracción mol del soluto (naftaleno) es independiente del solvente, pero la molalidad depende de su masa molecular. PRESION OSMOTICA (Atkins) En un estudio de la presión osmótica de la hemoglobina a 276.15°K se encontró que la presión era igual a la de una columna de agua de 3.51 cm de altura. La concentración fue de 1 g por 0.100 dm 3. Calcular la masa molar de la hemoglobina. Se sabe que su densidad relativa del mercurio es 13.59 DR Hg := 13.59 Por la definición de carga hidrostática y densidad relativa se puede demostrar que las alturas se relacionan así: h DR Hg Entonces, T := 276.15⋅ °K = AGUA h Hg h_AGUA := 3.51⋅ cm ρ := 1 ⋅ gr 3 0.100 ⋅ dm ---> Por otra parte, h Hg := c := La masa molecular se obtiene: 35.1 13.59 ⋅ mmHg P_osmotica := h P_osmotica c = 0.15 R⋅ T cm P_osmotica = 344.326 Pa Hg mol 3 m PM HEMO := ρ c PM gr ρ = 0.01 HEMO = 66678.5 gr mol 3 ECUACIÓN DE RAOULT Ilustración. Evaluar el ELV para la mezcla MEC-Tolueno-Agua: ⎛ 14.1334 ⎞ antA := ⎜ 13.9320 ⎜ ⎝ 16.3872 ⎠ Constantes de Antoine ⎛ 2838.24 ⎞ antB := ⎜ 3056.96 ⎜ ⎝ 3885.70 ⎠ ⎛ 218.690 ⎞ antC := ⎜ 217.625 ⎜ ⎝ 230.170 ⎠ j := 1 .. 3 ⎡ Psat( j , T) := exp⎢ antA − j ⎢ ⎣ T := 500 ⋅ °K °K <- temperatura de la mezcla Psat( j , T) = − 273.15 = 226.85 °C kPa 1157.8416 2656.9823 ⎛ 0.35 ⎞ x := ⎜ 0.50 ⎜ ⎝ 0.15 ⎠ 3 3 ∑ x =1 P := j j= 1 j P ∑ x ⋅ Psat( j , T) j P = 1800.702 kPa j= 1 P = 17.772 atm <- presion del sistema ⎛ 0.457 ⎞ y = ⎜ 0.321 ⎜ ⎝ 0.221 ⎠ x ⋅ Psat( j , T) j j 2352.0978 T y := ⎤ ⎥ ⋅ kPa ⎛ T − 273.15⎞ + antC ⎥ ⎜ j⎦ ⎝ °K ⎠ antB 3 ∑ y =1 j j= 1 GRÁFICAS DE EQUILIBRIO LÍQUIDO-VAPOR Ilustración. Evaluar el ELV para la mezcla MEC-Agua: Constantes de Antoine antA := ⎛ 14.1334 ⎞ ⎜ ⎝ 13.9320 ⎠ antB := ⎛ 2838.24 ⎞ ⎜ ⎝ 3056.96 ⎠ antC := ⎛ 218.690 ⎞ ⎜ ⎝ 217.625 ⎠ j := 1 .. 2 ⎡ Psat( j , T) := exp⎢ antA − ⎢ ⎣ T := 450 ⋅ °K T °K j ⎤ ⎥ ⋅ kPa ⎛ T − 273.15⎞ + antC ⎥ ⎜ j⎦ ⎝ °K ⎠ antB j <- temperatura de la mezcla Psat( j , T) = 1051.3097 − 273.15 = 176.85 °C 484.2304 kPa x 1, 1 x 1, i := 0 i := 2 .. 11 = x 2, i 0 1 0.1 0.9 0.2 0.8 0.3 0.7 0.4 0.6 0.5 0.5 0.6 0.4 0.7 0.3 0.8 0.2 0.9 0.1 1 0 1.1 .10 x 1, i := x 1 , i− 1 + 0.1 i := 1 .. 11 x i ∑ x ⋅ Psat( j , T) j, i j= 1 x y j, i := ⋅ Psat( j , T) j, i P i y 1, i = y 2, i = 1 0 1 1 4.779 0.194 0.806 2 5.339 0.352 0.648 3 5.899 0.482 0.518 4 6.458 0.591 0.409 5 7.018 0.685 0.315 6 7.578 0.765 0.235 7 8.137 0.835 0.165 8 8.697 0.897 0.103 9 9.257 0.951 0.049 10 9.816 1 0 P = i atm 11 10.376 T = 450 K 6 9 .10 5 8 .10 5 7 .10 5 6 .10 5 5 .10 5 4 .10 1, i 2 P := 6 Pi := 1 − x = 1 .10 Pi 2, i 5 0 0.2 0.4 x1 , i , y1 , i 0.6 0.8 1 Psist := 5 ⋅ atm Tsat := j antB ⎡⎡ ⎤ ⎤ j − antC ⎥ + 273.15⎥ ⋅ °K ⎢⎢ j ⎢⎢ ⎛⎜ antA − ln⎛⎜ Psist ⎞ ⎞ ⎥ ⎥ j ⎣⎣ ⎝ ⎝ kPa ⎠ ⎠ ⎦ ⎦ Tsat = ⎛ 413.473 ⎞ K °C ⎜ ⎝ 452.312 ⎠ 2 1 10 T := Tsat , Tsat + delT .. Tsat 1 x1( T) := Tsat − Tsat delT := 1 2 ( Psist − Psat( 2 , T) ) p1( x , T) := x ⋅ Psat( 1 , T) ( Psat( 1 , T) − Psat( 2 , T) ) p2( x , T) := ( 1 − x ) ⋅ Psat( 2 , T) P( x , T) := p1( x , T) + p2( x , T) y1( x , T) := 460 450 440 T T 430 420 410 0 0.2 0.4 0.6 0.8 1 0.8 1 x1( T) , y1( x1( T) , T) 1 0.8 y1( x1( T) , T) 0.6 x1( T) 0.4 0.2 0 0 0.2 0.4 0.6 x1( T) , x1( T) Psat( 1 , T) P( x , T) ⋅x