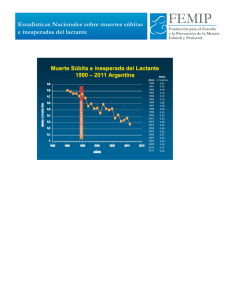
Muerte súbita o abortada
Anuncio

CAPÍTULO 16 Muerte súbita o abortada López Abel, Bernardo 16.1. Introducción 1. Episodio aparentemente letal: episodio agudo en un lactante, consistente en una combinación de apnea (central u obstructiva), cambios de coloración (lo más frecuente palidez, otras veces cianosis o eritema), y cambios del tono muscular (hipotonía), que requiere la intervención del observador para restaurar la respiración normal. 2. Muerte súbita: la Organización Mundial de la Salud la define como muerte natural en las 24 horas siguientes al inicio de los síntomas independientemente de la causa. 3. Síndrome de Muerte Súbita del Lactante (SMSL): muerte súbita de un niño menor de un año de edad, cuyas causas permanecen inexplicadas tras una investigación del caso, incluyendo una autopsia completa, un examen de la escena de la muerte y una revisión de la historia clínica. 4. Muerte súbita cardiaca (MSC): muerte abrupta, inesperada, debida a una causa cardiovascular, que ocurre en ausencia de otra condición potencialmente fatal. El término súbito se refiere habitualmente a 1 hora desde el inicio de los síntomas hasta la muerte o daño neurológico irreversible. Aunque la mayoría de las MSC se producen en adultos por enfermedad coronaria, cada vez se reconocen más casos en gente joven, en relación con deporte, en pacientes intervenidos de cardiopatías congénitas, y algunos casos englobados en el Síndrome de la Muerte Súbita del Lactante (SMSL). 16.2. Síndrome de muerte súbita del lactante y cardiopatía Aunque por definición el SMSL no muestra datos causales en la necropsia, estudios más exhaustivos muestran que aproximadamente un 10% pueden ser de origen cardiaco, fundamentalmente por arritmias primarias o secundarias a otros procesos. La mayoría presenta una cardiopatía estructural de base, sobre las que probablemente actúan factores desencadenantes como isquemia miocárdica (anomalías de de las arterias coronarias), alteraciones metabólicas, anemia, fármacos, o alteraciones del tono del sistema vegetativo durante el sueño (hipertono vagal con bradicardia-asistolia, o simpático con fibrilación ventricular). Un diagnóstico precoz de la cardiopatía podría prevenir gran parte de estos episodios. 16.3. Valoración del paciente con antecedente de episodio aparentemente letal La incidencia de ALTE supone un 0,6 a 2,46 por 1.000 nacidos vivos, con una edad media de 8 semanas y similar incidencia para ambos sexos. En un 50% de los casos nunca se encuentra una causa aparente. En el otro 50%, las causas más frecuentes son reflujo gastroesofágico (RGE), convulsiones, e infección respiratoria baja. Otras menos comunes, pero potencialmente tratables son aspiración, anomalías metabólicas, maltrato, apnea y arritmias. Dado que el RGE es muy frecuente en el lactante, solo el hallazgo de leche o contenido alimenticio en boca o nariz durante el episodio, debe hacernos considerar este diagnóstico como causa del ALTE. En la anamnesis debe averiguarse si se trata de una verdadera apnea (> 20 segundos), dado que episodios de respiración superficial, respiración periódica y pausas de apnea breves pueden ser normales en el recién nacido. Si la apnea fue central (sin esfuerzo respiratorio) u obstructiva (tos, atragantamiento, estridor o gasping). Las centrales orientan a causas neurológicas, cardiacas, metabólicas o infecciosas, mientras que 159 160 Cardiología Pediátrica en Atención Primaria las obstructivas a RGE, infección respiratoria, cuerpo extraño, sofocación o anomalía anatómica de la vía aérea. Debe interrogarse sobre cambios de coloración (cianosis, acrocianosis, palidez, enrojecimiento). La exploración física debe ser completa, incluyendo inspección en busca de traumatismos, auscultación pulmonar y cardiaca, pulsos, examen de vía aérea (restos alimenticios, cuerpo extraño) y estado neurológico. Entre las pruebas complementarias a realizar se encuentran despistaje de RGE, de infección sistémica o pulmonar, electrolitos, metabolopatías, análisis toxicológicos, ECG, EEG, monitorización cardiorrespiratoria y neuroimagen. Estudio inicial ante un ALTE • Anamnesis: – ¿Apnea real? (> 20 segundos). – Central u obstructiva. – Cambios de coloración. – Tono muscular, movimientos anormales. • Exploración física completa (atención especial a: traumatismos, restos lácteos en via aérea, respiratorio, cardiovascular y neurológico). • Pruebas complementarias iniciales: – Despistaje infección: hemograma, PCR, Procalcitonina, Orina elemental Cultivos, Radiografía de tórax). – Metabólico: Glucosa, Electrolitos, Lactato, Amonio. – ECG. – EEG. • Pruebas de segunda línea (según sospecha): – Estudios metabólicos específicos. – Análisis toxicológicos. – Polisomnografía. – Estudio cardiológico. – Técnicas de Neuroimágen (ecografía transfontanelar, RMN). En muchos de estos pacientes se indica monitorización domiciliaria. Su uso tiene un valor ambivalente de tranquilizar a la familia y generar stress, además de su coste económico. No existe evidencia de que reduzca la incidencia de SMSL. De hecho, la Academia Americana de Pediatría establece su recomendación solo en dos grupos de niños: prematuros con alto riesgo de apnea, bradicardia o hipoxemia, y lactantes dependientes de tecnología, via aérea inestable, enfermedades que afectan a la regulación de la respiración o enfermedad pulmonar crónica sintomática. 16.4. Muerte súbita y práctica deportiva La muerte súbita durante la actividad deportiva genera una fuerte preocupación en la opinión pública en nuestros días. La fuerte influencia social de los deportistas de élite Muerte súbita o abortada 161 en nuestra cultura, unida a su papel como modelos de salud, hacen poco comprensible la noticia del fallecimiento realizando deporte. Esto genera múltiples consultas de los padres para asegurarse de que su hijo puede realizar deporte con seguridad. Desgraciadamente no existe actualmente un protocolo que confiera una garantía de riesgo cero. El número de jóvenes que practican en la actualidad un deporte federado es muy alto, lo que hace impracticable económicamente la realización de muchos tests diagnósticos a gran escala. Las recomendaciones de reconocimento previo al deporte de competición son muy variables en distintos países, dependiendo de criterios fundamentalmente económicos, pero también de prevalencia de determinadas patologías e incluso de aceptación por parte de los deportistas, que pueden considerar una intromisión en su vida privada. En los protocolos americanos se realiza solamente una anamnesis y exploración física completa, pero no incluyen la realización generalizada de ECG. En el otro extremo las recomendaciones italianas contemplan además la inclusión de un ECG en todos los candidatos, ecocardiografía y una prueba de esfuerzo submáxima. Las series publicadas en EEUU muestran como causas mas frecuentes la miocardiopatía hipertrófica y las anomalías en las arterias coronarias, suponiendo entre ambas dos tercios de los casos. En cambio en Italia y España, la causa mas frecuentemente reconocida es la displasia arritmogénica de ventrículo derecho, con un 22%. En la serie española más amplia (Suárez-Mier y Aguilera, 2002), más del 30% de los casos de muerte súbita deportiva quedaron sin diagnóstico causal. La realización de un ECG y una Ecocardiografía aumentaría mucho la sensibilidad a la hora de detectar éstas y otras patologías. Por otro lado, muchas situaciones de riesgo pueden tener un número importante de falsos negativos. Por ejemplo, un ECG basal puede en algunos momentos no mostrar conducción anómala por un haz de Kent, y no llegar a un diagnóstico de síndrome de Wolff-Parkinson-White. Una miocardiopatía hipertrófica de base genética presenta un desarrollo evolutivo, pudiendo no mostrar datos a edades tempranas en el ECG ni en una ecocardiografía reglada, pero sí en fases tardías La expresión electrocardiográfica de un síndrome de QT largo es muy variable en el tiempo, y presentar modificaciones ambientales por factores como fármacos. La displasia arritmogénica de ventrículo derecho en estadios precoces puede escapar al ECG y a la ecocardiografía, y ser solo reconocibles mediante Resonancia magnética cardiaca. Sin embargo, existen muchos datos en la anamnesis y la exploración física de gran utilidad en la valoración previa al deporte de un paciente. Además, en la mayoría de las series, la causa más frecuente de MSC durante el deporte es la miocardiopatía hipertrófica. En esta patología, el ECG basal de 12 derivaciones es anormal en el 95% de los casos. Dado que además ayuda en el diagnóstico de otras patologías causales, parece prudente su inclusión en los programas de screening. El abordaje idóneo en este momento consiste en identificar al mayor porcentaje de individuos de riesgo con métodos de accesibilidad tal que puedan aplicarse a grandes grupos de población. ¿Cómo identificar los pacientes de riesgo de MSC deportiva? La Sociedad Europea de Cardiología propuso en 2005 un protocolo de screening previo a la participación de atletas jóvenes, basado en la anamnesis familiar y personal, exploración física, y ECG de 12 derivaciones. Un screening negativo permite la práctica deportiva. Si es positivo, debe referirse para una evaluación ulterior. 162 Cardiología Pediátrica en Atención Primaria Figura 16.1. Algoritmo de identificación del paciente de riesgo. Modificado de Corrado et al, 2005. 1. Historia familiar: a. Familiares cercanos con ataque cardiaco o muerte súbita temprana (< 55 años en varones y < 65 en mujeres). b. Familiares afectos de: – Cardiomiopatía. – Síndrome de Marfan. – Síndrome de QT largo. – Síndrome de Brugada. – Arritmias severas. – Otras causas cardiovasculares incapacitantes. 2. Historia personal: a. Molestias o dolor precordial con esfuerzo. b. Síncope o pre síncope. c. Palpitaciones o sensación de disrritmia. d. Disnea o fatiga desproporcionada al esfuerzo. Continúa Muerte súbita o abortada 163 3. Exploración física: a. Datos sugestivos de síndrome de Marfan. b. Soplo cardiaco significativo. c. Clicks sistólicos. d. Desdoblamiento fijo y amplio del segundo tono. e. Pulsos femorales disminuidos o retrasados. f. Ritmo cardiaco irregular. g. HTA en más de una toma. 4. Criterios de ECG positivo: a. Onda P: – Crecimiento AI: porción negativa en V1 > 0,1 mV y > 0,04s. – Crecimiento AD: picuda en II y III o > 0,25 mV en V1. b. QRS: – Desviación de eje derecha > 120º o izquierda de –30º a –90º. – Aumento del voltaje: R o S en derivaciones estándar > 2 mV, S en V1-2 > 3 mV o R en V5-6 > 3 mV. – Q > 0,04 s o > 25% de R o patrón QS en dos o más derivaciones. – BRD o BRI con QRS > 0,12 s. – R o R´ en V1 > 0,5 mV y R/S > 1. c. Repolarización: – Segmento ST deprimido o onda T aplanada o invertida en dos o mas derivaciones. – QTc > 0,44 s en varones o > 0’46 s en mujeres. d. Anomalias en el ritmo o la conducción: – Extrasístoles o arritmias ventriculares. – Taquicardias supraventriculares, flutter o fibrilación auricular. – PR < 0,12 ms con o sin onda delta. – Bradicardia sinusal con ritmo en reposo < 40 lpm. – Bloqueo AV de primer, segundo o tercer grado. 16.5. Muerte súbita y cardiopatías Se pueden distinguir dos situaciones con causas bien diferenciadas de MSC: algunas cardiopatías no operadas presentan un riesgo significativo (estenosis aórtica, anomalías de las arterias coronarias congénitas y adquiridas, e hipertensión pulmonar), y otro grupo de cardiopatías congénitas intervenidas, en las que la MSC tardía es un riesgo significativo. Destacan la tetralogía de Fallot, Transposición de los grandes vasos, estenosis aórtica y Coartación de aorta. Estenosis aórtica El mecanismo fundamental es la isquemia miocárdica que conlleva arritmias ventriculares. Son datos de riesgo: síncope, disnea de esfuerzo, dolor torácico, hallazgo de obstrucción severa del tracto de salida del ventrículo izquierdo, y ECG con sobrecarga de presión. 164 Cardiología Pediátrica en Atención Primaria Anomalías de las arterias coronarias La forma congénita más común es el origen de la arteria coronaria izquierda común del seno de Vasalva derecho. Durante el ejercicio, la expansión de la arteria pulmonar y la aorta puede comprimir esta arteria produciendo isquemia miocárdica y arritmia ventricular. Cuando el origen de una arteria coronaria está en la pulmonar, el cuadro es más severo y suele debutar durante los primeros meses de vida con fallo congestivo, aunque raros casos pueden llegar sin diagnóstico a la adolescencia. La enfermedad de Kawasaki, puede presentar MSC en fase aguda por rotura de aneurisma coronario y por miocarditis, pero también puede ser tardía por afectación coronaria e isquemia. Otra causa de alteración coronaria adquirida es una vasculopatía en algunos pacientes portadores de transplante cardiaco. Hipertensión pulmonar Tanto en su forma primaria como en el síndrome de Eisenmenger, la MSC es una causa frecuente de riesgo, especialmente durante el embarazo, ejercicio físico, cirugía no cardiaca y si viven en zonas de mucha altitud. Tetralogía de Fallot intervenida Son datos de riesgo en estos pacientes la sobrecarga de volumen del ventrículo derecho por regurgitación pulmonar, un QRS prolongado (> 180 ms), y una historia de síncope previo o palpitaciones sostenidas. Algunos de estos pacientes pueden beneficiarse de cirugía posterior de las lesiones residuales. Cuando esto no es posible puede estar indicada un desfibrilador implantable. Transposición de las grandes arterias Los pacientes intervenidos con cirugías de corrección atrial (Mustard y Senning), más usadas en el pasado, presentan riesgo de flutter y fibrilación auricular. Una conducción 1:1 de un flutter puede producir MSC por bajo gasto e isquemia miocárdica. Los paciente más jóvenes fueron intervenidos en su mayoría mediante switch arterial. Todavía no existen datos a suficiente largo plazo de esta técnica, pero potencialmente podrían existir problemas a largo plazo derivados de la reimplantación de las arterias coronarias que se realiza en esta técnica. Coartación de aorta intervenida Puede producirse MSC por rotura de aneurisma bien en la aorta nativa o en el parche quirúrgico. También existe asociación con malformaciones vasculares cerebrales, con riesgo de ruptura. El ventrículo izquierdo puede presentar disfunción e hipertrofia, con riesgo de arritmia ventricular. Otras enfermedades más infrecuentes Anomalía de Ebstein, y transposición corregida de las grandes arterias. 16.6. Bibliografía Corrado D, Pelliccia A, Bjørnstad HH, Vanhees L, Biffi A, Borjesson M et al. Study Group of Sport Cardiology of the Working Group of Cardiac Rehabilitation and Exercise Physiology and the Working Group of Myocardial and Pericardial Diseases of the European Society of Cardiology. Cardiovascular pre-participation screening of young competitive athletes for prevention Muerte súbita o abortada 165 of sudden death: proposal for a common European protocol. Consensus Statement of the Study Group of Sport Cardiology of the Working Group of Cardiac Rehabilitation and Exercise Physiology and the Working Group of Myocardial and Pericardial Diseases of the European Society of Cardiology. Eur Heart J. 2005 Mar;26(5):516-24. Fu LY, Moon RY. Apparent life-threatening events (ALTEs) and the role of home monitors. Pediatr Rev. 2007 Jun;28(6):203-8. Grupo de Trabajo para el Estudio y Prevención de la Muerte Súbita Infantil de la Asociación Española de Pediatría. Patología cardiogénica y MSL [Internet]. En: Libro blanco de la Muerte Súbita del Lactante. 2ª ed. 2003. Disponible en: http://www.aeped.es/gepmsl/libro_blanco_2003.htm. Silka MJ, Bar-Cohen Y. Sudden Cardiac Death. En: Allen HD., Driscoll DJ., Shaddy RE., Feltes TF. Moss and Adams´ Heart Disease in Infants, Children and Adolescents. 7ª ed. Philadelphia: Lippincott Williams & Wilkins, 2008; 342-359.