IRAC 2013 CLASIFICACIÓN, MICROMANIPULACIÓN Y CONGELADO DE
Anuncio

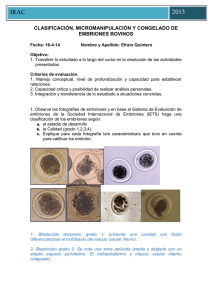
IRAC 2013 Espec CLASIFICACIÓN, MICROMANIPULACIÓN Y CONGELADO DE EMBRIONES BOVINOS Fecha: 15/10/2013 Nombre y Apellido: Rafael Ferro Objetivo: 1. Transferir lo estudiado a lo largo del curso en la resolución de las actividades presentadas. Criterios de evaluación: 1. Manejo conceptual, nivel de profundización y capacidad para establecer relaciones. 2. Capacidad crítica y posibilidad de realizar análisis personales. 3. Integración y transferencia de lo estudiado a situaciones concretas. 1. Observe las fotografías de embriones y en base al Sistema de Evaluación de embriones de la Sociedad Internacional de Embriones (IETS) haga una clasificación de los embriones según: a. el estadio de desarrollo b. la Calidad (grado 1,2,3,4). c. Explique para cada fotografía la/s característica/s que tuvo en cuenta para calificar los embrión. 1a) Estadio de desrrollo: 4 (Morula) Calidad: Grado 1 (Bueno) Posee mas del 85% del Macizo Celular Interno intacto, embrión esférico, color y tamaño celular uniforme. 1b) Estadio de desarrollo: 6 (Blastocisto) Calidad: Grado 2 (Regular) Posee entre el 50 y 84% del MCI. Se observa células sueltas, se visualiza un adelgazamiento de la zona pelúcida. IRAC Espec 2013 1c) Estadio de desarrollo: 3 (Morula temprana) Calidad: Grado 1 (Excelente) Se observa el MCI casi en un 100%, rodeado por la membrana intacta. 1d) Estadio de desarrollo: 4 (Morula) Calidad: Grado 2 (Regular) Posee aproximadamente el 60% del MCI, se observa una blastomera de gran tamaño y vesciculas. 1e) Estadio de desarrlo: 4 (Morula) Calidad: Grado 3 (malo) Posee al menos 5 blastomeras sueltas, células de diferente tamaño. IRAC Espec 2013 1f) Infertilizado Se observa una masa de aspecto granular, con puntillado rodeado por una membrana vitelina lisa. 1g) Estadio de desarrollo: 7 (Blastocisto expandido) Calidad: Grado 1 (Bueno) Posee el 85% del MCI, además se observa el blastocele y la zona pelucida sin alteraciones. Lo único que es llamativo es en la región inferior una deformación del MCI. 2. Realice una comparación entre el método de congelado y la vitrificación de embriones teniendo en cuenta: medios de congelado, toxicidad, curva de congelado, método de descongelado y practicidad (costos, entrenamiento, etc.). Respuesta: Método Tradicional de Congelado Existen dos tipos de crioprotectores: Intra y extracelulares. IRAC Espec 2013 Los intracelulares son mas importante y mas utilizados, evitando la formación de cristales de hielo intracelulares como asi también toxicidades o cualquier cambio osmótico perjudicial para las células criopreservadas. Son sustancias de bajo peso molecular y permeables a la membrana celular. Como ejemplos podemos citar DMSO, Etilenglicol, Glicerol, PROH, Amidas. Por su parte los extracelulares son macromoléculas de alto peso molecular no permeables a la membrana celular. Ejercen su función modificando la viscosidad de las soluciones. Se los puede dividir en dos grupos: Sacáridos (Galactosa, Glucosa, Sacarosa, Trealosa, y algunos otros azucares) y Poíimeros (Polivinilpirrolidona, Alcohol polivinilico, Almidón hidroxietilico, Hialuronidato de sodio). A grandes rasgos los crioprotectóres intracelulares remplazan osmóticamente el agua que esta dentro de la celula a congelar (células embrionarias) antes de que se produzca la congelación en si. La combinación de un congelado lento reduce los cambios de volumen de las células y disminuye significativamente la formación de cristales de hielo intracelulares. En cambio los crioprotectores extracelulares al tener alto peso molecular alteran la formación de cristales de hielo en cuanto al tamaño y forma de los mismos y asi protegen a las células de los embriones durante el proceso de congelado-descongelado. Es sabido que a fines practicos el método tradicional de congelamiento embrionario utiliza solo dos crioprotectores: Glicerol o Etilenglicol. Actualmente la mayoría de los embriones que son sometidos a algun proceso de criopreservación, la misma se realiza a través del método tradicional, utilizando para esto crioprotectores permeables (EG o GLY), con tasas de congelación lentas y descongelados rapidos. Los pasos o protocolo de congelamiento lento tradicional son los siguientes: 1) Se expone al embrión al crioprotector con temperatura ambiente (22ºC) hasta llegar a lograr un equilibrio entre la solución crioprotectora y el embrión. 2) Seeding→ Formacion de cristales de hielo a temperatura entre – 5ºC y – 7ºC. 3) Luego se procede a descender la temperatura lentamente a razón de 0,31ºC por minuto hasta llegar a -30ºC o -35ºC. 4) Congelar el embrión a -196ºC en Nitrogeno liquido. Por lo tanto la congelación por métodos tardicionales debe ser lenta. Los pasos o protocolo de descongelamiento tradicional son los siguientes: 1) Se prepara baño maria, con gua a 25ºC con una velociad de descongelado de 250ºC por minuto. 2) Se remueve el crioprotector a temperatura ambiente. IRAC Espec 2013 3) Carga del embrión en la pistola de transferencia y finalmente siembra (transferencia en si) del embrión en el tercio distal del cuerno uterino ipsilateral al cuerpo luteo ovárico (dia 7 del ciclo estral de la receptora). Inversamente a lo que sucede con la congelación, el descongelado debe ser rápido evitando asi la recristalizacion. Para esto se deben colocar las pajuelas a baño maria durante 15-30 segundos. Para evitar dañar la zona pelucida es recomendable mantener la pajuela (0,25) en el aire a temperatura ambiente durante 10 segundos y luego sumergirlas en el baño maria. Una vez que se a descongelado el embrión, debemos retrirar el crioprotector intracelular. Para esto podemos optar por colocar al embrión en soluciones decrecientes de Glicerol o en soluciones concentradas de algún crioprotector no permeable (ej. Sacarosa). La razón por la cual se realiza esto y de forma muy controlada es porque si colocásemos al embrión congelado en Glicerol en el medio de mantenimiento, por diferencia de osmolaridad el agua entraría violentamente a la celula (mayor concentración de solutos intracelulares), esto produciría la dilatación celular, alterando la membrana celular y su posterior ruptura. Para esto en la actualidad se cuenta con dos métodos, resumidos brevemente a continuación: Metodo A Colocar el embrión en un crioprotector no permeable (Sacarosa 1 Molar) durante 10 minutos. La sacarosa no penetra a la celula y actua osmóticamente sobre el Glicerol, esto quiere decir que genera la salida del Glicerol hacia el medio extracelular, el embrión se contrae. A los 10 minutos se coloca al embrión en el medio de mantenimieto (300 miliosmoles por litro), permitiendo el ingreso de agua hacia el interior de la celula, asi el embrión retoma su tamaño normal. Metodo B Se deben colocar a los embriones en tres soluciones decrecientes de Glicerol pero con Sacarosa a concentración constante. 1) Embrion en GLY 0,75 M y sacarosa 0,3 M durante 5 minutos. 2) Embrion en GLY 0,375 M y sacarosa 0,3 M durante 5 minutos. 3) Embrion en sacarosa 0,3 M durante 5 minutos. 4) Se coloca al embrión en el medio de mantenimiento, se carga en la pajuela y se transfiere. En el caso de los embriones congelados con Etilenglicol (EG) el protocolo seria el el siguiente: Congelado con Etilenglicol: 1) Clasificacion embrionaria 2) Lavado embrionario según normas IETS, se vuelven a clasificar 3) Colocar los embriones en EG 1,5 M y cargar la pajuela (5-10 minutos a temperatura ambiente) IRAC Espec 2013 4) Colocar pajuelas en la congeladora a -5ºC a -7ºC durante 1-2 minutos 5) Seeding 6) Congelar a 0,6ºC/minuto hasta alcanzar -35ºC 7) Colocar las pajuelas en el Nitrogeno liquido Descongelado con Etilengicol: 1) Sacara pajuela y colocarla en baño maria (30ºC) hasta que se produzca el descongelado de la misma 2) Secar la pajuela, carga la pistola de trasferencia y transferir el embrión dentro de los 15 minutos pos-descongelado. El Etilenglicol tiene como principal ventaja la transferencia directa de los embriones sin que sea necesario sacar el crioprotector pos-descongelado. Por ende se descongela la pajuela en agua y se transfiere previa carga de la pistola, es un método simple, sencillo y que requiere poco instrumental. Vitrificacion Embrionaria Es un sistema de enfriamiento muy veloz, el cual se basa en la formacion de un estado físico vítreo de una solución. Se eleva considerablemente la viscosidad con la ventaja de NO generar cristalización. Al no producirse cristales se reduce las noxas químico-mecanicas producidas a consecuencia de los métodos tradicionales de congelamiento. Aunque los daños toxicos (debido a la alta concentración del crioprotector) y osmoticos (por alterarse el volumen celular) si se pueden producir. Para reducir la toxicidad de los crioprotectores se puede utilizar crioprotectores de baja toxicidad, bajos volúmenes de solución, disminuir el tiempo de exposición del embrión, etc. Tambien la asociación de dos crioprotecores a dado buen resultado al respecto (ej. EG + DMSO). Las principales variables que hacen al éxito de un protocolo de vitrificación son el Tiempo y la Temperatura de exposición de embrión al crioprotector, siendo estos dos elementos los responsables de los posibles efectos toxicos y osmóticos anteriormente descripto. La curva de enfriamiento deberá ser mas rápida que el método tradicional ya demás se utilizan mayores concentraciones de crioprotectores (4-8 M). Es posible lograr la vitrificación a una concentración 1,5 M del crioprotector y con una tasa de enfriamiento de 15.000ºC por minuto. Muchos sistemas se han diseñado para logra este fin con resultados sumamente variables. Sin lugar a duda que el tamaño del envase ha sido una de las principales limitantes a la hora de vitrificar embriones. La constante necesidad de reducir el tamaño del envase (pajuela) para de esta forma utilizar menores volumenes y asi poder reducir la velocidad de enfriamiento ha sido motivo de investigación y desarrollo por parte de muchas emprseas de biotecnología. Uno de los principales métodos es el llamado “OPS” open-pulled Straw, el cual conciste en la utilización de pajuela de 0,25 ml, esta se calienta y estira para reducir el grosor de sus pardes a la mitad. Se corta la pajuela, se pasa el embrión a una microgota (1 microlitro). El embrión ingresa a la pajuela por capilaridad, ya que anteriormente se redujo su grosor. Luego se coloca la pajuela sin cerrar en N2. IRAC Espec 2013 Protocolo de Vitrificacion OPS 1) Se expone al embrión a temperatura ambiente (20ºC) durante 1-3 minutos en una solución equilibrada (10% DMSO + 10% EG en PBSm, solución buffer fosfatada). 2) Se pasan los embriones la solución dos (solución de vitrificación propiamente dicha. 3) Colocar el embrión en una tercera microgota de 1 microlito durante 25 segundos entre gota y gota. Estas gotas están doblemente concentradas (20% DMSO + 20% EG en PBSm), son muy viscosas. 4) Se coloca la extremidad fina de las OPS en la ultima microgota, los embriones se almacenan en la parte inferior del envase. Luego se sumerge rápidamente el embrión en N2 a -196ºC, y finalmente estos pueden ir al termo para ser almacenados. En cuanto al proceso de descongelado se procede a exponer las OPS con gotas de 0,25 ml de sacarosa, permitiendo un gradual descongelado ya asi controlando el ingreso de agua intacelular. 3. Enumere al menos 3 factores importantes para la obtención de preñeces a partir de la transferencia de embriones micro manipulados (hemi-embriones) A) Estadio de desarrollo embrionario: Mejores resultados con Morulas. B) Procedimiento de corte es mas sencillo en la Morulas ya que se debe cortar el macizo celular interno (MCI) que son la blastomeras en dos mitades similares. En el caso de los Blastocistos a demás se debe seccionar en dos mitades el blastocele, por ende el sentido que le demos al corte con la cuchilla en este ultimo caso si es importante. C) Calidad embrionaria: Deben ser embriones de excelente o buena calidad ya que es imprescindible que tengan la mayor cantidad de células viables capaces de desarrollar un nuevo embrión. No nos podemos olvidar que el proceso de sección involucra la ruptura de algunas células, y la manipulación de por si afecta la unión de otras. D) Cultivar o mantener en el medio de laboratorio a los Hemi embriones durante una hora antes de proceder a transferirlos, para facilitar la union de las blastomeras. E) Diferencia de tamaño de los dos hemi embriones: Si esta diferencia es muy pequeña, entendiendo como tal 55 a 45 el resultado de preñez esperado será óptimo. Pero a medida que la diferencia se amplía la tasa de preñez se reduce. F) Cualquier factor que pudiese afectar la supervivencia y viabilidad de un embrión NO micromanipulado puede afectar la tasa de preñez cuando se utilizan hemi embriones.