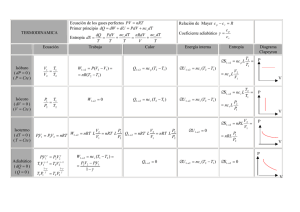
Representación gráfica de procesos de cuasi
Anuncio
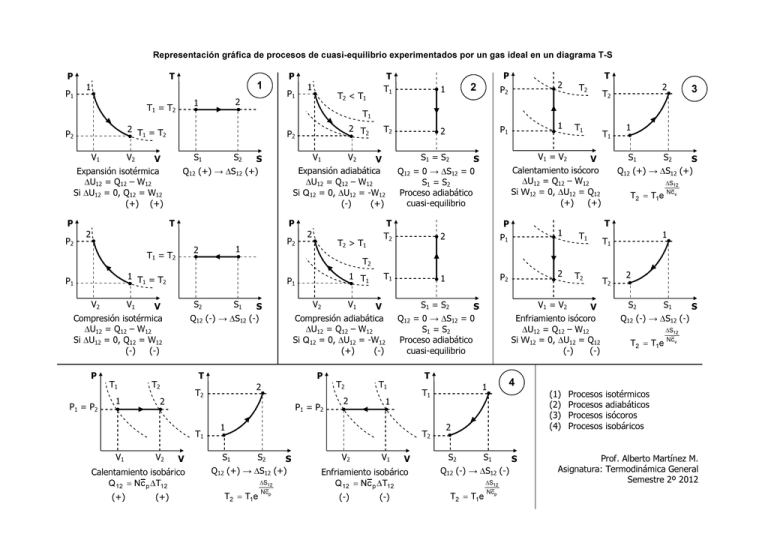
Representación gráfica de procesos de cuasi-equilibrio experimentados por un gas ideal en un diagrama T-S P P1 P T 1 1 V1 S1 V Expansión isotérmica ∆U12 = Q12 – W12 Si ∆U12 = 0, Q12 = W12 (+) (+) S2 Q12 (+) → ∆S12 T T1 = T2 V1 V Compresión isotérmica ∆U12 = Q12 – W12 Si ∆U12 = 0, Q12 = W12 (-) (-) P P1 = P2 1 P2 1 2 T2 2 V2 V Calentamiento isobárico Q 12 = N c p ∆T12 (+) (+) 2 2 T 2 P2 T2 2 T2 3 2 T2 > T1 1 P1 S1 = S2 T1 T1 V1 = V2 S1 V Calentamiento isócoro ∆U12 = Q12 – W12 Si W12 = 0, ∆U12 = Q12 (+) (+) S =0 Q12 = 0 → ∆S12 S1 = S2 Proceso adiabático cuasi-equilibrio T T2 2 P1 1 T1 1 P2 2 1 S2 S Q12 (+) → ∆S12 (+) T2 = T1e ∆S12 Nc v T P T1 1 T1 T2 1 T1 P1 S2 S1 Q12 (-) → ∆S12 S (-) V2 V1 V Compresión adiabática ∆U12 = Q12 – W12 Si Q12 = 0, ∆U12 = -W12 (+) (-) S1 = S2 P1 = P2 2 T1 1 1 T2 S1 S2 S Q12 (+) → ∆S12 (+) T2 = T1e ∆S12 Ncp V2 V1 V Enfriamiento isobárico Q 12 = Nc p ∆T12 (-) (-) 1 T1 S1 Q12 (-) → ∆S12 (-) T2 = T1e ∆S12 Ncp 2 S2 S1 S Q12 (-) → ∆S12 (-) ∆S12 T2 = T1e Nc v 4 (1) (2) (3) (4) 2 S2 T2 V Enfriamiento isócoro ∆U12 = Q12 – W12 Si W12 = 0, ∆U12 = Q12 (-) (-) T T2 T2 V1 = V2 S =0 Q12 = 0 → ∆S12 S1 = S2 Proceso adiabático cuasi-equilibrio P 2 T2 T1 V1 T2 V Expansión adiabática ∆U12 = Q12 – W12 Si Q12 = 0, ∆U12 = -W12 (-) (+) T T1 1 V2 P 1 T =T 1 2 V2 V1 S (+) 2 P1 2 T2 P2 V2 P T2 < T1 P T T1 T1 2 T =T 1 2 P2 P2 2 1 T1 = T2 P1 1 S Procesos Procesos Procesos Procesos isotérmicos adiabáticos isócoros isobáricos Prof. Alberto Martínez M. Asignatura: Termodinámica General Semestre 2º 2012