Tema 17
Anuncio
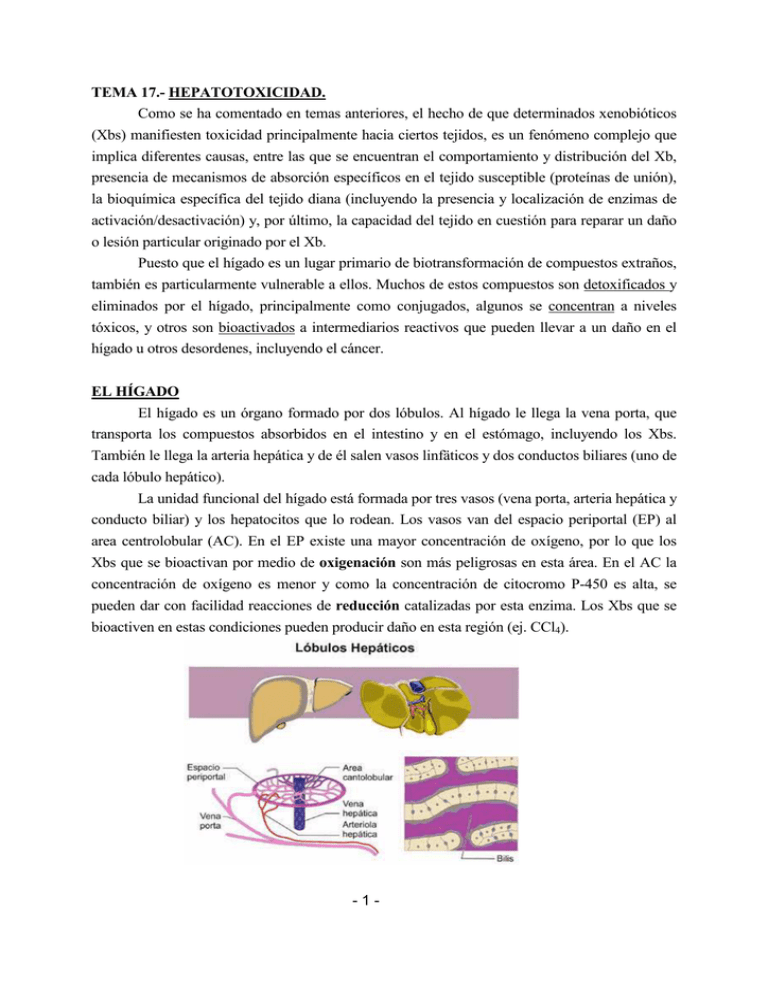
TEMA 17.- HEPATOTOXICIDAD. Como se ha comentado en temas anteriores, el hecho de que determinados xenobióticos (Xbs) manifiesten toxicidad principalmente hacia ciertos tejidos, es un fenómeno complejo que implica diferentes causas, entre las que se encuentran el comportamiento y distribución del Xb, presencia de mecanismos de absorción específicos en el tejido susceptible (proteínas de unión), la bioquímica específica del tejido diana (incluyendo la presencia y localización de enzimas de activación/desactivación) y, por último, la capacidad del tejido en cuestión para reparar un daño o lesión particular originado por el Xb. Puesto que el hígado es un lugar primario de biotransformación de compuestos extraños, también es particularmente vulnerable a ellos. Muchos de estos compuestos son detoxificados y eliminados por el hígado, principalmente como conjugados, algunos se concentran a niveles tóxicos, y otros son bioactivados a intermediarios reactivos que pueden llevar a un daño en el hígado u otros desordenes, incluyendo el cáncer. EL HÍGADO El hígado es un órgano formado por dos lóbulos. Al hígado le llega la vena porta, que transporta los compuestos absorbidos en el intestino y en el estómago, incluyendo los Xbs. También le llega la arteria hepática y de él salen vasos linfäticos y dos conductos biliares (uno de cada lóbulo hepático). La unidad funcional del hígado está formada por tres vasos (vena porta, arteria hepática y conducto biliar) y los hepatocitos que lo rodean. Los vasos van del espacio periportal (EP) al area centrolobular (AC). En el EP existe una mayor concentración de oxígeno, por lo que los Xbs que se bioactivan por medio de oxigenación son más peligrosas en esta área. En el AC la concentración de oxígeno es menor y como la concentración de citocromo P-450 es alta, se pueden dar con facilidad reacciones de reducción catalizadas por esta enzima. Los Xbs que se bioactiven en estas condiciones pueden producir daño en esta región (ej. CCl4). -1- FUNCIONES DEL HIGADO El hígado tiene tres tipos de funciones básicas que son: 1. Vasculares (almacenamiento y filtración) 2. Metabólicas (metabolismo de hidratos de carbono, lípidos y proteínas) 3. Secretoras y excretoras encargadas de formar bilis. Es un órgano muy propenso a sufrir daños por la exposición a tóxicos debido a que los dos sistemas circulatorios pueden llevar al hígado sustancias tóxicas o que se bioactiven en este órgano. El tejido hepático posee una elevada capacidad de regeneración, las células necróticas se eliminan por autolisis y las que quedan se dividen rápidamente. TRANSFORMACIONES METABOLICAS Las transformaciones metabólicas de los Xbs que tienen lugar en el hígado están principalmente asociadas a las enzimas microsómicas, es decir, a las enzimas que se encuentran en el retículo endoplásmico. Entre las reacciones catalizadas por enzimas microsómicas se encuentran: Oxidación Reducción Hidrólisis Desalquilación Desaminación Deshalogenación Formación de anillos Escisión de anillos Conjugación La hidrólisis y la conjugación no son reacciones asociadas con el sistema de la citocromo P450. FACTORES QUE PREDISPONEN AL HIGADO A SUFRIR TOXICIDAD Resumiendo lo anteriormente expuesto, son varios los factores que intervienen, entre ellos destacamos tres, cuya combinación expone al hígado a la toxicidad: • Recibe una gran cantidad de sangre que puede ser portadora de tóxicos, sobre todo la vena portal que transporta los Xbs absorbidos en el tracto gastrointestinal (vía de ingreso de los Xbs que penetran al organismo por vía oral). • La elevada capacidad de biotransformación y diversas concentraciones de oxígeno hacen que tengan lugar tanto reacciones de reducción como de oxidación de diversos Xbs. • La función excretora que hace que se concentren Xbs. COMPUESTOS QUE CAUSAN DAÑO HEPÁTICO El tetracloruro de carbono (CCl4) pertenece al grupo de los hidrocarburos halogenados, es poco soluble en agua y su descomposición térmica produce Fosgeno (Cl2CO), el cuál es un tóxico respiratorio. Se usa como disolvente (aceites, grasas, ceras y limpieza en seco) y, aunque se usa poco por sus propiedades cancerígenas, es quizás el hepatotóxico mejor estudiado y conocido entre aquellos Xbs que se sabe causan daño hepático. Es por ello que se detallan a continuación los efectos hepatotóxicos que se producen como consecuencia del metabolismo de dicho compuesto. -2- Hexacloroetano Unión a componentes de los tejidos Peroxidación lipídica Cloroformo He xacl or oe tano Unión a componentes de los tejidos Unión a c omponentes de l os tejidos Per oxidaci ón li pídi ca Cl or oformo Fo Diglutationilditio carbonato Unión a c om pone nte s de l os tejidos Diglutati onildi tio carbonato Ác ido 2-oxo-tiazoli dina-4c ar boxíl ic o sg Ácido 2-oxo-tiazolidina4-carboxílico CCl4 Radicales libres Peroxidación lipídica Lisosomas Núcleos RE Agregación de cromatina Ruptura Liberación de hidrolasas Cariolisis Polisomas separados Síntesis de proteínas Membrana celular Mitocondrias bomba de Na Hinchamiento Interrupción de Acumulación de Ca la membrana cel. Acumulación de grasa Concentración ATP Residuos de membrana MUERTE -CELULAR 3- Residuos de membrana OTROS XENOBIÓTICOS QUE SE SABE PRODUCEN DAÑO HEPÁTICO: COMPUESTOS METALES INDUSTRIALES PVC, Cloroformo Mercurio (afinidad por -SH) Dimetilformamida Hierro Trinitrotolueno Cobre Insecticidas clorados Vanadio Policlorodibenzo dioxinas (PCDD) y Niquel PCBs El cloruro de vinilo (VC) es un químico sintético que se polimeriza para la obtención de policloruro de vinilo (PVC). A temperatura ambiente, es un gas incoloro, de olor dulce y poco soluble en agua. Es rápida y eficientemente absorbido en humanos y animales por inhalación y vía oral, y se convierte rápidamente en sus metabolitos solubles en agua, por lo que se excreta rápidamente. Su metabolismo parece ser que tiene lugar por dos vías saturables: CLORURO DE VINILO P450 (CYP2E1 y 2B1) EPOXIDO CLOROETILENO CO2 EPOXIDO HIDROLASA GSH CONJUGADOS DE GLUTATION ADUCTOS DE DNA CLOROACETALDEHIDO GSH ADUCTOS EN TEJIDOS Los solventes orgánicos son componentes de pinturas, plásticos, pegamentos, y muchos otros productos industriales. La dimetilformamida es muy utilizada en la manufacturación de productos de poliuretano y fibras acrílicas. El trinitrotolueno (TNT) y algunos insecticidas clorados, son ampliamente usados en la industria y agricultura. Los hidrocarburos halogenados (incluyendo los PCBs) suprimen la excreción biliar de sustancias al interferir con los procesos productores de energía de las células. Esta supresión puede ser también causada por una inhibición de la biotransformación o por la administración de anestésicos (p. ej. dietil eter). -4- Los metales pesados y sus derivados tienen afinidad por grupos sulfhidrilo libres del GSH, aminoácidos y proteínas (enzimas). La exposición a los metales pesados (como el Hg) puede reducir drásticamente la reserva de grupos SH disponibles y producir estrés oxidativo. La unión de metales pesados a SH de proteínas puede también causar inhibición no competitiva de muchas enzimas. Hierro y otros metales de transición.- El hígado es el principal sitio de almacén de hierro por lo que es susceptible de daño por sobrecarga. El hierro y otros metales pesados (cobre, vanadio, níquel) generan especies reactivas de oxígeno, con lo que incrementan la peroxidación lipídica de las membranas hepáticas y la disfunción mitocondrial. RECEPTORES ACTIVADOS POR PROLIFERADORES PEROXISOMALES (PPARS) Los PPARS se han relacionado en animales de laboratorio (roedores) con carcinomas hepáticos (metástasis). No se conoce todavía su mecanismo de acción, pero no son mutagénicos (test de Ames, tema 18) y no se unen directamente al ADN ni lo daña, por lo que se consideran no geno-tóxicos y se clasifican como una nueva clase de carcinógenos químicos epigenéticos (tema 19). Son un subtipo de receptores nucleares, descubiertos hace apenas una década, que se activan por un grupo de agentes químicos no relacionados estructuralmente, como son drogas hipolipidémicas, esteres de ftalato y disolventes halogenados. Forman heterodímeros con receptores retinoicos X (RXRs) y estos heterodímeros regulan la transcripción de varios genes mediante interacción con elementos de respuesta específicos de los PPs (PPREs) localizados corriente arriba de genes de respuesta. PPRE Hay tres subtipos de PPARs conocidos, cada uno de ellos con una función diferente: PPAR-α * Catabolismo lipídico PPAR-β PPAR-γ * Metabolismo lipídico básico -5- *Diferenciación adipocitos * Apoptosis Algunos genes de respuesta que se sabe contienen motivos PPRE, incluyen los de la acilCoA oxidasa (enzima limitante de la β-oxidación peroxisomal), el de la proteína que une ácidos grasos en el hígado (L-FABP) y CYP4A6 microsomal (una citocromo P450 acido graso whidroxilasa). Dado que los productos de estos genes están implicados en algún aspecto del metabolismo de ácidos grasos, los PPARs juegan un papel importante en mediar la acción de los PPs y en regular la homeostasis lipídica. POTENCIACION Y ANTAGONISMO DE XENOBIOTICOS EN EL HIGADO En el hígado, especialmente, puede darse el efecto de potenciación y antagonismo. Por ejemplo, hidrocarburos halogenados causan más daño en el hígado en pacientes que se recuperan de una ingestión de etanol aguda que en controles de no bebedores. La acción del tetracloruro de carbono también es mayor en presencia de PCBs. Sin embargo, el pretratamiento con ácido lipoico (ácido 6,8-tiooctic) reduce la hepatotoxicidad por cadmio y el cloranfenicol (y antioxidantes, en general) antagoniza la hepatotoxicidad por CCl4 in vivo, probablemente al inhibir la peroxidación lipídica. -6- BIOMARCADORES HEPÁTICOS En relación con el hígado, la determinación en plasma de la actividad de algunas isoenzimas específicas de éste órgano (enzimas marcadoras) es importante como medida de la hepatotoxicidad, ya que su presencia, anormalmente incrementada en plasma, indica la pérdida de las mismas (daño hepático). Esto ha resultado útil en la valoración de la intoxicación con metales pesados. Marcadores citotóxicos: Las isoenzimas hepáticas que se encuentran normalmente en el plasma suelen ser de origen citosólico (AST, ALT, LDH), y su presencia en plasma se relaciona con la gravedad del daño celular, indicando la extensión de la irreversibilidad del daño en la destrucción o disfunción celular. Síntomas clínicos del daño hepático son hepatomegalia, dolor, etc. Marcadores citotóxicos y colestáticos: Las isoenzimas fosfatasa alcalina (FA) y γglutamiltransferasa (γ-GT), así como la bilirrubina y ácidos biliares se usan como tales. Marcadores colestáticos: 5’-nucleotidasa y bilirrubina en orina. La lesión sobre el hígado puede ser por toxicidad directa (A. phalloides, etc), o a través de un metabolito intermedio tóxico (paracetamol, tetracloruro de carbono, etc). Habitualmente la lesión no es detectada por el laboratorio hasta transcurridas unas 24-48 horas; antes puede provocar un cuadro inespecífico de náuseas, vómitos, diarreas y dolor abdominal. A partir de entonces aumentan rápidamente las cifras de transaminasas, y si la lesión hepática es severa se altera también la bilirrubina plasmática y pueden aparecer otras alteraciones (hipoglicemia, acidosis metabólica). La mayoría de las veces la toxicidad de productos industriales es leve y sólo cursa con aumento de la cifra de transaminasas, apenas sin otra clínica y acostumbra a ser reversible en cuanto el tóxico es eliminado. DROGAS HEPATOPROTECTORAS. Aparte de los mecanismos de protección celular vistos anteriormente (tema 16), existen varias drogas que se usan para proteger el parenquima hepático en pacientes expuestos a hepatotóxicos. Así, la droga prometacina (una fetotiacina) fue la primera que se demostró que tenía un efecto hepatoprotector contra la acción necrogénica del CCl4. La acción parece ser por secuestro de CCl3OO. (radicales peroxilo clorocarbonados) que pueden iniciar la peroxidación lipídica en membranas hepáticas. La N-acetilcisteína, al ser un precursor del GSH (cisteína) protege contra agentes oxidantes, como el acetaminofen. -7-






