unidad didáctica: funciones químicas inorgánicas
Anuncio

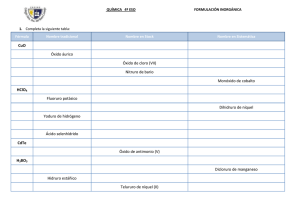
UNIVERSIDAD FRANCISCO DE PAULA SANTANDER FACULTAD DE EDUCACIÓN, ARTES Y HUMANIDADES DEPARTAMENTO DE PEDAGOGÍA, ANDRAGOGÍA, COMUNICACIÓN Y MULTIMEDIA LICENCIATURA EN BIOLOGÍA Y QUÍMICA PRÁCTICA PEDAGÓGICA VI: PROFESIONAL UNIDAD DIDÁCTICA: FUNCIONES QUÍMICAS INORGÁNICAS TEMAS Y OBJETIVOS DIDÁCTICOS Área/Asignatura: Docente: Tema: Objetivo Didáctico: Instructivo: DATOS DE IDENTIFICACIÓN Ciencias Naturales y Educación Ambiental / Química Noveno “A” Rubén D. Toro Berbesí Grado: Y “C” Óxidos Hidróxidos Duración: 6 horas Ácidos Identificar las sustancias nomenclatura química. inorgánicas por medio de su 1. Lea cuidadosamente la guía. 2. Desarrolle los ejercicios y participe de las actividades sugeridas de la guía en el cuaderno y proceso de aula. RECONOCIMIENTO DE MOMENTOS PREVIOS. MOTIVACIÓN 1. RECUPERACIÓN DE CONOCIMIENTOS TÉCNICOS Ecuaciones químicas, reacciones químicas, elementos químicos, tabla periódica, compuestos, funciones químicas, nomenclatura química, sustancias, inorgánica. 2. MOTIVACIÓN Muchos de los procesos que notamos en la naturaleza son acciones que se cobijan y dan pie para el estudio de la química inorgánica, como fundamento tenemos la oxidación de un carro, de cualquier elemento metálico que se oxida con el aire, es decir en presencia de oxígeno. Elementos que nos permite ver desde esos fenómenos naturales la acción de la fuerza y atracción de las funciones químicas que se conjugan en su medio para formar nuevas sustancias químicas. CONTENIDOS PROGRAMÁTICOS 3. MOMENTO BÁSICO FUNCIÓN ÓXIDO Los óxidos son compuestos inorgánicos binarios, es decir, constituidos por dos elementos, que resultan de la combinación entre el oxígeno y cualquier otro elemento. Por ejemplo, el cobre arde en presencia del oxígeno. Cuando el elemento unido al oxígeno es un metal, el compuesto se llama óxido básico, mientras que si se trata de un no metal, se le denomina óxido ácido. Para nombrar este tipo de compuestos basta recordar las siguientes reglas: — El oxígeno en la gran mayoría de sus compuestos actúa con número de oxidación 2-. — En todo compuesto la suma algebraica de los números de oxidación de sus elementos debe ser igual a cero. Al nombrar o escribir las fórmulas de los óxidos se pueden presentar tres situaciones: Elementos con un único número de oxidación: se incluyen en esta categoría los elementos de los grupos IA, IIA y IIIA. En este caso para expresar la fórmula del compuesto basta con escribir los símbolos de los elementos involucrados dejando un espacio entre ellos para anotar los subíndices numéricos que permiten equilibrar el número de cargas positivas y negativas del compuesto de tal manera que se cumpla la segunda regla. Elementos que presentan dos números de oxidación: en este caso, estos elementos pueden combinarse con el oxígeno para dar lugar a dos tipos de óxidos, con propiedades químicas y físicas propias y que de igual forma reciben nombres y fórmulas distintos. Dentro de la nomenclatura tradicional se emplean sufijos (terminaciones) que permiten diferenciar las dos clases de óxidos. Veamos el siguiente ejemplo: El hierro es un elemento metálico que actúa con dos números de oxidación: 2+, 3+. Teniendo en cuenta que el número de oxidación del oxígeno es 2-, las fórmulas para los respectivos óxidos serán: FeO cuando el número de oxidación es 2+ y Fe2O3 cuando el número de oxidación es 3+. Nótese que en la primera fórmula la proporción es 1:1, mientras que en la segunda es 2:3. De esta manera las cargas positivas y negativas se equilibran y se cumple la segunda regla. Para diferenciar el primer óxido del segundo se emplea el sufijo oso para el óxido formado con el menor número de oxidación (2+), e ico para el óxido formado con el mayor número de oxidación (3+). Los nombres serán entonces óxido ferroso (FeO) y óxido férrico (Fe2O3). Otro ejemplo puede ser el cobre. Este elemento actúa con los números de oxidación 1+ y 2+. El procedimiento es el mismo del caso anterior: números de oxidación del cobre: Cu 1+ y Cu2+ y número de oxidación del oxígeno O2-. La fórmula de los óxidos es: Cu2O para el óxido formado cuando el cobre actúa con número de oxidación 1+, y CuO cuando el cobre actúa con número de oxidación 2+. Existe otro sistema de nomenclatura denominado stock en el cual se nombra el óxido incluyendo en el nombre el número de oxidación del elemento. Dicho número se escribe dentro de un paréntesis en números romanos. Por ejemplo, el FeO es óxido de hierro (II) y el Fe 2O3, óxido de hierro (III). En ocasiones se emplea otro sistema de nomenclatura para óxidos ácidos (no metal y oxígeno) denominado nomenclatura sistemática. Según este sistema los óxidos se nombran con la palabra genérica óxido anteponiéndole prefijos de origen griego, como mono, di, tri, tetra, penta, etc., para indicar la cantidad de átomos de oxígeno presentes en la molécula. Algunos ejemplos son: CO: monóxido de carbono, NO2: dióxido de nitrógeno y SO3: trióxido de azufre. Elementos con tres o cuatro números de oxidación: en este caso se forman tres o cuatro óxidos con fórmulas, nombres y propiedades distintas, según el caso. — Vamos a ilustrar en primer lugar el caso de un elemento que actúa con tres números de oxidación, como el azufre: S2+, S4+ y S6+. Las fórmulas de los tres óxidos son: SO, cuando el azufre actúa con número de oxidación 2+; SO2, cuando actúa con 4+, y SO3, cuando su número de oxidación es 6+. Para nombrar el segundo y tercer óxido basta con aplicar la misma norma del caso anterior. Es decir, el SO 2 recibirá el nombre de óxido sulfuroso, mientras el SO3 se llamará óxido sulfúrico. Para nombrar el óxido que tiene el menor número de oxidación de los tres, es decir, S2+, es necesario anteponer al nombre del óxido el prefijo hipo, que quiere decir “por debajo de”, seguido de la raíz del nombre del elemento con la terminación oso. En este caso el nombre del SO será óxido hiposulfuroso. Otros elementos con comportamiento similar son el selenio y el yodo. — Veamos a continuación el caso de un elemento que actúa con cuatro números de oxidación, como el cloro: Cl1+, Cl3+, Cl5+ y Cl7+. Las fórmulas de los diferentes óxidos son: Cl2O para el primer caso (Cl1+); Cl2O3 para el segundo (Cl3+); Cl2O5 para el tercero (Cl5+) y Cl2O7 para el cuarto (Cl7+). Para nombrar estos óxidos empleamos la misma regla del caso anterior pero añadimos el prefijo per o hiper (“por en- cima de”) para el óxido formado cuando el cloro actúa con el mayor número de oxidación, en este caso, siete. Los nombres son: óxido hipocloroso (Cl2O), óxido cloroso (Cl2O3), óxido clórico (Cl2O5) y óxido perclórico (Cl2O7). FUNCIÓN HIDRÓXIDOS O BASES Los hidróxidos son sustancias que se forman a partir de la reacción química entre un óxido básico y el agua. Recordemos que el óxido básico (o simplemente óxido) está constituido por un metal combinado con el oxígeno. Es muy fácil escribir la fórmula de un hidróxido porque su molécula solo tiene un átomo del metal (M) y el radical (OH). M (OH) X. (x) = números de grupos de OH que se unen al metal; número que es igual al número de oxidación del metal. El radical oxhidrilo actúa como un elemento que tiene una sola valencia. Según lo dicho para escribir la fórmula de un hidróxido se procede de la siguiente forma: 1. Se escribe el metal. 2. Se escribe el radical (OH) 3. Se escribe como subíndice del radical un número igual a la valencia del metal. Nota: el metal no lleva subíndice porque la valencia del radical (OH) es uno. En la siguiente tabla se indican ejemplos paso a paso: Nombre hidróxido de potasio hidróxido de Calcio hidróxido de aluminio hidróxido plúmbico 1º paso K Ca Al Pb 2º paso K(OH) Ca(OH) Al(OH) Pb(OH) 3º paso K(OH) Ca(OH)2 Al(OH)3 Pb(OH)4 FUNCIÓN ÁCIDOS Los ácidos son sustancias que se caracterizan por: a. b. c. d. Ceder protones (H+) en medio acuoso Enrojecer el papel tornasol azul La fenolftaleína permanece incolora Presentar agrio, picante (los ácidos no se deben saborear por ser muchos de ellos tóxicos) Las sustancias ácidas pueden agruparse en dos clases: hidrácidos y oxácidos. Hidrácidos: son compuestos binarios, es decir, contienen solamente hidrógeno y un no metal en su estructura. Por lo regular se obtienen de la reacción entre el hidrógeno y los no metales (usualmente los halógenos y además del S, el Te y el Se) NoM + H2 → 2HNoM No metal + Hidrógeno → Hidrácido Cl2 + H2 → 2HCl F2 + H2 → 2HF Por otra parte, no son hidrácidos los compuestos siguientes, pues no presentan las propiedades químicas que caracterizan a los ácidos. H2O SbH3 AsH3 Agua Estibamina Arsenamina CH4 NH3 Metano Amoniaco Se nombran con el sufijo hídrico o como un derivado del hidrogeno con el sufijo uro. HCl HI ácido clorhídrico ácido yodhídrico cloruro de hidrógeno yoduro de hidrógeno Oxácidos: son compuestos ternarios, es decir, contienen hidrógeno, oxígeno y un no metal en su estructura. Estos compuestos responden a una fórmula general del tipo HaXbOc, donde X es normalmente un elemento no metálico, aunque también puede ser un elemento de transición como el Cr o el Mn; a, b y c representan el número de átomos que hay de cada elemento en la molécula. Se obtienen de la reacción entre un óxido ácido y el agua. (NoM)2On + H2O → Ha(NoM)bOc Óxido ácido + Agua → Oxácido N2O5 + H2O → 2HNO3 El nombre corresponde al óxido del cual proviene, con la nomenclatura oso, ico (hipo-oso, per-ico si es el caso). SO3 + H2O → H2SO4 Del óxido sulfúrico → ácido sulfúrico Cl2O + H2O → H2Cl2O2 → 2HClO Del óxido hipocloroso → Ácido hipocloroso P2O3 + 3H2O → H6P2O6 → 2H3PO3 Del óxido fosforoso → Ácido fosforoso Casos especiales de los oxácidos Algunos elementos como B, P, As, Sb; pueden formar más de un oxácido con la misma valencia. Dependiendo del número de moléculas de agua añadidas al anhídrido y dependiendo también de la valencia del elemento en cuestión tendremos: 1 molécula de H2O + anhídrido → ÁCIDO META …… 2 molécula de H2O + anhídrido → ÁCIDO PIRO …….. 3 molécula de H2O + anhídrido → ÁCIDO ORTO……. Ácido metafosfórico : P2O5 + H2O → H2P2O6 → HPO3 Ácido pirofosfórico : P2O5 + 2H2O → H4P2O7 Ácido ortofosfórico o ácido fosfórico: P2O5 + 3H2O → H6P2O8 → H3PO4 PALABRAS CLAVES: Funciones químicas, tabla periódica, elementos metálicos, elementos no metálicos, elementos en transición, estados o números de oxidación, valencias, sustancias, compuestos, oxigeno, hidrogeno, agua, hidroxilo, nomenclatura química inorgánica. ACTIVIDADES DE ENSEÑANZA APRENDIZAJE 4. MOMENTO DE PRÁCTICA Resuelve la siguiente actividad, teniendo en cuenta lo trabajo en clase. 1. Complete con el nombre o su fórmula química, e indique si es oxido básico u oxido ácido. OXIDO Au2O CaO Cl2O7 Dióxido de Carbono Dióxido de Titanio Fe2O3 Na2O NiO Oxido de Bario Óxido de Bromo (III) Oxido de Niquel (III) Oxido de Plomo (II) Pentóxido de dicloro NOMBRE/FÓRMULA QUÍMICA BÁSICO ÁCIDO SiO2 Trióxido de Cromo 2. Escribir las fórmulas de los siguientes hidróxidos: a) hidróxido de sodio e) hidróxido de aluminio i) hidróxido de platino b) hidróxido de litio f) hidróxido auroso c) hidróxido niqueloso g) hidróxido cuproso d) hidróxido férrico h) hidróxido mercúrico j) hidróxido plúmbico k) hidróxido de zinc l) hidróxido de indio 3. Indicar con cuántas valencias actúa el metal en cada uno de los siguientes hidróxidos: a) Au(OH)3 e) Bi(OH)2 b) Be(OH)2 f) Ce(OH)3 c) Bi(OH)3 g) Cs(OH) d) Cd(OH)2 h) Ce(OH)4 4. Escribir el nombre cada uno de los siguientes hidróxidos: a) Ba(OH)2 e) Au(OH)3 i) Zn(OH)2 b) Pb(OH)2 f) Hg(OH) 2 j) In(OH)3 c) Fe(OH)2 g) Ni(OH) 3 k) Fe(OH) 3 d) Cu(OH)2 h) Ag (OH) l) Lu(OH) 3 5. Algunos de los hidróxidos de la siguiente tabla están mal escritos, táchelos. a) Ca(OH) e) Au(OH)3 i) Zn(OH) b) Pb(OH)2 f) Hg(OH) 2 j) In(OH)4 c) Li(OH)2 g) Ni(OH) 3 k) Fe(OH) 3 d) Cu(OH)3 h) Ag (OH) 2 l) Cu(OH) 6. Nombrar según el sistema tradicional y Stock los siguientes compuestos HNO3, HBrO, HF, HClO4, H2CO3, H2SeO2, HIO, H2Se, H3BO3 7. Dar la estructura correspondiente a los siguientes nombres Ácido fosfórico, ácido de cloro (V), ácido selénico, ácido bromhídrico, sulfuro de hidrógeno, ácido hipocromoso, ácido de arsénico (III), ácido pirofosfórico, ácido ortosilícico 8. Completar con fórmulas y nombres las siguientes ecuaciones: SeO2 + H2O → ___ Óxido perclórico + Agua →___ I2 + H2 → ___ ___ + ___ → Ácido de nitrógeno (III) ___ + ___ → Ácido hiposulfuroso MOMENTO DE EVALUACIÓN 5. MOMENTO DE EVALUACIÓN 1. Completar la siguiente tabla: Compuesto Stock Sistemática Tradicional Ag2O Oxido de Antimonio (III) Monóxido de estaño Oxido hipovanadioso 2. Completar la siguiente tabla Fórmula química del hidróxido Fórmula química del óxido del que se formó N. Sistemática Hidróxido Sr(OH)2 Trihidróxido de Indio N. Tradicional Hidróxido N. Stock Hidróxido TiO2 Hidróxido platinoso Hidróxido de mercurio (II) 3. Escribe la reacción de obtención de los siguientes óxidos. Pentaóxido de dicloro Óxido Bismútico Óxido de Niobio (V) 4. A partir del óxido obtener el hidróxido correspondiente Dióxido de Rodio Óxido Paládico Óxido de Molibdeno (VI) 5. A partir del óxido hacer el proceso de obtención del ácido correspondiente Óxido de Cloro (VII) Dióxido de Selenio Óxido de Cromo (VI) 6. Escribe la reacción de obtención de los siguientes ácidos. Ácido Yódico Ácido sulfuroso Ácido Sulfhídrico MOMENTO DE EXTENSIÓN 6. MOMENTO DE EXTENSIÓN Establezca por medio de fenómenos naturales y de otras acciones que ves a diario en tu casa, empresas o en otros medios donde puedas observar y a partir de ello formar y establecer compuestos inorgánicos, indicando sus nombres de acuerdo a la nomenclatura química inorgánica y en lo posible determinar sus nombres común; como ejemplo la oxidación de un carro, como se forma, hasta formar su compuesto, como es el ácido que usamos en casa, en las empresas. GLOSARIO 7. GLOSARIO Ácido: Sustancia compuesta de metaloide e hidrógeno (hidrácidos) o también de metaloide, oxígeno e hidrógeno (oxácidos). Suelen tener un sabor agrio, enrojecen la tintura azul de tornasol y atacan a todos los metales (excepto a los metales nobles, plata, mercurio, oro, platino) dando unos cuerpos llamados sales, y desprendiendo hidrógeno. Balanceo: es igualar el número y clase de átomos, iones o moléculas reactantes con los productos, con la finalidad de cumplir la ley de conservación de la masa. Ecuación química: es la representación gráfica sencilla de una reacción química. Endotérmica: reacciones que ocurren con absorción de energía. Exotérmica: reacciones que ocurren con liberación de energía. Hidróxido: Álcali o base. Compuesto que contiene uno o más grupos hidroxilo en su molécula, por ej. el NaOH y el Ca(OH)2 Hidroxilo: Radical monovalente compuesto de un átomo de oxígeno y uno de hidrógeno:OH-. Procede del peróxido de hidrógeno H2O2 (agua oxigenada). Se puede obtener por disociación del vapor de agua mediante una descarga eléctrica.SINÓNIMO. Oxhidrilo e hidroxil. Número de oxidación: Cifra que se asigna a un átomo, una molécula o un ion y que refleja, cualitativamente, su estado de oxidación. Óxidos: Compuestos binarios formados por el oxígeno y otro elemento, en lo que el oxígeno actúa con número de oxidación -2. los óxidos metálicos resultan de combinar un metal con un oxígeno, son compuestos iónicos sólidos y tienen propiedades básicas. Los óxidos no metálicos son el resultado de combinar un elemento no metálico con el oxígeno, forman compuestos covalentes con enlaces polarizados hacia el oxígeno y se presentan como gases o como líquidos. Productos: son las sustancias resultantes. Química: es la ciencia que estudia tanto la composición, estructura y propiedades de la materia, así como los cambios que ésta experimenta durante las reacciones químicas y su relación con la energía. Química inorgánica: Rama de la química que estudia los elementos y los compuestos inorgánicos presentes en las rocas y los minerales, sus propiedades y reacciones que producen. Reacción: son procesos en los que se producen nuevas sustancias distintas a las reaccionantes. Reaccionantes: son las sustancias que reaccionan entre sí. Reacciones heterogéneas: ocurre cuando las sustancias están en etapas diferentes y se desarrolla sólo en la interfase. Reacciones homogéneas: ocurre cuando los reactivos y productos están en una sola fase. Valencia: Número entero sencillo que indica la capacidad que tiene un átomo de un elemento para combinarse con otro elemento. En los compuestos iónicos equivale a la carga eléctrica real del ión y en las sustancias covalentes representa el número de electrones que aporta el elemento para ser compartidos. Es preferible utilizar el número de oxidación. BIBLIOGRAFÍA 8. BIBLIOGRAFÍA Mondragón Martínez, César Humberto; Peña Gómez, Luz Yadira; Sánchez de Escobar, Martha; Arbeláez Escalante, Fernando; González Gutiérrez, Diana. Hipertexto Química 1. Editorial Santillana, 2010. Restrepo Merino, Fabio & Jairo. Hola química tomo 1. Susaeta Ediciones. 1989. Internet - Google: Óxidos. Función química inorgánica óxidos. Hidróxidos. Función química inorgánica Hidróxidos. Ácidos. http://www.unlu.edu.ar/~qui10017/Quimica%20COU%20muestra%20para%20IQ10017/prcap3.htm http://www.rubenprofe.com.ar/4matuniv/38quim/384guiahidro.pdf