Actividad 5: “Problemario sobre soluciones porcentuales, molalidad
Anuncio

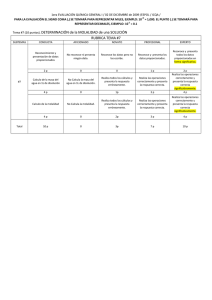
Actividad 5: “Problemario sobre soluciones porcentuales, molalidad, molaridad y normalidad” _____________________________________________________________________________________ Instrucciones: Aplica las competencias: Actividad 5 El docente realizara una exposición magistral de los pasos a seguir para resolver ejercicios sobre soluciones porcentuales, molalidad, molaridad, normalidad. Producto del aprendizaje: Genéricas Disciplinares 4. Escucha, interpreta y emite mensajes pertinentes en distintos contextos mediante la utilización de medios, códigos y herramientas apropiados 4.1) Expresa ideas y conceptos mediante representaciones lingüísticas, matemáticas o gráficas. 3. Identifica problemas, formula preguntas de carácter científico y plantea las hipótesis necesarias para responderlas. Problemario FÓRMULAS BÁSICAS SOLUCIONES VALORADAS Molalidad Molaridad Normalidad I.-Ejercicios sobre soluciones empíricas (%masa/%volumen/%masa-volumen). 1.- Calcula la concentración porcentual masa/volumen de una disolución que se preparó disolviendo 30 g de hidróxido de potasio en suficiente cantidad de agua para obtener 100mL de disolución. (R= 30% de KOH). DATOS FÓRMULA SUSTITUCIÓN RESULTADO %m/v= ¿? G solvente= 30 g V disolución= 100 ml 2.- Calcula la concentración porcentual volumen/volumen de una disolución que se preparó disolviendo 5 mL de etanol en 95 mLde agua. (R= 5% de Etanol). 3.- Calcula la concentración porcentual masa/masa de una disolución que se preparó disolviendo 5 g de cloruro de sodio en 50 g de agua. (R= 9.09% de NaCl). 4.- %masa/masa: Si se disuelven 25 g de alcohol en 90 g de agua, ¿Cuál es el porcentaje de alcohol en la solución? (R= 21.7% de alcohol). 5.- %v/v: Si se disuelven 75 ml de ácido acético (vinagre) en 200 ml de agua, ¿Cuál será el porcentaje, en volumen, en el que se encuentra el ácido en la solución? (R= 27.2% de ácido). 6.- %m/m: Si se evaporan a sequedad 150 g de una solución de bromuro de sodio (NaBr), quedan en el recipiente 35 g de la sal mencionada, ¿Cuál será la concentración en porcentaje en peso de la solución? (R= 23.3% de sal). 7.- %v/v: Si se disuelven 40 ml de cetona en 170 ml de agua, ¿Cuál será el porcentaje de la cetona en la solución? (R= 19.04% de cetona). II.-Ejercicios sobre soluciones valoradas (Molalidad/Molaridad/Normalidad). 8.- Molalidad: Se tiene una solución de etanol (C2H6O) cuya concentración es 0.87 molal. ¿Cuántos gramos de etanol estarán disueltos en 800 g de agua? (R= 32.016 g de etanol). 9.- Molalidad: ¿Cuál será la molalidad de 4.538 gramos de cloruro de calcio (CaCl2) que se disuelven en 1800 gramos de agua? (R= m=0.0227 mol/kg o 0.0227 m). 10.- Molalidad: ¿Cuál será la molalidad de 20 gramos de nitrato de plata (AgNO3) que se disuelven en 2150 gramos de agua? (R= m=0.0547 mol/kg o 0.0547 m). 11.- Molaridad: ¿Cuántos gramos de ácido sulfúrico (H2SO4) se necesitan para preparar 1.4 L de una solución 0.25 molar? (R= 34.3 g de ácido sulfúrico). 12.- Molaridad: ¿Cuántos gramos de permanganato de potasio (KMnO 4) se necesitan para preparar 1 L de solución 0.35 molar de permanganato de potasio? (R= 55.3 g de permanganato de potasio). Actividad 5: “Problemario sobre soluciones porcentuales, molalidad, molaridad y normalidad” _____________________________________________________________________________________ 13.- Molaridad: ¿Cuántos gramos de cloruro de bario (BaCl2) se deberán pesar y llevar a un litro de solvente para tener una solución 1.7 Molar? (R= 353.6 g de cloruro de bario). 14.- Normalidad: Calcular la cantidad de gramos de Ca(OH)2 necesarios para preparar 450 ml de una solución 0.6 N. (R= 9.99 g de Hidróxido de calcio). 15.- Normalidad: ¿Qué normalidad tendrá una solución de 600 ml que contienen 45 g de ácido clorhídrico? (R= 2.05 eq-g/l o 2.05 N de ácido clorhídrico). 16.- Normalidad: ¿Cuántos gramos de soluto se necesitarán para preparar un litro de 0.1 N de H2SO4? (R= 4.9 g de ácido sulfúrico).