cinética de precipitación de hierro en autoclave desde soluciones
Anuncio

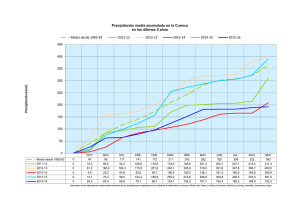
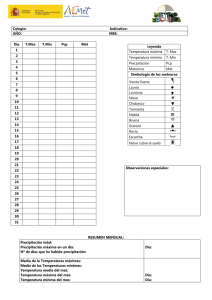
CINÉTICA DE PRECIPITACIÓN DE HIERRO EN AUTOCLAVE DESDE SOLUCIONES DE SULFATO FERROSO Daniel Castillo Universidad de Concepción.CHILE RESUMEN En el siguiente trabajo de tesis se estudia la precipitación de hierro en reactor autoclave desde soluciones que contienen sulfato ferroso. Para esto las soluciones son calentadas en un rango comprendido entre los 160 a 220 ºC; una vez alcanzada la temperatura de trabajo se le aplica una determinada sobrepresión de oxígeno durante tiempos que van desde cero hasta los 60 minutos. Además se estudia el efecto de otras variables en la precipitación de hierro como son: la agitación, acidez, concentración de hierro. A continuación se muestra la figura Nº1 donde se aprecia el efecto de la presión de oxígeno en el porcentaje de precipitación de hierro: % pp Fe vs tiempo (180ºC) 100 90 80 70 % pp Fe 60 50 40 30 20 10 0 0 10 20 30 40 50 60 70 Tie m po (m in) 15 p.s .i. 45 p.s .i. 90 p.s .i. El gráfico anterior muestra el resultado para soluciones de trabajo que contenían 5 gpL de hierro inicial y 1 gpL de ácido sulfúrico, los puntos en azul corresponden a experiencias realizadas con una presión de oxígeno de 15 p.s.i., los rosa a pruebas con 45 p.s.i. y en amarillo a 90 p.s.i. de oxígeno. El tiempo representa el período de reacción al que fueron sometidos. La cinética de precipitación de hierro en presencia de oxígeno se sabe que contempla dos reacciones: Primero, la oxidación del ion ferroso a férrico, cuya reacción es: 1 2 Fe 2 + + O2 + 2 H + = 2 Fe 3+ + H 2 O 2 (1) y la hidrólisis del ion férrico para generar óxidos de hierro, como por ejemplo: 2 Fe 3+ + 3H 2 O = Fe 2 O3 + 6 H + (2a) 2 Fe 3+ + 4 H 2 O = 2 FeO ⋅ OH + 6 H + (2b) Al analizar las reacciones (1) a (2b), se observa que la precipitación será posible en la medida que haya ion férrico en el sistema, con lo que hay que analizar como afectan las variables de temperatura, acidez y agitación en la generación de hierro trivalente en la solución. El siguiente gráfico muestra como afecta la presión de oxigeno aplicada la transformación de ion ferroso a ion férrico: 1/[Fe + 2] vs tie m po 900 800 700 R 2 = 0,9954 1/[Fe+2] (l/mol) 600 500 400 300 R 2 = 0,9871 2 200 R = 0,9926 100 0 0 10 20 30 40 50 60 70 Tie m po (m in) 15 p.s .i. 45 p.s .i. 90 p.s .i. Al concluir las experiencia se ajustará un modelo cinético para la precipitación de hierro desde soluciones de sulfato ferroso en medio ácido sulfúrico, en que estará en función de las variables antes mencionadas(agitación, temperatura, presión de oxígeno, concentración de Fe(II) y Fe(III) y concentración de ácido sulfúrico. Una vez obtenido el modelo cinético en función de las variables antes mencionadas, se podría evaluar la posibilidad de incorporar este proceso en la purificación de soluciones provenientes de lixiviación de cobre, por ejemplo, ya que ellas contienen hierro en solución y deben ser sometidas a etapas de extracción por solventes u otras similares con el fin de eliminar el hierro. Hay que recordar que el ion ferroso y férrico tienen alta importancia en electro-obtención, por disminuir la eficiencia de corriente del proceso.