ANESTESIA GENERAL EN EL SÍNDROME DE DANDY WALKER
Anuncio

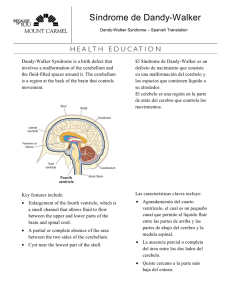
Documento descargado de http://www.elsevier.es el 20/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. CARTAS AL DIRECTOR mayor riesgo de depresión respiratoria y aspiración secundaria al uso de anestésicos4. En este caso, el procedimiento a realizar era corto, con un estímulo doloroso limitado, debiendo el anestesiólogo valorar el beneficio/riesgo de realizar una anestesia general o una sedación profunda. Los riesgos de la anestesia general incluyen la hipersensibilidad a bloqueantes neuromusculares no despolarizantes5, hiperpotasemia tras la administración de succinilcolina y fallo en la extubación con el consiguiente riesgo de traqueotomía6. En la realización de una sedación profunda parece aconsejable contar con un soporte respiratorio, función aportada por la VMNI nasal perfectamente. En este caso, se precisa como añadido un acceso oral para el endoscopista, factor que supone una limitación de esta técnica por el aumento en las fugas en el circuito respiratorio por la boca. Respecto a las fugas consideradas como excesivas en la VMNI, debemos tener en cuenta que en pacientes sometidos a VMNI nasal domiciliaria, éstas se producen en el 69% de los pacientes durante el sueño7. Así, nuestro objetivo con esta técnica no es realizar una “VMNI ideal”, es la utilización de un soporte respiratorio que nos permita evitar una anestesia general, permitiendo la utilización de anestésicos con mayor seguridad. Estos procedimientos se realizan habitualmente en el quirófano, con respiradores de quirófano, que pueden no ser los más adecuados en un circuito en el que van a existir importantes fugas, pero que actualmente nos ofrecen modos ventilatorios adecuados para plantear una VMNI y la posibilidad de ante cualquier incidente reconvertir el proceso a una anestesia general, a diferencia de respiradores específicos de VMNI. Otro aspecto es la utilización de la ketamina, teniendo como indicación la posibilidad de minimizar los fenómenos de depresión respiratoria, preservando la reactividad de la vía aérea8, pensando en otra limitación crítica en la utilización de la VMNI como es el riesgo de regurgitación y aspiración9. Hubiera sido deseable disponer de una espirometría previa, pero debido a la situación del paciente era imposible obtenerla. En el caso de que el deterioro respiratorio fuera muy intenso, puede ser más adecuado una gastrostomía radiológica percutánea (PGR) que una PEG, ya que la PGR requiere un menor grado de sedación, comprometiéndose en menor medida la función respiratoria10. Podemos así considerar la VMNI nasal como una opción a contemplar para la sedación en este tipo de procedimientos, en los que una anestesia general implica asumir numerosos riesgos. Es evidente que se trata de una opción con limitaciones, pudiendo considerar como la más importante el riesgo de broncoaspiración, ya que la pérdida de monitorización del EtCO2 por las fugas del circuito respiratorio es algo inherente a la técnica, siendo estos inconveniente suplidos por la ventaja de disponer de un mecanismo de rescate ante una posible apnea en pacientes con una sensibilidad aumentada a los agentes anestésicos. BIBLIOGRAFÍA 1. Silva LB, Mourão LF, Silva AA, Lima NM, Almeida SR, Franca MC Jr, et al. Amyotrophic lateral sclerosis: Combined nutritional, respiratory and functional assesment. Arq Neuropsiquiatr. 2008;66:354-9. Rev Esp Anestesiol Reanim. 2011;58:254-263 2. Wijeskera LC, Leigh PN. Amyotrophic lateral sclerosis. Orphanet J Rare Dis. 2009;4:3. 3. Mathus-Vligen LM, Louwerse LS, Merkus MP, Tytgat GN, Vianney de Jong JM. Percutaneous endoscopic gastrostomy in patients with amyotrphic lateral sclerosis and impaired pulmonary function. Gastrointest Endosc. 1994;40:463-9. 4. Naguib M, Flood P, McArdle JJ, Brenner HR. Advances in neurobiology of the neuromuscular junction: Implications for the anesthesiologist. Anesthesiology. 2002;96:202-31. 5. Rosenbaum KJ, Neigh JL, Strobel GE. Sensitivity to nondepolarizing muscle relaxants in amyotrophic lateral sclerosis: Report of two cases. Anesthesiology. 1971;35:638-41. 6. Birnkrant DJ, Ferguson RD, Martin JE, Gordon GJ. Noninvasive ventilation during gastrostomy tube placement in patients with severe Duchenne muscular dystrophy. Pediatr Pulmonol. 2006;41:188-93. 7. Rabec CA, Reybert-Degat O, Bonniaud P, Fanton A, Camus P. Leak monitoring in noninvasive ventilation. Arch Bronconeumol. 2004;40:508-17. 8. Kohrs R, Durieux ME. Ketamine: Teaching and old drug new tricks. Anesth Analg. 1998;87:1186-93. 9. Iwama H. Application of nasal bi-level positive airway pressure to respiratory support during combined epidural-propofol anesthesia. J Clin Anesth. 2002;14:24-33. 10. Wollman B, D’Agostino HB. Percutaneous radiologic and endoscopic gastrostomy: a 3-year institutional analysis of procedure performance. AJR Am J Roentgenol. 1997;169:1551-3. J. M. Marcos Vidal, J. C. Bermejo González, P. M. Baticón Escudero Servicio Anestesiología y Reanimación. Hospital de León. ANESTESIA GENERAL EN EL SÍNDROME DE DANDY WALKER Sr Director: El síndrome de Dandy-Walker es una asociación de anomalías cerebrales congénitas localizadas y que pueden formar parte de cuadros malformativos diversos. Tiene una prevalencia de 1:25.000 nacimientos vivos y se caracteriza por un ensanchamiento quístico del cuarto ventrículo, hipoplasia y agenesia antes de la diferenciación embriológica, del vérmix y los hemisferios cerebelosos, que secundariamente produce hidrocefalia e hipertensión intracraneal1. En el 68% de los casos esta malformación se asocia a otros defectos del sistema nervioso central, que forman parte de este complejo, lo que sugiere que las anomalías neurológicas son parte de las alteraciones del desarrollo general de la línea media y que ocurren en las seis primeras semanas de gestación, como son: quiste del tercer ventrículo y de la fosa posterior, atresia de los agujeros de Luschka y Magendie, anomalías de la migración neuronal que incluyen polimicrogiria (desarrollo escaso de las circunvoluciones cerebrales), agiria (desarrollo insuficiente de las circunvoluciones cerebrales), agenesia del cuerpo calloso, y otras malformaciones muy heterogéneas entre las que destaca estenosis del acueducto, microcefalia, siringomielia, meningocele, anomalías oculares y paladar hendido. La clínica suele comenzar durante la lactancia por crecimiento del cráneo en forma progresiva debido a la hidrocefalia y puede acompañarse de otras malformaciones congénitas encefálicas. Se debe a la obstrucción de la salida del líquido cefalorraquídeo del sistema ventricular, a una menor 259 Documento descargado de http://www.elsevier.es el 20/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. CARTAS AL DIRECTOR absorción del líquido y menos frecuentemente a la producción excesiva de líquido por anomalías del plexo coroideo. En los neonatos el diagnóstico lo sugiere la forma del cráneo, dolicocéfalo y la deformación del occipucio. El estado general de los niños puede ser excelente, aunque si el síndrome se deja a su evolución espontánea comienzan con síntomas de postración, somnolencia y rechazo a los alimentos. La progresión de la hidrocefalia provoca anomalías en la motilidad ocular. La compresión de las vías ópticas debido a la dilatación del tercer ventrículo puede dar lugar a una atrofia óptica y la afectación del sexto par craneal puede dar lugar a estrabismo; la disfunción del tronco encefálico ocasiona dificultades para la succión o la alimentación, y puede causar vómitos y aspiración, así como trastornos del ritmo respiratorio. Las descompensaciones o los estadios más avanzados pueden causar la muerte, ésta se produce por compresión del tronco o por herniación de la masa encefálica a través de los agujeros de Luschka y Magendie. Se deberán descartar otras malformaciones acompañantes como son espina bífida, siringomielia, dismorfias faciales y cardiopatías congénitas. El diagnóstico se realiza con estudios de neuroimagen, como resonancia magnética (método diagnóstico de elección) y escáner para confirmar tanto la dilatación ventricular como otras malformaciones congénitas asociadas; algunos lactantes con estenosis congénita del acueducto están asintomáticos, incluso hasta el comienzo de la vida adulta2; algunos pueden ser totalmente asintomáticos. El tratamiento es la derivación ventricular y ventriculostomía en los casos de hidrocefalia3-5. Presentamos un caso de un niño de 5 años y 23 kg de peso con síndrome de Dandy-Walker, que había sido diagnosticado por ecografía prenatal, y confirmado tras parto mediante ultrasonografía, programado para cirugía programada de corrección de estrabismo. Además del quiste de IV ventrículo e hipoplasia del vérmixcerebeloso, el paciente presentaba agenesia del cuerpo calloso, no presentaba hidrocefalia aunque el perímetro craneal estaba ligeramente aumentado con deformación del occipucio. Tenía retraso psicomotor y del lenguaje, y el citado estrabismo. No tenía antecedentes anestésicos y la analítica preoperatoria era normal. Se procedió a monitorización mediante pulsioximetría, electrocardiograma y presión arterial no invasiva, tras lo cual se realizó inducción anestésica con sevoflurano al 7% mediante mascarilla facial, y posterior canalización de vía venosa periférica 22G en miembro superior izquierdo. Se le administró atropina (0,1 mg kg–1), fentanilo (1 µg kg–1), y propofol (2 mg kg–1), tras lo cual se insertó mascarilla laríngea nº 2,5. Asimismo se administraron ondansetrón (0,1 mg kg–1) y dexametasona (0,2 mg kg–1) como profilaxis antiemética. Se conectó a ventilación mecánica y se realizó el mantenimiento con sevoflurano al 2%. Tras finalización de la cirugía y recuperación de la respiración espontánea, se extubó sin incidencias. Este síndrome neurológico congénito tiene gran variabilidad en su presentación clínica. En nuestro caso presentaba cierto grado de hipotonía por lo que se desestimó el uso de bloqueantes neuromusculares. Otro de los problemas 260 potenciales debido a la deformidad craneal es el manejo de la vía aérea6,7, por lo que se decidió la colocación de una mascarilla laríngea. Aunque el paciente no presentaba hidrocefalia, y no tenía aumento de la presión intracraneal, se prefirió el uso de la ventilación mecánica a la ventilación espontánea para conseguir normocapnia. Existe muy poca literatura sobre este síndrome y sus implicaciones anestésicas. BIBLIOGRAFÍA 1. Kaoru K, Kazuya M, Kazuaki F. Anesthetic management of a neonatewith Dandy-Walker syndrome. J Anesthesia. 1994;8,344-5. 2. Cone AM. Head injury in anadult with previously undiagnosed DandyWalker syndrome: a review of the condition and discussion of its anesthetic implications. AnaesthIntensive Care. 1995;23:613-5. 3. Hamid RK, Newfield P. Pediatric neuroanesthesia. Hydrocephalus. Anesthesiol Clin North America. 2001;19:207-18. 4. Mohanty A, Biswas A, Satish S, Praharaj SS, Sastry KV. Treatment options for Dandy-Walker malformation. J Neurosurg. 2006;105(5 Suppl):348-56. 5. Ewart MC, Oh T. The Dandy-Walker syndrome. Relevance to anaesthesia and intensive care. Anaesthesia. 1990;45:646-8. 6. Mayhew JFMiner ME, Denneny J. Upper airway obstruction following cyst-to-peritoneal shunt in a child with a Dandy-Walker cyst. Anesthesiology. 1985;65:183-4. 7. Abouleish AE, Mayhew JF. Magnetic resonance imaging of the airway in a infant with micrognathia. Anesth Analg. 1998;86:964-6. D. García Bernal, P. Ramos, A. Martínez, M. Echevarría Hospital Universitario de Valme. Sevilla. CONSIDERACIONES ANESTÉSICAS EN EL SÍNDROME DE MILLER FISHER Sr Director: El síndrome de Miller Fisher (SMF), cuya incidencia es muy baja, se considera una variante del síndrome de Guillain-Barré (SGB). En ambos síndromes la mayor parte de las veces existe antecedente de infección respiratoria1,2 y aunque también el SMF se ha asociado con lupus eritematoso sistémico, tiroiditis, enfermedad de Hodgkin o carcinomas, no se considera una enfermedad reumatológica ni paraneoplásica3. Se produce una polirradiculoneuropatía desmielinizante aguda con patogenia inmunológica similar hallándose elevados los anticuerpos antigangliósido. El hallazgo de anticuerpos antigangliósido tipo GQ1b confirmaría el SMF. Estos anticuerpos actúan sobre la unión neuromuscular del tercer, cuarto y sexto par craneales causando la oftalmoparesia2. Se caracteriza por la aparición aguda pero limitada de oftalmoplejia, ataxia y arreflexia. En general tiene buen pronóstico, con una recuperación media de unas 10 semanas. Formas atípicas pueden presentar también parálisis orofaríngea2, y aunque no suele haber compromiso respiratorio, cuando lo hay se consideran casos de solapamiento entre SMF y SGB. Las recidivas son muy raras y se han visto relacionadas con el antígeno HLA DR22,4. Rev Esp Anestesiol Reanim. 2011;58:254-263