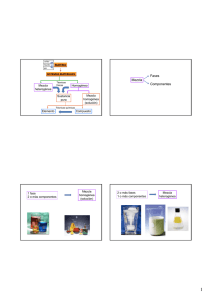
Mezcla Fases Componentes 1 fase 2 fases
Anuncio

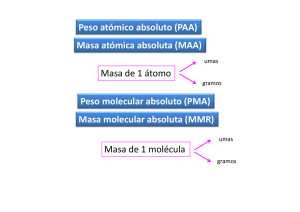
solido líquido MATERIA gas SISTEMAS MATERIALES Técnicas físicas Mezcla heterogénea Fases Mezcla Componentes Homogéneo Mezcla homogénea (solución) Sustancia pura Técnicas químicas Elemento Compuesto Mezcla homogénea (solución) 1 fase 2 o más componentes 059_MixesandComp.mov 1 fase 2 o más fases 1 o más componentes Mezcla heterogénea 002_DEMOPAPER.mov 2 fases 1 Peso atómico relativo (PAR) Masa atómica relativa (MAR) Número que indica cuántas veces más grande es la masa de un átomo de un elemento respecto de cierta masa tomada como referencia Balanza imaginaria 32 átomos de hidrógeno MAR = 32 Unidad de masa atómica uma = 1,67 x 10‐24 g Peso atómico relativo (PAR) Masa atómica relativa (MAR) Número que indica cuántas veces más grande es la masa de un átomo de un elemento respecto de la uma. Átomo – gramo (atg) Masa de un elemento que, expresada en gramos, coincide numéricamente con el peso atómico relativo del elemento. Número de Avogadro (NA) NA = 6,023 x 1023 MOL Peso molecular relativo (PMR) Masa molecular relativa (MMR) Número que indica cuántas veces más grande es la masa de una molécula de una sustancia respecto de la uma. 1 mol de át. = NA = 6,023 1023 at át‐gramo Átomo – gramo (atg) Masa de un elemento que contiene el número de Avogadro de átomos. Molécula – gramo 600.0003000.0002000.0001000.000 Se tardaría aproximadamente 20.000.000.000 de años en contar NA partículas a razón de un millón por segundo. L h bit t d l ti Los habitantes de la tierra son 6 000 000 000 6.000.000.000 Masa correspondiente a 1 mol de moléculas del compuesto. Masa del compuesto que contiene el número de Avogadro de moléculas Si se desparraman 6 x 1023 bolitas sobre la superficie de la tierra, se formaría una capa de casi 5 Km de espesor. Aún no ha transcurrido 1 mol de segundos desde el big‐bang. Edad del universo: 2x1010 años = 6x1017 segundos. 2 Peso atómico absoluto (PAA) La masa contenida en 1 mol de átomos o moléculas depende del elemento o la sustancia en consideración Masa atómica absoluta (MAA) umas Masa de 1 átomo gramos Peso molecular absoluto (PMA) ( ) Masa molecular absoluta (MMR) umas Masa de 1 molécula gramos Ej: Masa atómica absoluta Mg 24 umas = 24 x 1,66 10‐24 g = 3.98 10‐23 g Masa atómica absoluta C = 12 umas Masa atómica absoluta H = 1 uma Masa atómica absoluta O =16 umas Masa atómica absoluta S = 32 umas a) Punto de vista molecular CO2 C 1 molécula 44 uma 7,3 x 10 –23 g 1 átomo 12 uma 2 x 10 –23 g O 2 átomos 32 uma 5,3 x 10 –23 g b) Punto de vista molar CO2 1 mol de moléculas C 1 mol de átomos O 2 moles de átomos 44 g 1 molécula gramo 12 g 1 átomo gramo 32 g 2 átomo gramo 6,023 x 10 23 moléculas 6,023 x 10 23 átomos 2 x 6,023 x 10 23 átomos 22,4 l (C.N.) ----------- ---------- 3