Fundamento teórico y ejemplos
Anuncio

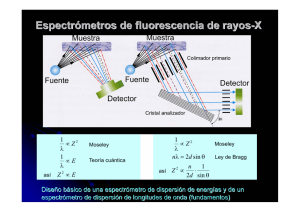
FUNDAMENTO TEÓRICO DE FLUORESCENCIA DE RAYOS-X Dentro de los métodos físicos utilizados para la caracterización de materiales, las técnicas basadas en la utilización de los rayos-X constituyen un grupo especialmente importante, tanto en la variedad de la información que proporcionan como en la importancia de esta. El fundamento de estas técnicas reside en los fenómenos que se producen cuando la radiación X incide sobre la materia. El primer fenómeno que se observa en que la radiación incidente es parcialmente atenuada por el material irradiado; es decir, sólo una cierta fracción de intensidad de esta radiación la atraviesa sin que se produzcan cambios en su energía o longitud de onda. La medida de esta intensidad transmitida es la base de las técnicas de absorción de rayos-X. La atenuación de la radiación se produce por dos mecanismos principales: absorción fotoeléctrica y dispersión. La absorción fotoeléctrica se traduce en emisión, por la muestra irradiada, de radiación X y de electrones; el estudio, tanto del espectro de rayos-X como de los electrones emitidos, conduce a una serie de técnicas que se pueden englobar dentro del título general de técnicas basadas en el efecto fotoeléctrico. En la dispersión una parte de la radiación incidente, es desviada de su dirección original por la interacción con el material irradiado; en este fenómeno se basa la difracción de rayosX. El fundamento de las técnicas espectrométricas radica en la existencia de un sistema atómico con distintos niveles de energía y posibles transiciones entre ellos. La medida de la energía de la radiación electromagnética absorbida o emitida en estas transiciones es la base de estas técnicas. En las figuras 1 a 4 siguientes se muestra el esquema básico en el que se fundamentan: Figura 1.-Estructura simplificada de un átomo Niveles Energéticos de los átomos electrones K L M n= Número de las capas n= n= etc Núcleo et Figura 2.- Interacción observada en la FRX (1) Fotón energético con energía mayor que los electrones de la capa K de un átomo presente en la muestra K L M Figura 3.- Interacción observada en la FRX (2) El electrón K excitado promueve a una capa más externa o incluso abandona el átomo Vacante electrónica causada tras la interacción K L M Fotón energético reducido o gastado Figura 4.- Interacción observada en la FRX (3) La energía potencial en exceso del electrón transferido [EL – EK] se convierte en un fotón Un electrón de la capa L se transfiere a la K K L L M M L K Kα M K Kβ El exceso de energía potencia del electrón trasferido [EM – EK] se convierte en un fotón “Kβ Un electrón de la capa M se tranbfiere para rellenar la vacante craeda en la capa K K K L M L M Como se observa en las figuras se pueden distinguir dos etapas: Excitación y Emisión: Excitación. Si se considera un sistema en su estado fundamental, es decir de menor energía, al aplicarse una energía de una magnitud adecuada, ésta puede ser absorbida por el sistema, pasando éste a un estado de mayor energía, o estado excitado. Emisión. Los estados excitados son inestables, y el átomo tiende a volver a su estado fundamental, para lo cual se producen saltos de electrones de los niveles más externos para cubrir el hueco producido, en este proceso hay un desprendimiento de energía en forma de radiación cuya longitud de onda dependerá de la diferencia de energía entre los dos niveles involucrados en la transición (Kα, Kβ, ...). La medida de la radiación emitida por el sistema es la base de las técnicas espectrométricas de emisión, como la fluorescencia de rayos-X. A la excitación producida por el bombardeo de partículas se le denomina excitación primaria y a la radiación así obtenida radiación X primaria. Al ser las energías de los distinto niveles atómicos características de cada tipo de átomos, la radiación X emitida será característica para cada elemento, y en principio, no dependerá de la sustancia química en la que se encuentre (ver figura 5), ya que en general, estas radiaciones están originadas por transiciones entre los niveles electrónicos internos, cuyas energías no se ven afectadas por el tipo de enlace existente. Aunque el número de radiaciones características posibles para cada elemento es grande, en la práctica la intensidad de muchas de ellas es muy pequeña (probabilidad muy pequeña de que se produzca la transición electrónica que los origina), y no se puede registrar con los equipos de medida; además, el número de radiaciones que se registran se limita todavía más, debido a que la diferencia de energías entre algunas de ellas es tan pequeña que aparecen juntas (Figura 5). Figura 5.-Energías características y número atómico CaKα Z (Kα)= 11 15 20 25 29 33 38 42 MnKα PKα MoKα SrKα CuKα NaKα AsKα MnKβ CaKβ 0 5 CuKβ AsKβ 10 Ejemplos de resultados obtenidos en microfluorescencia. MoKβ1,3 SrKβ Kβ2 15 keV 20 Ejemplo de mapeo obtenido con microfluorescencia: Muestra Calcio Cloro Cobre Silicio Azufre Cinc Cobre y cinc Ejemplo de resultados obtenidos con fluorescencia.