Continuación y bibliografía
Anuncio

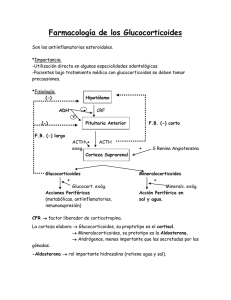
Capítulo 568 Fisiología de la glándula suprarrenal & e568-5 Los receptores de glucocorticoides y mineralcorticoides no ligados se encuentran sobre todo en el citosol. Las moléculas hormonales difunden a través de la membrana plasmática y se unen a los receptores, cambiando su configuración e induciendo su translocación al núcleo, donde se unen al ADN en los elementos específicos de respuesta hormonal. Los receptores con ligando pueden atraer otros factores correguladores de la transcripción al ADN. Mientras que los diferentes esteroides pueden compartir actividades biológicas debido a su capacidad para ligarse al mismo receptor, un determinado esteroide puede tener varios efectos biológicos en diferentes tejidos. La diversidad de las respuestas hormonales está determinada por los diferentes genes que están regulados por cada hormona en los distintos tejidos. Además, en los distintos tejidos se expresan diferentes combinaciones de correguladores, lo que permite que cada hormona esteroidea tenga muchos efectos distintos. Es más, las enzimas pueden aumentar o disminuir la afinidad de los esteroides por sus receptores y de esta forma modular su actividad. La 11b-hidroxiesteroide deshidrogenasa tipo 1 (HSD11B1) convierte la cortisona, que no es un ligando del receptor de glucocorticoides, en cortisol, que es un glucocorticoide activo. Esto aumenta las concentraciones locales de glucocorticoides en varios tejidos, especialmente en el hígado, donde los glucocorticoides mantienen la producción hepática de glucosa (v. más adelante). La sobreexpresión de esta enzima en el tejido adiposo puede predisponer al desarrollo de obesidad (v. más adelante). Por el contrario, la HSD11B2 oxida el cortisol a cortisona, sobre todo en el riñón, lo que impide que los receptores de mineralcorticoides sean ocupados por niveles elevados de cortisol (v. más adelante). Aunque los receptores de corticoides actúan principalmente en el núcleo, algunas de las respuestas a los glucocorticoides y mineralcorticoides comienzan en unos minutos, un intervalo demasiado corto para ser explicado por un aumento de la transcripción de genes y de la síntesis de proteínas. Estos efectos «no genómicos» pueden ser mediados en algunos casos por isoformas de los receptores clásicos de glucocorticoides y mineralcorticoides asociadas a la membrana celular, que pueden acoplarse a una variedad de vías rápidas de señalización intracelular como las proteínas G. También se ha documentado la interacción directa con otras proteínas como los canales de iones, particularmente en el sistema nervioso. © ELSEVIER. Fotocopiar sin autorización es un delito. ACCIONES DE LOS GLUCOCORTICOIDES Los glucocorticoides son esenciales para la supervivencia. El término glucocorticoide se refiere a las propiedades reguladoras de la glucosa de estas hormonas. Sin embargo, los glucocorticoides tienen múltiples efectos sobre el metabolismo de los hidratos de carbono, los lípidos y las proteínas. También regulan la función inmunitaria, circulatoria y renal. Influyen sobre el crecimiento, el desarrollo, el metabolismo óseo y la actividad del sistema nervioso central. En las situaciones de estrés, la secreción de glucocorticoides puede aumentar hasta 10 veces. Se cree que este incremento favorece la supervivencia mediante un aumento de la contractilidad cardíaca, del gasto cardíaco, de la sensibilidad de los efectos constrictores de las catecolaminas y otras hormonas vasoconstrictoras, de la capacidad de trabajo de los músculos esqueléticos y de la capacidad de movilizar depósitos de energía. Efectos metabólicos La acción principal de los glucocorticoides sobre el metabolismo de los hidratos de carbono es el aumento de la producción de glucosa mediante el aumento de la gluconeogénesis hepática. Los glucocorticoides también aumentan la resistencia celular a la insulina, por lo que disminuyen la entrada de glucosa a la célula. Esta inhibición de la captación de glucosa se produce en los adipocitos, las células musculares y los fibroblastos. Además de oponerse a la acción de la insulina, los glucocorticoides pueden actuar junto con la insulina para proteger frente a la inanición a largo plazo estimulando el depósito y la producción de glucógeno en el hígado. Ambas hormonas estimulan la actividad sintetasa de glucógeno y disminuyen la glucogenólisis. El exceso de glucocorticoides puede producir hiperglucemia, mientras que su déficit puede causar hipoglucemia. Los glucocorticoides aumentan los niveles de ácidos grasos libres mediante la estimulación de la lipólisis y disminuyendo la captación celular de glucosa y la producción de glicerol, que es necesario para la reesterificación de los ácidos grasos. Este aumento de la lipólisis también se estimula a través del incremento permisivo de la acción lipolítica de otros factores como la adrenalina. Esta acción afecta a los adipocitos de forma distinta en función de su localización anatómica. En el paciente con exceso de glucocorticoides, se pierde la grasa de las extremidades pero aumenta en el tronco (obesidad centrípeta), el cuello y la cara (cara de luna llena). Esto puede implicar efectos en la diferenciación de los adipocitos. Por lo general, los glucocorticoides ejercen un efecto catabólico o antianabólico sobre el metabolismo proteico. La proteólisis en la grasa, el músculo esquelético, el hueso, el tejido linfoide y conjuntivo aumenta los aminoácidos que pueden ser utilizados como sustratos en la gluconeogénesis. El músculo cardíaco y el diafragma están casi completamente exentos de este efecto catabólico. Efectos circulatorios y renales Los glucocorticoides tienen un efecto inotrópico positivo sobre el corazón, al aumentar el índice de trabajo del ventrículo izquierdo. Además, tienen un efecto permisivo de las acciones de la adrenalina y la noradrenalina, tanto en el corazón como en los vasos sanguíneos. En ausencia de glucocorticoides, puede producirse una disminución del gasto cardíaco y shock; en los estados de exceso de glucocorticoides, con frecuencia se observa hipertensión. Esto puede deberse a la activación del receptor de los mineralcorticoides (v. más adelante) que se produce cuando la HSD11B renal se satura por las excesivas concentraciones de glucocorticoides. Crecimiento El exceso de glucocorticoides inhibe el crecimiento lineal y la maduración esquelética en los niños, aparentemente por un efecto directo sobre las epífisis. Sin embargo, los glucocorticoides son también necesarios para el crecimiento y el desarrollo normales. En el feto y en el recién nacido aceleran la diferenciación y el desarrollo de varios tejidos como los sistemas hepático y gastrointestinal, así como la producción de surfactante por los pulmones fetales. Los glucocorticoides suelen administrarse a las mujeres embarazadas con riesgo de parto prematuro para intentar acelerar estos procesos madurativos (cap. 90.8). Efectos inmunológicos Los glucocorticoides tienen un papel esencial en la regulación inmunológica. Inhiben la síntesis de glucolípidos y precursores de prostaglandinas y las acciones de la bradicinina. También bloquean la secreción y los efectos de la histamina y las citocinas inflamatorias (factor de necrosis tumoral [TNF] a, interleucina [IL] 1 e IL-6), disminuyendo la inflamación. Las dosis altas de glucocorticoides deplecionan los monocitos, los eosinófilos y los linfocitos, en especial las células T. Realizan estas acciones, al menos en parte, por la inducción de una parada del ciclo celular en la fase G1 y mediante la activación de la apoptosis por efectos mediados por los receptores de los glucocorticoides. Los efectos sobre los linfocitos se ejercen principalmente sobre las células T colaboradoras de tipo 1 y por tanto sobre la inmunidad celular, mientras que las células T colaboradoras de tipo 2 quedan exentas de estas acciones, lo que conlleva una respuesta inmunitaria predominantemente humoral. Las dosis farmacológicas de glucocorticoides también pueden disminuir el tamaño de los tejidos inmunológicos (bazo, timo y ganglios linfáticos). Los glucocorticoides aumentan los recuentos periféricos de células polimorfonucleares, sobre todo porque evitan su salida de la circulación. Los glucocorticoides disminuyen la diapédesis, la quimiotaxis y la fagocitosis de las células polimorfonucleares. Por ello, la movilidad de estas células está alterada de tal forma que no llegan al lugar de la inflamación para organizar una respuesta e568-6 & Parte XXVI Sistema endocrino inmunitaria apropiada. Los niveles altos de los glucocorticoides disminuyen las respuestas inflamatorias e inmunitarias celulares y aumentan la susceptibilidad a determinadas infecciones bacterianas, víricas, fúngicas y parasitarias. Efectos sobre la piel, el hueso y el calcio Los glucocorticoides inhiben a los fibroblastos, lo que produce un aumento de la formación de equimosis, y alteran la curación de las heridas con atrofia cutánea. Este efecto explica el adelgazamiento de la piel y las estrías que se ven en los pacientes con síndrome de Cushing. Los glucocorticoides tienen un efecto global de disminución de la calcemia y se han utilizado en el tratamiento urgente de determinados tipos de hipercalcemia. Este efecto hipocalcemiante se debe probablemente a una disminución de la absorción intestinal de calcio y de la reabsorción renal de calcio y fósforo. La calcemia, sin embargo, no suele disminuir por debajo de los niveles normales debido al aumento secundario de la secreción de hormona paratiroidea. El efecto más significativo del exceso de glucocorticoides a largo plazo sobre el calcio y el metabolismo óseo es la osteoporosis. Los glucocorticoides inhiben la actividad osteoblástica mediante la disminución del número y la actividad de los osteoblastos. Los glucocorticoides también disminuyen la actividad osteoclástica, pero en menor grado, lo que produce un recambio óseo bajo con un balance global negativo. La tendencia de los glucocorticoides a disminuir la calcemia y los niveles de fosfato causa hiperparatiroidismo secundario. Estas acciones reducen el depósito óseo y causan una pérdida neta de hueso mineral. La adherencia al tratamiento oral con bifosfonatos, agentes efectivos contra la osteoporosis inducida por glucocorticoides, es baja, pero se sugiere que el tratamiento durante años con ácido zoledrónico intravenoso es igual de efectivo. Efectos sobre el sistema nervioso central Los glucocorticoides atraviesan con facilidad la barrera hematoencefálica y tienen efectos directos sobre el metabolismo cerebral. Disminuyen determinados tipos de edema del SNC y se emplean con frecuencia para el tratamiento de la hipertensión intracraneal. Estimulan el apetito y producen insomnio con una reducción de la fase de sueño REM. Existe un aumento de la irritabilidad y de la labilidad emocional, con alteración de la memoria y de la capacidad para concentrarse. El exceso leve o moderado de glucocorticoides durante un período limitado de tiempo suele producir un sentimiento de euforia o bienestar, pero tanto el exceso como el déficit de glucocorticoides pueden asociarse con depresión clínica. El exceso de glucocorticoides produce psicosis en algunos pacientes. Los efectos de los glucocorticoides sobre el cerebro están mediados en gran parte por las interacciones con los receptores de mineralcorticoides y de glucocorticoides (denominados a veces en este contexto receptores de corticoides tipo I y II, respectivamente). La activación de los receptores tipo II aumenta la sensibilidad de las neuronas del hipocampo al neurotransmisor serotonina, lo que podría ayudar a explicar la euforia asociada con las altas dosis de glucocorticoides. Los glucocorticoides suprimen la liberación de hormona liberadora de corticotropina (CRH) en el hipotálamo anterior, pero la estimulan en el núcleo central de la amígdala y en el núcleo del lecho lateral de la estría terminal, donde pueden mediar los estados de miedo y ansiedad. Los glucocorticoides y otros esteroides podrían tener efectos no genómicos mediante la modulación de la actividad de los receptores del ácido g-aminobutírico (GABA) y del N-metil-D-aspartato (NMDA). hidrogeniones. Ejercen estas acciones en el riñón, el intestino y las glándulas salivales y sudoríparas. Además, la aldosterona puede tener efectos distintos sobre otros tejidos. Existen receptores de mineralcorticoides en el corazón y en el endotelio vascular, y la aldosterona aumenta la fibrosis miocárdica en la insuficiencia cardíaca. Los túbulos contorneados distales y los tubos colectores corticales del riñón son los principales lugares donde actúan los mineralcorticoides, induciendo la reabsorción de sodio y la excreción de potasio. En el tubo colector medular actúan de forma permisiva y dejan que la vasopresina aumente el flujo osmótico de agua. Por ello, los pacientes con déficit de mineralcorticoides pueden desarrollar pérdida de peso, hipotensión, hiponatremia e hiperpotasemia, mientras que los pacientes con exceso de mineralcorticoides pueden presentar hipertensión, hipopotasemia y alcalosis metabólica (caps. 569-572). Los mecanismos por los que la aldosterona afecta a la excreción de sodio no se comprenden del todo. La mayoría de los efectos de la aldosterona se debe presumiblemente a cambios en la expresión génica mediados por el receptor de mineralcorticoides, y de hecho los niveles de las subunidades de la Na+, K+-ATPasa y el canal epitelial de sodio (ENaC) aumentan en respuesta a la aldosterona. Además, la aldosterona incrementa la expresión de la cinasa sérica regulada por corticoides (SGK), que indirectamente reduce el recambio de las subunidades del ENaC y por tanto aumenta el número de canales de sodio abiertos. El receptor de mineralcorticoides tiene afinidades similares in vitro para el cortisol y la aldosterona, aunque el cortisol es un mineralcorticoide débil in vivo. Esta discrepancia se debe a la acción de la HSD11B2, que convierte el cortisol en cortisona. La cortisona no es un ligando del receptor, mientras que la aldosterona no es un sustrato para la enzima. La inhibición farmacológica o el déficit genético de esta enzima permite que el cortisol ocupe los receptores de mineralcorticoides renales y produzca retención de sodio e hipertensión; el trastorno genético se denomina síndrome de exceso aparente de mineralcorticoides (cap. 570.3). ACCIONES DE LOS ANDRÓGENOS SUPRARRENALES Muchas acciones de los andrógenos suprarrenales se ejercen mediante su conversión a andrógenos o estrógenos activos, como la testosterona, la dihidrotestosterona, la estrona y el estradiol. En hombres, <2% de los andrógenos con importancia biológica deriva de la producción suprarrenal, mientras que en las mujeres alrededor del 50% de los andrógenos es de origen suprarrenal. La contribución suprarrenal a los niveles circulantes de estrógenos es importante, sobre todo en condiciones patológicas como los tumores suprarrenales feminizantes. Los andrógenos suprarrenales contribuyen al desarrollo fisiológico del vello púbico y axilar durante la pubertad normal. También tienen una función importante en la fisiopatología de la hiperplasia suprarrenal congénita, la adrenarquia prematura, los tumores suprarrenales y el síndrome de Cushing (caps. 570 y 571). En el ser humano, los niveles circulantes de DHEA y DHEAS, los principales andrógenos suprarrenales, alcanzan un pico en la fase temprana de la edad adulta y después disminuyen. Esto ha llevado a especular que los cambios fisiológicos relacionados con la edad pueden revertirse mediante la administración de DHEA, y se han sugerido efectos beneficiosos (aunque no se han demostrado) sobre la sensibilidad a la insulina, la densidad mineral ósea, la masa muscular, el riesgo cardiovascular, la obesidad, el riesgo de cáncer, la autoinmunidad y el sistema nervioso central. ACCIONES DE LOS MINERALCORTICOIDES Corticoides sintéticos El mineralcorticoide más importante es la aldosterona y, en menor grado, la 11-desoxicorticosterona; la corticosterona y el cortisol no suelen ser importantes como mineralcorticoides, a menos que se secreten en exceso. Los mineralcorticoides tienen acciones más limitadas que los glucocorticoides. Su función principal es mantener el volumen intravascular conservando sodio y eliminando potasio e Se dispone de muchos análogos sintéticos de la cortisona y la hidrocortisona. La prednisona y la prednisolona son derivados con un doble enlace adicional en el anillo A. Al igual que la cortisona, la prednisona no es un esteroide activo, pero se convierte en prednisolona por acción de la HSD11B1 en el hígado. La prednisona y la prednisolona son unas 4-5 veces más potentes en la actividad Capítulo 568 Fisiología de la glándula suprarrenal & e568-7 antiinflamatoria y en la acción sobre los hidratos de carbono, pero tienen un efecto sobre la retención de agua y sodio ligeramente menor que el cortisol. Los derivados halogenados tienen efectos diferentes. La betametasona y la dexametasona tienen una potencia glucocorticoidea 25-40 veces mayor que el cortisol, pero su efecto mineralcorticoide es escaso. Estos análogos se suelen emplear en dosis farmacológicas por sus propiedades antiinflamatorias o inmunosupresoras. La fludrocortisona tiene una actividad antiinflamatoria 15 veces mayor que la hidrocortisona, pero es más de 125 veces más activa como mineralcorticoide; se emplea para tratar el déficit de aldosterona. BIBLIOGRAFÍA © ELSEVIER. Fotocopiar sin autorización es un delito. Canalis E: Mechanisms of glucocorticoid action in bone, Curr Osteoporos Rep 3:98-102, 2005. Datson NA, Morsink MC, Meijer OC, et al: Central corticosteroid actions: search for gene targets, Eur J Pharmacol 583:272-289, 2008. De BK, Haegeman G: Minireview: latest perspectives on antiinflammatory actions of glucocorticoids, Mol Endocrinol 23:281-291, 2009. Fuller PJ, Young MJ: Mechanisms of mineralocorticoid action, Hypertension 46:1227-1235, 2005. Haller J, Mikics E, Makara GB: The effects of non-genomic glucocorticoid mechanisms on bodily functions and the central neural system. A critical evaluation of findings, Front Neuroendocrinol 29:273-291, 2008. Reid DM, Devogelaer J-P, Saag K, et al: and for the HORIZON investigators: Zoledronic acid and risedronate in the prevention and treatment of glucocorticoid-induced osteoporosis (HORIZON): a multicentre, double-blind, double-dummy, randomised controlled trial, Lancet 373:1253-1263, 2009. Tait AS, Butts CL, Sternberg EM: The role of glucocorticoids and progestins in inflammatory, autoimmune, and infectious disease, J Leukoc Biol 84:924-931, 2008. Tasker JG, Di S, Malcher-Lopes R: Minireview: rapid glucocorticoid signaling via membrane-associated receptors, Endocrinology 147:5549-5556, 2006. van der LS, Meijer OC: Pharmacology of glucocorticoids: beyond receptors, Eur J Pharmacol 585:483-491, 2008. van Raalte DH, Ouwens DM, Diamant M: Novel insights into glucocorticoid-mediated diabetogenic effects: towards expansion of therapeutic options? Eur J Clin Invest 39:81-93, 2009. Zhou J, Cidlowski JA: The human glucocorticoid receptor: one gene, multiple proteins and diverse responses, Steroids 70:407-417, 2005.