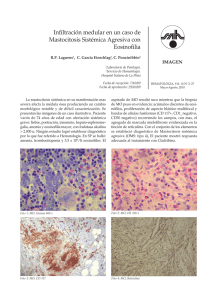
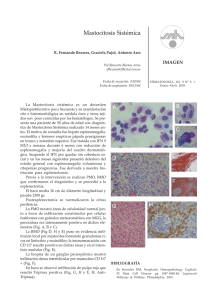
ción de una complicación que nos puede sorprender durante el
Anuncio

Documento descargado de http://www.elsevier.es el 20/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. CARTAS AL DIRECTOR ción de una complicación que nos puede sorprender durante el postoperatorio de una RTU. M. Bausilia, C. Cruzb, A. M. Álvarezb, P. Baxariasb, D. Hernandob Servicio de Anestesiología y Reanimación. Hospital de la Santa Creu i Sant Pau. Barcelona. b Fundació Puigvert. Barcelona. a BIBLIOGRAFÍA 1. Frachet O, Cordier G, Henry N, Tligui M, Gattegno B, Sebe P. Perforations vésicals au cours d’une résection trans-uréthrale de tumeur de vessie. Prog Urol. 2007;17(7):1310-2. 2. Balbay MD, Çimentepe E, Únsal A, Bayrak O, Koç A, Akbulut Z. The actual incidence of bladder perforation following transurethral bladder surgery. J Urol. 2005;174(6):2260-3. 3. Collado A, Chéchile GE, Salvador J, Vicente J. Early complications of endoscopic treatment for superficial bladder tumors. J Urol. 2000;164(5):1529-32. 4. Gattegno B, Chopin D. Tumeurs superficialles de vessie. Rapport du Congrés 2001 de l’Association Française d’Urologie. Prog Urol. 2001;11:1021-30. 5. Pycha A, Lodde M, Lusuardi L, Palermo S, Signorello D, Galantini A, et al. Teaching transurethral resection of the bladder: still a challenge? Urology. 2003;62(1):46-8. 6. Mahoney SA, Forsythe WE III, Persky L. Intraperitoneal extravasation of irrigating solutions. J Urol. 1965;94(3):276-81. 7. Marmar JL, Allen SD. The transurethral resection reaction secondary to intraperitoneal extravasation of irrigating solution. J Urol. 1970;104(3):457-8. 8. Hahn RG. Transurethral resection syndrome after transurethral resction of bladder tumours. Can J Anesth. 1995;42(1):69-72. 9. Dorotta I, Basali A, Ritchey M, O’Hara JF, Sprung J. Transurethral resection syndrome after bladder perforation. Anesth Analg. 2003;97(5):1536-8. 10. Montesinos A, Banús JM, Palou J, Nogueron M, Macias N. Physiopathology and surgical treatment of extravasated peritoneal fluid after transurethral resection. Eur Urol. 1984;10:183-6. 11. Murshidi MS. Intraperitoneal rupture of the urinary bladder during transurethral resection of transicional cell carcinoma. Acta Urol Belg. 1988;56(1):68-73. 12. Manikandan R, Lynch N, Grills RJ. Percutaneous peritoneal drainage for intraperitoneal bladder perforations during transurethral resection of bladder tumors. J Endourol. 2003;17(10):945-7. 13. Pansadoro A, Franco G, LAurenti C, Pansadoro V. Conservative tratment of intraperitoneal bladder prforation during transurethral resection of bladder tumor. Urology. 2002;60(4):682-4. MASTOCITOSIS SISTÉMICA: MANEJO PERIOPERATORIO. A PROPÓSITO DE DOS CASOS Sr. Director: La mastocitosis es una enfermedad que se caracteriza por la proliferación de mastocitos en el tracto gastrointestinal, hígado, bazo, nódulos linfoides, hueso y otros tejidos1. La degranulación de los mastocitos y consecuente liberación de histamina está desencadenada por factores como el estrés físico o emocional, el alcohol y fármacos liberadores de histamina. Cuando la degranulación ocurre durante el transcurso de una intervención quirúrgica, puede conllevar hipotensión severa, taquicardia, broncoespasmo y coagulopatía. El control y monitorización perioperatorio, tanto anestésico como analgésico, junto con una cuidadosa selección de los fármacos, es esencial para el manejo de este tipo de pacientes. 192 Describiremos el manejo preoperatorio, intraoperatorio y postoperatorio anestésico y analgésico de dos pacientes que iban a ser intervenidos quirúrgicamente con anestesia general y que padecían mastocitosis sistémica (MS). Mujer de 78 años programada para colecistectomía abierta por colelitiasis. Como antecedentes personales destacaba hipercolesterolemia en tratamiento dietético y mastocitosis sistémica subtipo II diagnosticada tras presentar un shock anafiláctico por picadura de himenóptero. Ingresó el día previo a la intervención quirúrgica para premedicación específica en pacientes con mastocitosis. Esta premedicación consistió en prednisona 60 mg i.v tres dosis administradas previamente a la cirugía, maleato de dexclorfeniramina 5 mg i.v 1 hora antes de la anestesia, ranitidina 100 mg i.v 1 hora antes de la anestesia, montelukast 1 comprimido de 10 mg v.o 24 horas antes de la anestesia y una hora antes de la misma y loracepan 5 mg v.o la noche anterior y treinta minutos antes de la intervención. Para el correcto control del dolor postoperatorio se realizó una analgesia de tipo multimodal con catéter epidural insertado a nivel T11-T12. Durante la inducción de la anestesia se administraron etomidato (0,23 mg/kg), fentanilo (3,84 μg/kg) y rocuronio (0,615 mg/kg). El mantenimiento anestésico se realizó con sevofluorano (Et 1-2%). Veinte minutos antes del final de la intervención se administraron 4 mg de ondansetrón i.v y una dosis por catéter epidural de 26,5 mg de ropivacaína y 50 μg de fentanilo. No se apreciaron crisis hipotensivas, salvas de taquicardia ni cambios de coloración cutánea. Tras una hora y media de anestesia balanceada se despertó a la paciente sin incidencias se trasladó a la Unidad de Reanimación desde donde pasó a planta de hospitalización a las 24 h. Durante el postoperatorio se mantuvo tratamiento con antihistamínicos tipo 1 y 2, antileucotrienos y corticoides además de analgesia multimodal con paracetamol i.v e infusión de ropivacaína y fentanilo vía epidural. Durante todo el tratamiento evitamos el uso de fármacos histaminoliberadores (básicamente morfina, codeína, atropina y AINES incluido metamizol). La paciente fue dada de alta a los cuatro días sin incidencias reseñables. Varón de 63 años diagnosticado de MS agresiva programado para resección de masa cervicolateral. Presentaba asma leve (en tratamiento con broncodilatadores) y MS agresiva con infiltración esplénica, ganglionar y de médula ósea. Se premedicó como a la paciente anterior y para la inducción se emplearon los mismos fármacos con dosis ajustadas al paciente y tipo de intervención. En el mantenimiento anestésico se utilizó sevoflurane y dosis intermitentes de fentanilo. Veinte minutos antes de la educción se administró 1 g de paracetamol iv. No presentó tampoco crisis hipotensivas, episodios de taquicardia ni cambios de coloración cutánea. Tras una hora de intervención quirúrgica, pasó a la Unidad de Recuperación Postanestésica y tras cumplir criterios de alta de la misma pasó a planta de hospitalización. Se analizaron los niveles de histamina, IgE y triptasa previo, intra y post-intervención quirúrgica. No se observaron alteraciones de los valores en ninguno de los dos pacientes. Los mastocitos son células relacionadas con reacciones 66 Documento descargado de http://www.elsevier.es el 20/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. CARTAS AL DIRECTOR de hipersensibilidad como la urticaria, anafilaxis y otros procesos alérgicos. Los mastocitos proceden de precursores de la médula ósea y pasando de ahí a la sangre, se redistribuyen por todo el organismo1. La mastocitosis es una enfermedad poco frecuente caracterizada por la proliferación de mastocitos en el tracto gastrointestinal, hígado, bazo, nódulos linfoides, huesos y otros tejidos1. La variedad de mastocitosis cutánea está limitada a la piel. La mayoría de los casos de mastocitosis son esporádicos y afecta a los dos sexos por igual, más frecuentemente en la raza blanca y no tiene carácter hereditario. La incidencia acumulada de anafilaxia es mayor en adultos que en niños2. La etiología es desconocida. El diagnóstico definitivo es histológico. La clasificación de la mastocitosis se basa en las manifestaciones clínicas3,4, de esta manera, la Organización Mundial de la Salud (OMS) define las variantes de esta enfermedad en siete tipos (Tabla 1). La activación de los mastocitos puede ser mediada por las inmunoglobulinas (Ig) tipo E, o por estímulos no inmunológicos, como las picaduras de insectos, cambios de temperatura, alcohol y estrés emocional. Algunos fármacos que se utilizan durante la anestesia son desencadenadores de la degranulación mastocitaria, cuya liberación reproduce un cuadro clínico que puede ir desde un leve prurito hasta un shock anafiláctico que conduzca a la muerte del paciente. La histamina, mediante la unión a los receptores tipo 1 produce un enlentecimiento de la conducción aurículo-ventricular y una vasoconstricción coronaria epicárdica, mientras que la unión a los receptores tipo 2 produce una vasodilatación coronaria, taquicardia y aumento de la contractilidad miocárdica5. La administración de antihistamínicos tipo 1 y tipo 2 se ha demostrado que es capaz de disminuir significativamente la taquicardia, bradicardia, hipotensión arterial, respuestas cutáneas e incluso la disminución del pH gástrico, inducidos todo ellos por la liberación de histamina5. Así mismo acompañando a los antihistamínicos se deben administrar corticoides y benzodiacepinas3,5,6. Los corticoides disminuyen el riesgo de degranulación mastocitaria en respuesta al estrés y a la broncoconstricción6. El uso de benzodiacepinas también disminuye el estrés y la incidencia de reacciones anafilácticas6. Por todo ello, en nuestros dos pacientes administramos prednisona, maleato de dexclorfeniramina, ranitidina, loracepan y midazolam. Para la inducción está demostrado el nulo efecto liberador de histamina del etomidato3, que se considera fármaco de elección en pacientes con mastocitosis. El propofol, la ketamina y los anestésicos inhalados, no se les considera liberadores de histamina y se pueden usar en concentraciones suficientes para mantener una anestesia profunda3. Los bloqueantes neuromusculares (BNM) están ligados a reacciones anafilácticas y anafilactoides. En 1990, departamentos de Anestesia y Alergología de 21 hospitales franceses estudiaron la proporción real de reacciones anafilácticas y anafilactoides vinculadas a los fármacos utilizados en anestesia. Comprobaron que los BNM fueron la principal causa de reacciones anafilactoides (70%) seguidos del látex (12,6%)7. Dentro de los BNM el principal responsable fue la succinilcolina (43%)7. Igea et al. refieren que el atracurio fue el BNM de mayor potencia 67 TABLA 1 Clasificación actual de la mastocitosis4,5 Tipo 1 Mastocitosis cutánea – Urticaria pigmentosa (UP). – Mastocitoma cutáneo. Tipo 2 Mastocitosis sistemica indolente – (Aislada) de médula ósea mastocitosis. – Combustión lenta mastocitosis sistémica. Tipo 3 Mastocitosis sistemica con ANHMD Tipo 4 Mastocitosis sistémica agresiva – Mastocitosis linfoadenopática con eosinofilia. Tipo 5 Leucemia de mastocitos (MCL) – Clásica MCL. – Variante aleucémica de MCL. Tipo 6 Sarcoma de mastocitos Tipo 7 Mastocitoma extracutáneo liberadora de histamina seguido por succinilcolina, pancuronio y por último, el vecuronio8. El rocuronio es un BNM aminoesteroideo cuaternario con farmacocinética similar al vecuronio, es menos potente y presenta tiempo de inicio de acción más corto9. La dosis efectiva 95 (DE95) del rocuronio es de 0,3 mg/kg. Estudios clínicos en el ser humano no han demostrado liberación de histamina con dosis de hasta 4 veces la DE95 de rocuronio. No se han demostrado aumento de los niveles plasmáticos de histamina después de 1, 3 y 5 minutos de una inyección endovenosa rápida de rocuronio, usando dosis de 0,6, 0,9 y 1,2 mg/kg. Tampoco existen claras diferencias entre cisatracurio y rocuronio en los tests cutáneos. Mark et al. evaluaron los efectos hemodinámicos producidos por el bromuro de rocuronio concluyendo que las dosis clínicas del rocuronio no estaban asociadas a inestabilidad hemodinámica. Es por todo esto que en nuestro caso elegimos rocuronio como BNM. En el caso de la analgesia, en la mastocitosis las técnicas regionales son de elección6,9. Los anestésicos locales más indicados son del tipo amida6. Dentro de los opiáceos, el fentanilo es el más utilizado por su elevada potencia analgésica y por su seguridad6,8,9. La morfina, sin embargo, está formalmente contraindicada. El tramadol, metamizol y otros AINEs no son de elección6,8,9. Dentro de los analgésicos no opiáceos, el paracetamol es el más indicado6,8. Así pues concluimos que los fármacos elegidos deben tener el menor efecto liberador de histamina posible. El rocuronio es una buena alternativa al vecuronio como BNM, ya que durante la anestesia garantiza la nula liberación de histamina y permite una intubación rápida. Extremando las atenciones y los cuidados pre, intra y postoperatoriamente, el riesgo de anafilaxis puede minimizarse significativamente en pacientes con mastocitosis sistémica. N. Calvo, S. Telletxea, K. Intxaurraga, A. Arízaga Servicio de Anestesiología, Reanimación y Tratamiento del Dolor. Hospital de Galdákao-Usansolo. Galdakao. Bizkaia. 193 Documento descargado de http://www.elsevier.es el 20/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. CARTAS AL DIRECTOR BIBLIOGRAFÍA 1. Patnaik MM, Rindos M, Kouides PA, Tefferi A, Pardanani A. Systemic mastocytosis: a concise clinical and laboratory review. Arch Pathol Lab Med. 2007;131(5):784-91. 2. Brockow K, Jofer C, Behrendt H, Ring J. Anaphylaxis in patients whith mastocytosis: a study on history, clinical features and risk factors in 120 patients. Allergy. 2008;63(2):226-32. 3. Longás J, Martínez J, Muñoz L, Girón JA, Gonzalo I, Pardillos C. Manejo anestésico de la mastocitosis. Rev Esp Anestesiol Reanim. 2005;52(2):105-8. 4. Valent P, Akin C, Escribano L, Fodinger M, Brockow K, Castells M, et al. Standards and standardization in mastocytosis: consensus statements on diagnostics, treatment recomendations and response criteria. Eur J Clin Invest. 2007;37(6):435-53. 5. Kimura K, Adachi M, Kubo K. H1 and H2 receptor antagonist prevent histamine release in allergic patients after administration of midazolam 194 6. 7. 8. 9. 10. and ketamine. A randomized controlled study. Inflamm Res. 1999;48(3):128-32. Duran P, Castro LE, Campo GD, Suso B. Analgesia en pacientes con mastocitosis. Algia. 2006;1:17-22. Laxenaire MC. Drugs and other agents involved in anaphylactic shock occurring during anaesthesia. A French multicenter epidemiological inquiry. Ann Fr Anesth Reanim. 1993;12(2):91-6. Igea JM, Fernández M, Lázaro M. Efecto liberador de histamina de los fármacos utilizados en la anestesia general. Rev Esp Alergol Inmunol Clin. 1996;11(2):117-26. Telletxea S, Calvo N, Intxaurraga K, Arízaga A. Comentario a la carta “Mastocitosis sistémica y anestesia. A propósito de un caso”. Rev. Esp. Anestesiol. Reanim. 2008;55(6):385-6. Berg CM, Heier T, Wilhelmsen V, Florvaag E. Rocuronium and cisatracurium-positive skin tests in non-allergic volunteers: determination of drug concentration thresholds using a dilution titration technique. Acta Anaesthesiol Scand. 2003;7:576-82. 68