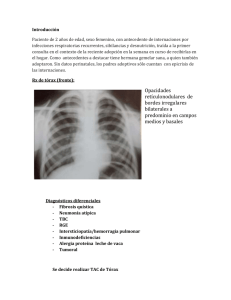
Hemosiderófagos en las secreciones respiratorias. Significado
Anuncio

Documento descargado de http://www.elsevier.es el 20/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. EDITORIALES Hemosiderófagos en las secreciones respiratorias. Significado biológico y utilidad clínica 94.769 José Luis Pérez Arellano y Alfonso Ángel-Moreno Maroto Servicio de Medicina Interna. Hospital Universitario Insular de Gran Canaria. Departamento de Ciencias Médicas y Quirúrgicas. Universidad de Las Palmas de Gran Canaria. Las Palmas de Gran Canaria. España. Los hemosiderófagos son células del sistema mononuclearfagocítico (habitualmente macrófagos) en los que puede identificarse la presencia de hemosiderina mediante técnicas inmunoquímicas. Aunque estas células pueden observarse en múltiples tejidos, normales o neoplásicos1, en este editorial nos referiremos de forma exclusiva a los hemosiderófagos presentes en el pulmón y las secreciones respiratorias. La formación de hemosiderófagos requiere la interacción, durante un tiempo mínimo, entre dos elementos esenciales (macrófagos y compuestos de hierro). Los macrófagos constituyen la principal población celular presente en la región alveolar normal2. Estas células derivan principalmente de los monocitos sanguíneos, aunque también tienen una cierta capacidad proliferativa. En la región alveolar actúan como mecanismo de defensa inespecífico, fagocitando microorganismos, sustancias químicas y restos celulares. La principal vía de eliminación de los macrófagos alveolares es la bronquial; acceden hasta la orofaringe, desde donde son eliminados al exterior por la expectoración o deglutidos. Otra vía de eliminación importante desde un punto de vista patogénico es la linfática, mediante el transporte de antígenos hasta los ganglios regionales. El aporte de hierro a la región alveolar puede proceder de contaminantes atmosféricos o, lo que es más habitual, del hierro contenido en la hemoglobina3,4. A su vez, los hematíes pueden proceder del exterior (aspirado de sangre desde las vías respiratorias) o de alteraciones de la barrera alvéolo-capilar (hemorragia alveolar). La hemoglobina de los hematíes fagocitados aporta hierro a los macrófagos alveolares, utilizado posteriormente para la síntesis de ferritina y productos insolubles que reciben la denominación de hemosiderina4. Este proceso no es inmediato, y requiere un tiempo variable según los distintos estudios. Así, en estudios experimentales5,6, parece establecido que el tiempo mínimo para que pueda detectarse hemosiderina intramacrofágica es de 3 días, alcanzando un máximo a los 5-7 días tras la presencia de hematíes en el alvéolo. Un aspecto menos claro es el tiempo de persistencia de hemosiderófagos en el pulmón tras un único episodio de hemorragia, que puede oscilar entre las 2 semanas y 2 meses5,6. Por ello, desde un punto de vista práctico, la presencia de hemosiderófagos en las secreciones respiratorias no permite distinguir de forma adecuada entre una hemorragia actual o previa. La demostración de hemosiderófagos en biopsias pulmonares, en el estudio citológico del lavado broncoalveolar o en el esputo, se realiza mediante la tinción de Perls7. La forma Correspondencia: Prof. J.L. Pérez Arellano. Departamento de Ciencias Médicas y Quirúrgicas. Centro de Ciencias de la Salud. Universidad de Las Palmas de Gran Canaria. 35080 Las Palmas de Gran Canaria. España. Correo electrónico: jlperez@dcmq.ulpgc.es Recibido el 11-1-2005; aceptado para su publicación el 28-1-2005. 576 Med Clin (Barc). 2005;124(15):576-7 habitual de expresar esta magnitud es considerar el porcentaje de macrófagos que presentan pigmento, aunque es interesante señalar que como su contenido puede ser muy variable, en determinadas situaciones es más útil indicar la presencia de hemosiderófagos en forma de puntuación (score de hemosiderina)7. La principal utilidad diagnóstica tradicional del estudio de hemosiderófagos, empleando como muestra biológica el líquido de lavado broncoalveolar, ha sido el diagnóstico sindrómico de hemorragia alveolar difusa. Teniendo en cuenta que, en individuos sanos no fumadores, se ha demostrado la presencia de hasta un 5% de hemosiderófagos6,7, la mera detección de estas células no es suficiente para el diagnóstico de hemorragia pulmonar difusa, y se considera esta entidad cuando en el lavado broncoalveolar se encuentra un porcentaje de macrófagos cargados con hemosiderina igual o mayor al 20%8,9. Una vez realizado el diagnóstico sindrómico de hemosiderosis es habitual distinguir entre las formas que asocian capilaritis y los síndromes no inflamatorios10. Dentro de las formas con capilaritis, las principales entidades en las que aparece hemosiderosis son las vasculitis10,11 y, en mucha menor medida, algunas colagenosis (p. ej., lupus eritematoso sistémico)10,11. Los dos ejemplos clásicos de hemosiderosis pulmonar difusa sin capilaritis son la estenosis mitral y la hemosiderosis pulmonar idiopática12,13, aunque el número de causas responsables continúa incrementándose (p. ej. agentes físicos, como el mal de altura14, sustancias químicas, como el crack15 o malformaciones vasculares16). Sin embargo, debemos señalar que esta clasificación de los síndromes de hemorragia pulmonar difusa tiene sus limitaciones. Por ejemplo: a) algunos fármacos como el sirolimus, pueden dar lugar a dos formas diferentes de hemosiderosis pulmonar, con o sin inflamación linfocitaria17; b) algunos pacientes con enfermedades intersticiales clásicas (p. ej., sarcoidosis o fibrosis pulmonar idiopática) en las que hay una inflamación alveolar, presentan valores de hemosiderófagos superiores al 20%7; c) en casos claramente establecidos de hemosiderosis secundaria a estenosis mitral, el estudio histopatológico pulmonar demuestra infiltrados inflamatorios12, y d) hay una respuesta parcial a corticoides en algunas formas de hemosiderosis pulmonar idiopática13. En los últimos años, la medida del número de hemosiderófagos en las secreciones respiratorias está aportando nuevos datos de utilidad en la práctica clínica. El artículo publicado en este número de MEDICINA CLÍNICA18 por el equipo multidisciplinario del Hospital de la Santa Creu i de Sant Pau es un claro ejemplo de la afirmación previa. En este trabajo, que completa y matiza datos ya publicados por el mismo grupo19, los autores emplean la determinación de hemosiderófagos en el esputo inducido en el diagnóstico diferencial del paciente con disnea. A nuestro juicio, el trabajo mencionado tiene un gran interés por varios aspectos: a) aborda un problema frecuente y complejo: el diagnóstico diferencial 26 Documento descargado de http://www.elsevier.es el 20/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. PÉREZ ARELLANO JL, ET AL. HEMOSIDERÓFAGOS EN LAS SECRECIONES RESPIRATORIAS. SIGNIFICADO BIOLÓGICO Y UTILIDAD CLÍNICA del paciente con disnea aguda; b) utiliza dos determinaciones incruentas: el estudio del esputo inducido, basándose en el trabajo de Leigh et al20, y la determinación de la concentración sérica del péptido natriurético N-BNP (N-terminal pro-brain natriuretic peptide), y c) indica la utilidad de la cuantificación de hemosiderófagos en el esputo en las circunstancias en que la determinación de N-BNP no aporta resultados concluyentes (disnea «mixta» cardíaca y respiratoria). Evidentemente, como en cualquier trabajo científico, son precisos más estudios que confirmen los hallazgos mencionados antes de su aplicación a la práctica clínica diaria. Además, hay algunas limitaciones en el trabajo, ya mencionadas por los propios autores, que deben acotar el campo de aplicación. Por un lado, debería establecerse el «valor normal» de hemosiderófagos en el esputo en cada ámbito geográfico, ya que la contaminación ambiental incrementa notablemente esta magnitud3. Por otro lado, el término «disnea respiratoria» debería matizarse de forma más precisa. Aunque evidentemente, la mayor parte de los casos de disnea «problemática» corresponden a pacientes fumadores, en los que hay un riesgo aumentado de enfermedad pulmonar obstructiva crónica y de cardiopatía (isquémica y/o hipertensiva), lógicamente los pacientes con enfermedad pulmonar intersticial también presentan «disnea respiratoria» y, por los datos mencionados previamente, también pueden presentar un elevado recuento de hemosiderófagos. Finalmente, el trabajo mencionado plantea múltiples preguntas relacionadas con la patogenia de la afección pulmonar en la insuficiencia cardíaca. Así, por ejemplo, además del incremento de presión como agente físico21, sería interesante conocer la intervención de mediadores químicos implicados en la alteración de la barrera alvéolo-capilar en la insuficiencia cardíaca izquierda (p. ej., VEGF [vascular endotelial growth factor]22, endotelina-115). Por otro lado, tendría interés evaluar la relación entre la hemorragia alveolar con la inflamación subclínica en pacientes con insuficiencia cardíaca congestiva. En este sentido, cabe realizar dos observaciones: a) la hemorragia alveolar desencadena una respuesta inflamatoria local (aumento de todos los tipos de células inflamatorias5, presumiblemente ligado a la generación de hierro libre4), y b) existe una asociación significativa entre el aumento de la velocidad de sedimentación globular (como marcador inespecífico de inflamación) y la supervivencia de los pacientes con insuficiencia cardíaca congestiva23. Finalmente, la magnitud de la hemosiderosis detectada en este estudio debe hacer reconsiderar de forma individual la ferropenia como mecanismo de la anemia en pacientes con insuficiencia cardíaca congestiva. De hecho, en un estudio realizado con un objetivo diferente, hasta un 10% de pacientes con insuficiencia cardíaca presentaban esta deficiencia24. El estudio de Bellido-Casado et al aporta múltiples datos interesantes, aunque preliminares, tanto para la asistencia al paciente como para la investigación de aspectos patogénicos clave en la insuficiencia cardíaca congestiva. 27 REFERENCIAS BIBLIOGRÁFICAS 1. Gupta K, Dey P, Goldsmith R, Vasishta RK. Comparison of cytologic features of giant-cell tumor and giant-cell tumor of tendon sheath. Diagn Cytopathol. 2004;30:14-8. 2. Pérez Arellano JL, Alcázar Montero MC, Jiménez A. Alveolar macrophage: Origin, kinetics and relationships with cells of the alveolo-interstitial region. Allergol Immunopathol. 1990;18:175-83. 3. Roy S, Ray MR, Basu C, Lahiri P, Lahiri T. Abundance of siderophages in sputum: indicator of an adverse lung reaction to air pollution. Acta Cytol. 2001;45:958-64. 4. Mateos Rodríguez F, Brock JH, Pérez Arellano JL. Iron metabolism in the lower respiratory tract. Thorax. 1998;53:594-600. 5. Epstein CE, Elidemir O, Colasurdo GN, Fan LL. Time course of hemosiderin production by alveolar macrophages in a murine model. Chest. 2001;120:2013-20. 6. Sherman JM, Winnie G, Thomassen MJ, Abdul-Karim FW, Boat TF. Time course of hemosiderin production and clearance by human pulmonary macrophages. Chest. 1984;86:409-11. 7. Pérez Arellano JL, Losa JE, García Macías MC, Gómez F, Jiménez A, De Castro S. Hemosiderin-loaded macrophages in bronchoalveolar lavage fluid. Acta Cytol (Baltimore). 1992;36:26-30. 8. Cordonnier C, Bernaudin JF, Fleury J, Feuilhade M, Haioun C, Payen D, et al. Diagnostic yield of bronchoalveolar lavage in pneumonitis occurring after allogeneic bone marrow transplantation. Am Rev Respir Dis. 1985;132:1118-23. 9. Drew WL, Finley TN, Golde DW. Diagnostic lavage and occult pulmonary hemorrhage in thrombocytopenic immunocompromised patients. Am Rev Respir Dis. 1977;116:215-21. 10. Schnabel A, Reuter M, Csernok E, Richter C, Gross WL. Subclinical alveolar bleeding in pulmonary vasculitides: correlation with indices of disease activity. Eur Respir J. 1999;14:118-24. 11. Lauque D, Cadranel J, Lazor R, Pourrat J, Ronco P, Guillevin L, et al. Microscopic polyangiitis with alveolar hemorrhage. A study of 29 cases and review of the literature. Medicine (Baltimore). 2000;79:222-33. 12. Spence TH, Connors JC. Diffuse alveolar hemorrhage syndrome due to «silent» mitral valve regurgitation. South Med J. 2000;93:65-7. 13. Ioachimescu OC, Sieber S, Kotch A. Idiopathic pulmonary haemosiderosis revisited. Eur Respir J. 2004;24:162-70. 14. Grissom CK, Albertine KH, Elstad MR. Alveolar haemorrhage in a case of high altitude pulmonary oedema. Thorax. 2000;55:167-9. 15. Baldwin GC, Choi R, Roth MD, Shay AH, Kleerup EC, Simmons MS, et al. Evidence of chronic damage to the pulmonary microcirculation in habitual users of alkaloidal («crack») cocaine. Chest. 2002;121:1231-8. 16. Almagro P, Julia J, Sanjaume M, González G, Casalots J, Heredia JL, et al. Pulmonary capillary hemangiomatosis associated with primary pulmonary hypertension: report of 2 new cases and review of 35 cases from the literature. Medicine (Baltimore). 2002;81:417-24. 17. Vlahakis NE, Rickman OB, Morgenthaler T. Sirolimus-associated diffuse alveolar hemorrhage. Mayo Clin Proc. 2004;79:541-5. 18. Bellido-Casado J, Bayés-Genis A, López L, Margarit G, Cotes C, SantalóBel M, et al. Recuento de hemosiderófagos en el esputo en el diagnóstico de la disnea de origen cardíaco. Med Clin (Barc). 2005;124:566-70. 19. Bayes-Genis A, Bellido-Casado J, Zapico E, Cotes C, Belda J, López L, et al. N-terminal pro-brain natriuretic peptide reflects pulmonary capillary leakage in patients with acute dyspnea. Am J Cardiol. 2004;94:669-70. 20. Leigh R, Sharon RF, Efthimiadis A, Hargreave FE, Kitching AD. Diagnosis of left- ventricular dysfunction from induced sputum examination. Lancet. 1999;354:833-4. 21. West JB, Mathieu-Costello O. Vulnerability of pulmonary capillaries in heart disease. Circulation. 1995;92:622-31. 22. Le Cras TD, Spitzmiller RE, Albertine KH, Greenberg JM, Whitsett JA, Akeson AL. VEGF causes pulmonary hemorrhage, hemosiderosis, and air space enlargement in neonatal mice. Am J Physiol Lung Cell Mol Physiol. 2004;287:L134-42. 23. Sharma R, Rauchhaus M, Ponikowski PP, Varney S, Pode-Wilson PA, Mann DL, et al. The relationship of the erythrocyte sedimentation rate to inflammatory cytokines and survival in patients with chronic heart failure treated with angiotensin-converting enzyme inhibitors. J Am Coll Cardiol. 2000;36:523-8. 24. Witte KK, DeSilva R, Chattopadhyay S, Ghosh J, Cleland JG, Clark AL. Are hematinic deficiencies the cause of anemia in chronic heart failure? Am Heart J. 2004;147:924-30. Med Clin (Barc). 2005;124(15):576-7 577