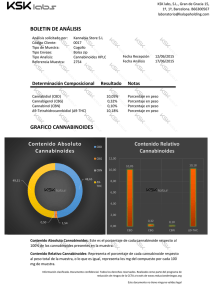
APOPTOSIS INDUCIDA POR CANNABINOIDES EN LAS CÉLULAS
Anuncio

APOPTOSIS INDUCIDA POR CANNABINOIDES EN LAS CÉLULAS INMUNES COMO UN CAMINO HACIA LA INMUNOSUPRESIÓN REVISIÓN MCCR Los cannabinoides son un grupo de compuestos presentes en la planta de Cannabis Sativa. Ellos median sus efectos fisiológicos y de comportamiento mediante la activación de los receptores de cannabinoides específicos. Los cannabinoides han demostrado que actúan como inmunosupresores potentes, agentes antiinflamatorios y se ha demostrado que tienen efectos beneficiosos en una amplia gama de enfermedades inmunomediadas, tales como la esclerosis múltiple, la diabetes, el choque séptico, la artritis reumatoide, y el asma alérgica. El receptor de cannabinoides 1 (CB1) se expresa principalmente en las células del sistema nervioso central, así como en la periferia y el receptor de cannabinoide 2 (CB2) se expresa predominantemente en las células inmunes. Estudios realizados en nuestro laboratorio se han centrado en los mecanismos de inducción de apoptosis por los cannabinoides naturales y sintéticos a través de la activación de los receptores CB2. En esta revisión, nos centraremos en los mecanismos apoptóticos de la inmunosupresión mediada por los cannabinoides en las diferentes poblaciones de células inmunes y discutir cómo la activación de CB2 proporciona una nueva modalidad terapéutica contra las enfermedades inflamatorias y autoinmunes, así como tumores malignos del sistema inmune. “El potencial terapéutico antiinflamatorio de los cannabinoides es evidente a partir de los estudios discutidos en este artículo de revisión” El mecanismo independiente del receptor de acción es evidente para los cannabinoides en algunas poblaciones de células. Además de la utilización de los cannabinoides exógenos, en la manipulación in vivo de los endocannabinoides también pueden ofrecer nuevas oportunidades de tratamiento contra el cáncer y enfermedades autoinmunes. 2015 Este documento es solo para fines educativos y uso no comercial. Más información en www.medicalcannabiscostarica.org RESUMEN ABSTRACTO Los cannabinoides son un grupo de compuestos presentes en la planta del cáñamo (Cannabis sativa L.). Ellos median sus efectos fisiológicos y de comportamiento mediante la activación de los receptores de cannabinoides específicos. Con el reciente descubrimiento de los receptores de cannabinoides (CB1 y CB2) y el sistema endocannabinoide, la investigación en este campo se ha ampliado de manera exponencial. Los cannabinoides se han demostrado que actúa como inmunosupresores potentes y agentes anti-inflamatorios y se ha demostrado para mediar efectos beneficiosos en una amplia gama de enfermedades inmunomediadas, tales como la esclerosis múltiple, la diabetes, el choque séptico, la artritis reumatoide, y el asma alérgica. El receptor de cannabinoides 1 (CB1) se expresa principalmente en las células del sistema nervioso central, así como en la periferia. En contraste, el receptor de cannabinoide 2 (CB2) se expresa predominantemente en las células inmunes. Los mecanismos precisos a través del cual los cannabinoides median inmunosupresión sólo ahora está empezando a ser entendidos y se pueden categorizar ampliamente en cuatro vías: la apoptosis, la inhibición de la proliferación, la supresión de citoquinas y quimio quinas y la inducción de células T reguladoras (T regs). Estudios realizados en nuestro laboratorio se han centrado en los mecanismos de inducción de apoptosis por los cannabinoides naturales y sintéticos a través de la activación de los receptores CB2. En esta revisión, nos centraremos en los mecanismos apoptóticos de la inmunosupresión mediada por los cannabinoides en las diferentes poblaciones de células inmunes y discutir cómo la activación de CB2 proporciona una nueva modalidad terapéutica contra las enfermedades inflamatorias y autoinmunes, así como tumores malignos del sistema inmune, sin ejercer la psicotrópica desfavorable efectos. INTRODUCCIÓN Los cannabinoides son un grupo de compuestos que se encuentran en la planta de marihuana (Cannabis sativa L.). La marihuana ha sido utilizada tanto para fines recreativos y medicinales desde hace varios siglos. Los cannabinoides se han demostrado ser eficaces en el tratamiento de las náuseas y vómitos asociados con la quimioterapia del cáncer, anorexia y caquexia se observa en pacientes con VIH / SIDA, así como el dolor neuropático, y la espasticidad en esclerosis múltiple. Más recientemente, las propiedades anti-inflamatorias de los cannabinoides están llamando la atención significativa. En los últimos 15 años, los estudios con los cannabinoides marihuana llevaron al descubrimiento de los receptores de cannabinoides (CB1 y CB2) y sus ligados endógenos, que forman lo que se conoce como el sistema endocannabinoide. CB1 se expresa en los tejidos de tanto el sistema nervioso central (CNS) y la periferia, con una expresión predominante en los nervios presinápticos.CB2, a veces referido como el “receptor cannabinoide periférico”, se expresa principalmente en las células inmunitarias, pero también se puede encontrar en otros 2015 Este documento es solo para fines educativos y uso no comercial. Más información en www.medicalcannabiscostarica.org tejidos periféricos tales como la retina y en el SNC. El sistema endocannabinoide modula muchas funciones, tales como el movimiento, la memoria, el apetito, la regulación de la temperatura corporal, el dolor y las funciones inmunes. Los cannabinoides naturales y sintéticos se derivan de plantas de marihuana, mientras que los endocannabinoides son metabolitos del ácido araquidónico. El mecanismo de la inmunosupresión por los cannabinoides ha sido investigado tanto in vitro como en estudios in vivo; Sin embargo, aún quedan muchas preguntas. En general, se sabe que desde los cannabinoides se unen a receptores CB1 y CB2, que ejercen sus efectos a través de la inhibición de la actividad de la adenilato ciclasa; bloqueando de este modo la activación de AMPc estimulada por forskolina. Este proceso conduce a la disminución de la actividad de la proteína quinasa A, y, posteriormente, a menor unión de factores de transcripción a las secuencias de consenso de CRE, y una disfunción en la producción de IL-2. En estudios de células NK, se demostró que cuando pre tratados con THC, las células NK tenían un defecto en receptor IL-2 con la disminución de IL-2 sitios de unión; Por lo tanto, la IL-2 de las células estimuladas eran incapaces de matar células EL-4 tumorales. Mostró que la disminución de la proliferación de timocitos por tratamiento de THC se debe a la inhibición de Ca 2 + estabilización dentro de la célula. Hay pocos informes también muestran acciones independiente del receptor de cannabinoides, tales como en las células B y las neuronas corticales de rata. La apoptosis es el proceso de muerte celular programada que puede ser inducida por factores intrínsecos, factores extrínsecos o ambos. Debido a que la apoptosis elimina las células dañadas, dañinos y no deseados, es significativo en los procesos biológicos, incluyendo el desarrollo, la morfogénesis y la homeostasis. Durante la apoptosis, muchos cambios morfológicos ocurren como blebbing membrana, encogimiento celular, la fuga mitocondrias, y la fragmentación nuclear. Los cambios moleculares subyacen a estos cambios morfológicos, y constituyen las dos vías diferentes de la apoptosis: (1) la vía intrínseca – a través de las mitocondrias, y (2) de la vía extrínseca – a través de los receptores de muerte. En pocas palabras, la ruta intrínseca se inicia por un desequilibrio en el anti-apoptóticas y pro-apoptóticos miembros de la familia Bcl-2 de proteínas que regulan la permeabilidad de la membrana mitocondrial. El desequilibrio hacia este último conduce a la citocromo c fugas en el citosol. El citocromo c se combina con la procaspasa 9, ATP y Apaf-1 para formar el apoptosoma. Los resultados apoptosoma en la formación de la caspasa activa 9, se escinde la procaspasa 3 en la caspasa 3 activa, y conduce a la apoptosis. La vía extrínseca se activa con la ligación de receptores de muerte tales como la familia del receptor del factor de necrosis tumoral (es decir CD95), y los resultados en la formación del complejo de señalización para inducir la muerte (DISC). Disco contiene caspasa 8 y caspasa 10 como las caspasas iniciadoras, y estas caspasas activar la caspasa 3, lo que resulta en la apoptosis. APOPTOSIS INDUCIDA POR CANNABINOIDES EN LAS CÉLULAS T 2015 Este documento es solo para fines educativos y uso no comercial. Más información en www.medicalcannabiscostarica.org Mientras que el fumar marihuana o la exposición a cannabinoides marihuana puede causar lesión pulmonar, Delta9-etrahydrocannabinol (THC) en modelos experimentales se ha demostrado para suprimir las funciones inmunes y aumentar la susceptibilidad a las infecciones. Estudios in vitro revelaron que el THC puede ejercer un efecto directo sobre las células inmunes por la inhibición de la proliferación de linfocitos en cultivo, aunque los mecanismos precisos sigue siendo poco clara. En 1994, la anandamida, un ligando del receptor cannabinoide endógeno fue mostrado para inducir la apoptosis en cultivos de linfocitos humanos. Este estudio también se extendió a murino macrófagos y células T, mostrando que el tratamiento de THC de células inmunes cultivadas activa la apoptosis a través de la regulación de la actividad de Bcl-2 y la caspasa. Si bien estos estudios abren nuevas vías para investigar más a fondo la apoptosis como un mecanismo de inmunotoxicidad en vivo inducida por el THC, no se realizaron estudios adicionales para demostrar estos efectos in vivo. Una de las razones podría haber sido que la detección de la apoptosis in vivo es difícil, ya que las células apoptóticas se borran rápidamente y eficientemente a través de la fagocitosis. Estudios realizados en nuestro laboratorio establecieron este hecho mediante una serie de medicamentos y productos químicos de los cuales 2, 3, 7, 8-tetraclorodibenzo-p-dioxina (TCDD) y dexametasona. En estos estudios, hemos observado que si las células inmunes expuestas a un producto químico apoptótica in vivo, se cultivanin vitro para un adicional de 12 a 24 h, exhiben marcadas aumento en la apoptosis debido a su incapacidad para ser limpiado in vitro por los fagocitos. Por ello, realizó una investigación sistemática sobre si los cannabinoides inducen apoptosis in vivo, utilizando ratones normales y demostró de manera concluyente que el THC y otros cannabinoides hacen, lo que puede explicar la inmunotoxicidad in vivo. En estos estudios, hemos demostrado que la administración de THC in vivo (10 mg / kg de peso corporal) redujo la celularidad en el bazo y el timo, que afecta a varias poblaciones de células, tales como células T, células B y macrófagos. La evidencia concluyente para la apoptosis no sólo vino de la observación de que las células in vivo en expuestos fueron sometidos a la apoptosis espontánea mejorada in vitro, sino también que la exposición de los ratones a un inhibidor de la caspasa cacerola antes de la administración de THC bloqueado efectos apoptóticos de THC in vivo. Además, extensos estudios in vitro demostraron que ingenuo esplenocitos o estimuladas por mitógenos, la apoptosis se sometieron cuando se cultivan con el THC, medido por el ensayo de TUNEL y tinción AnnexinV / PI. A una concentración más baja (10 mM) de THC sólo indujo AnnexinV + células, que es indicativo de células apoptóticas tempranas. En concentraciones más altas de THC (es decir, 20 mM), los esplenocitos fueron tanto AnnexinV y PI positivo, que representan las células necróticas finales de apoptosis, así como. Un hallazgo interesante fue que en los cultivos que habían sido tratados con THC solo, y en ausencia de mitógeno, los niveles de apoptosis fueron mayores en comparación con los observados en cultivos que contenía tanto THC y mitógeno. Estos resultados sugieren que el THC puede afectar a los linfocitos a un grado mayor que los linfocitos activados. 2015 Este documento es solo para fines educativos y uso no comercial. Más información en www.medicalcannabiscostarica.org Además, se observó que los linfocitos activados regulan expresión de CB2, explicando de ese modo disminución de la sensibilidad de los linfocitos activados a THC. El uso de los antagonistas de CB2 bloqueó la apoptosis inducida por el THC-en estas células, mientras que los antagonistas CB1 no mostraron un efecto significativo. Estos datos indican que la apoptosis inducida por el THC-en esplenocitos de una manera dependiente del receptor CB2. Se observaron resultados similares cuando los experimentos se repitieron contimocitos. El hecho de que la activación de CB2 desencadena la apoptosis en las células inmunes sugiere que la orientación CB2 puede constituir un enfoque novedoso para el tratamiento de enfermedades inflamatorias y autoinmunes. Dicho tratamiento no podría ejercer efectos psicotrópicos y puede atacar selectivamente a las células inmunes. Para este fin, de nuestro laboratorio probado los efectos de un agonista de CB2 sintética, JWH-015, en células T y B. Se observó que el JWH-015 en una forma dependiente de la dosis no sólo inhibió la proliferación, sino también indujo apoptosis en ingenuas y activada por esplenocitos y timocitos-. En este estudio, los resultados confirmaron que tanto la vía del receptor de la muerte y la vía intrínseca estaban involucrados, porque la caspasa 8 y caspasa 9 tratamientos inhibidores fueron capaces de bloquear la apoptosis inducida por JWH-015. La administración in vivo de JWH-015 (150 mg / kg de peso corporal) inhibe la proliferación de esplenocitos ex vivo, cuando son estimuladas con ConA. Además, JWH-015 disminuyó la respuesta específica de antígeno en ratones que fueron expuestos a la entero toxina estafilocócica A, determinado por disminución de la proliferación de-SEA sensible Vβ3 células + y T Vβ11 +. Ácido ajulémico (Aja) es un metabolito del THC, y es un potente analgésico y agente antiinflamatorio. Aja pertenece a una clase de los cannabinoides llamados tetrahidrocannabinoles carboxi. En los ensayos controlados de pacientes con dolor neuropático, Aja resultó tan eficaz como la morfina y en ratas, redujo significativamente la severidad de la artritis inducida por adyuvante. Un estudio investigó los efectos de Aja en linfocitos T de sangre periférica humana. Este estudio mostró que Aja reduce la proliferación de células T por ~ 75%, y la apoptosis inducida de una manera dependiente de la dosis (en 1, 3 y 10 mM). La incubación de las células con Aja (10 mM) durante 6 h aumentó la caspasa 3 actividad 9 veces, y la fragmentación del ADN 2.471.3 veces. Había una gran variedad en los efectos observados de Aja en las células T de donantes, y esto sugiere que las células de cada donante tenían diferentes niveles de sensibilidad a la apoptosis inducida por Aja. El sistema endocannabinoide también juega un papel durante los procesos de enfermedad. En la sangre de los pacientes con shock séptico, aumento de 4 veces en la AEA y 2-AG se ha detectado, y esto también se observó en la hipotensión inducida por LPS. El uso de antagonistas de CB1 en el modelo hipotensión, aliviar los efectos de cannabinoides, que muestra que estos compuestos contribuyeron con el grado de inflamación. Por otra parte, los compuestos WIN había funciones de protección en el shock séptico, ya que disminuyeron la infiltración de linfocitos y la producción de citoquinas inhibido. Una vez más, este ejemplo demuestra el papel bifásico de los cannabinoides en general. 2015 Este documento es solo para fines educativos y uso no comercial. Más información en www.medicalcannabiscostarica.org SENSIBILIDAD DE LAS CÉLULAS B A LA APOPTOSIS INDUCIDA CANNABINOIDE-­‐ Las células B son las células productoras de anticuerpos del sistema inmunológico, y que expresan la más alta cantidad de CB2 en su superficie celular. Varios informes han demostrado que los cannabinoides tienen diferentes efectos sobre las células B tales como la disminución de la proliferación celular y la producción de anticuerpos reducida. También se han realizado estudios sobre las poblaciones de fumadores de marihuana, y los resultados de estos estudios varían de manera significativa, debido a muchos factores, como la edad y los antecedentes genéticos de los usuarios, la cantidad de marihuana que se consume, y la duración de su uso eran todas diferentes. Algunos informes de estudios en humanos mostraron el número de células B reducidas junto con la disminución de IgG e IgM, mientras que otros no mostraron ningún cambio en el número de células B y el aumento de los niveles de IgE. La actividad de los cannabinoides no se limita a la inmunosupresión, y las concentraciones nanomolares de sintético (CP55, 940 y WIN55212-2) y (THC) cannabinoides naturales aumentar la proliferación en las células B tonsilares humanos co-estimuladas con anticuerpos anti CD40 los anticuerpos anti-Ig o. Argumentaron que este efecto de los cannabinoides es mediada a través del receptor CB2 desde el bloqueo de los receptores CB1 con SR141716A no inhibió la proliferación. Los investigadores mencionaron que también probaron los cannabinoides en el rango de 1-100μM, y estas altas concentraciones indicadas inhibían la proliferación. Un mecanismo independiente del receptor de la muerte celular inducida por el cannabinoide-se ha demostrado en las células linfoblastoides B humanas cultivadas. Los investigadores demostraron que el THC, cannabinol, y cannabidiol protegidos células linfoblastoides B humanas (5/2) de la muerte de células privadas de suero a concentraciones submicromolares. Además, que ilustran que la acción de los cannabinoides no se correlacionó con su afinidad de unión a los receptores CB1 y CB2 y no había estereoselectividad, lo que sugiere una acción independiente del receptor de cannabinoides. También llevaron a cabo experimentos con α-tocoferol, el isómero más potente de la vitamina E antioxidante y con anhydroretinol retinoide, que induce la muerte celular oxidativa, ya sea en la presencia o ausencia de THC. Sus resultados demostraron que al igual que el efecto de αtocoferol, y a diferencia de anhydroretinol retinoide, el THC era capaz de proteger 5/2 las células del estrés oxidativo y la muerte celular. APOPTOSIS INDUCIDA POR CANNABINOIDES EN LAS CÉLULAS PRESENTADORAS DE ANTÍGENO Las células dendríticas (DC) son las células presentadoras de antígenos más potentes y especializadas del sistema inmune, y los cannabinoides han demostrado inducir la apoptosis en estas células a través de receptores CB1 y CB2. THC (5 M o mayor) y la AEA (20 M) indujo apoptosis 2015 Este documento es solo para fines educativos y uso no comercial. Más información en www.medicalcannabiscostarica.org en células dendríticas óseas derivadas de la médula de C57BL / 6 ratones que fueron cultivadas en medio libre de suero, a través del compromiso de ambos receptores. Se demostró que el tratamiento de THC dio lugar a muchos cambios moleculares tales como la activación de las caspasas 2, 8, y 9, la escisión de Oferta (una proteína Bcl2-familia), la liberación del citocromo c, una disminución en el potencial de membrana mitocondrial, y un aumento en la fosforilación de Iκβα. Este estudio también demostró los efectos in vivo de la administración de THC, y mostró que hubo una disminución en el número de esplénicos países en desarrollo, y en la expresión de MHCII en países en desarrollo. Los efectos inmunosupresores de THC en Legionella pneumophila (Lp) infectaron células dendríticas, y se centró en la supresión inmune Th1. Sus resultados mostraron que la Lp carga in vitro en las células dendríticas, y posterior administración a ratones dieron lugar a la inmunización. Sin embargo, cuando las células dendríticas se trataron previamente con el THC, se suprime el potencial de inmunización de células cargadas-Lp. Tratamiento de THC suprime la IL-12p40 producción por las células dendríticas, así como inhibe la expresión de marcadores de maduración tales como MHCII, CD86, y CD40. Los investigadores se preguntaron si esta disminución de citoquinas era debido al aumento en la apoptosis de las células dendríticas por tratamiento de THC, y demostraron que 10 mM de THC no indujo la muerte celular en los países en desarrollo después de 24 h. Sus resultados contradicen; Sin embargo, esto se puede atribuir a las diferencias en el diseño experimental. Por ejemplo, et al. utilizado condiciones libres de suero con el fin de minimizar los efectos inhibitorios de suero sobre la acción de cannabinoides, mientras que Lu et al. El suero utilizado en sus condiciones de cultivo. Además, Do et al. utilizado países en desarrollo de la médula ósea de ratones C57BL / 6 ratones, mientras que Lu et al. utilizados países en desarrollo de la médula ósea de ratones Balb / c. El efecto de Aja en las células precursoras de la osteoclastogénesis, que son los monocitos y macrófagos, y en sí mismos los osteoclastos. Se utilizan células de médula ósea incubadas con factor estimulante de macrófagos (M-CSF), y una línea celular de macrófagos de ratón como células precursoras, y se añaden RANKL a las células precursoras con el fin de obtener células de osteoclastos in vitro puros. En este estudio, demuestran que Aja indujo la apoptosis tanto en los monocitos precursores y macrófagos, así como en los osteoclastos a concentraciones entre 15 y 30 mM. EFECTO DE LOS CANNABINOIDES EN LAS CÉLULAS INMUNES MALIGNAS Estudios de nuestro laboratorio sugirieron por primera vez que la orientación de los receptores CB2 en cánceres de origen inmunitario puede constituir un enfoque novedoso para el tratamiento de tales tumores malignos. En primer lugar, investigó la capacidad de los cannabinoides para inducir la apoptosis en las células malignas de origen inmunológico incluyendo linfomas y leucemias. Se demostró que la leucemia y líneas celulares de linfoma humanos tales como las células Jurkat y Molt-4 expresan receptores CB2, pero expresan poco o nada de niveles significativos de CB1. Se 2015 Este documento es solo para fines educativos y uso no comercial. Más información en www.medicalcannabiscostarica.org encontró que estas células a ser susceptibles a la inducida por el THC, HU-210, la anandamida, y JWH-015 la apoptosis. En el mismo estudio, se observó que la apoptosis también fue inducida por el THC y la anandamida en células tumorales murinas, tales como EL-4 y LSA. La administración in vivo de 3 y 5 mg / kg de peso corporal de THC también fue eficaz en matar EL-4 del tumor células que se inyectaron en la cavidad peritoneal, y tras el tratamiento de THC, 25% de los ratones sobrevivieron a la exposición del tumor. Células humanas de leucemia linfoblástica primarios también se ensayaron para determinar su susceptibilidad a la apoptosis inducida por el THC-, y las células tomadas a partir de dos donantes diferentes mostraron aumento de la apoptosis en los tratamientos de THC en 5 M o mayores concentraciones. Otra observación por este estudio fue que el suero interfiere con los efectos del THC; por lo tanto, en medio que contiene suero se necesitaban 10 M o mayores concentraciones para inducir la apoptosis; Sin embargo, en condiciones libres de suero 3 M o más altas concentraciones eran suficientes para inducir un aumento significativo en la apoptosis. Está bien establecido que el THC induce la apoptosis en líneas celulares de leucemia Jurkat, y esto se produce a través de tres mecanismos diferentes. El primer mecanismo, donde los investigadores examinaron el efecto del THC en el tipo salvaje, así como en FADD deficiente, la caspasa 8 deficiente, y la caspasa 9 células Jurkat deficientes. Su estudio demostró que la apoptosis inducida por el THCen las células Jurkat se produjo principalmente a través de la vía intrínseca incluyendo caspasa 9 de activación, y la liberación de citocromo cen el citosol. Sin embargo, el grado de apoptosis en células deficientes deficientes 8 y la caspasa FADD mostraron una disminución parcial, cuando se mide por TUNEL. Tratamiento de THC de las células dio lugar a la activación de las caspasas 2, 8, 9, y 10 en ese orden, y la escisión de la oferta se produjo 2 h después del tratamiento. En general, estos estudios demostraron que la apoptosis inducida por el THC-se produjo a través de la diafonía entre las vías extrínsecas e intrínsecas, con la vía intrínseca en el papel principal. El segundo mecanismo propuesto surgió de un grupo de investigación en España, y en este estudio en particular, los investigadores investigaron si la acumulación de ceramida está implicado en la apoptosis inducida por el THC en células Jurkat. Ellos demostraron que al 2 mM tratamiento con THC, los niveles de ceramida se incrementaron dentro de la célula.Ellos inhiben la síntesis de ceramida con un inhibidor farmacológico o transfectaron las células con una forma dominante negativa de la enzima que cataliza la producción de ceramida, y demostraron que esto condujo a la disminución de los niveles de apoptosis en la presencia de THC. La apoptosis fue mediada a través de la pérdida del potencial de membrana mitocondrial, la liberación del citocromo c, y la activación de las caspasas. Cuando se usó un inhibidor de pan caspasa, se impidió la apoptosis pero todavía era la pérdida del potencial de membrana de las mitocondrias. Por lo tanto, este estudio demostró que el primer paso en la vía apoptótica fue la producción de ceramida, y que esto llevó a la pérdida de potencial de membrana, y la activación de caspasas, respectivamente. 2015 Este documento es solo para fines educativos y uso no comercial. Más información en www.medicalcannabiscostarica.org Nuestros estudios han demostrado, además, que el THC interfiere con la vía de señalización de la MAP quinasa, que desempeña un papel crítico en la apoptosis de células Jurkat.Específicamente, el THC inhibe la vía MAPK / MEK / ERK señalización, lo que resultó en la translocación de Bad en las mitocondrias, y, finalmente, la apoptosis. También se demostró que la apoptosis inducida por el THC en células T Jurkat en una forma dependiente de la dosis, y el uso de CB1 y CB2 (SR141716 antagonistas y SR144528, respectivamente) disminuyó significativamente la cantidad de THC inducida por la apoptosis. Se demostró que el tratamiento de THC dio lugar a la fosforilación reducida de Raf-1, MEK1 / 2, y ERK1 / 2, sin ningún cambio en las proteínas totales, y que este proceso era independiente de caspasas. Por otra parte, la interrupción de la vía de señalización Raf1/MEK/ERK/RSK, y no a la vía PI3K/Akt, jugó un papel en la desfosforilación y translocación de una proteína de la familia Bcl-2, Bad, en la mitocondria. En este trabajo se arrojará más luz sobre el mecanismo de la apoptosis inducida por el THC en líneas de células T leucémicas, y demostró que la ligadura de los receptores CB1 y CB2 por THC dio lugar a: (1) la interrupción de una vía principal de la supervivencia celular, (2) la translocación de Bad en la mitocondria, y (3) la apoptosis. EFECTO DE LOS CANNABINOIDES SOBRE LAS CÉLULAS NO INMUNES Los cannabinoides afectan el destino celular en muchos otros tipos de células, tales como células transformadas neurales, células de cáncer de mama, hepatocitos, y células de cáncer de próstata. Como se discutió previamente, la presencia de los receptores de cannabinoides en la superficie celular es un determinante clave de cómo los cannabinoides afectan a una población celular determinada. Un estudio exploró los efectos del THC en líneas celulares de cáncer de mama murinos y humanos, así como en un modelo in vivo de cáncer de mama en ratones. Los investigadores demostraron que el ratón 4T1 carcinoma de mama, y líneas celulares de cáncer de mama humano MCF-7 y MDA-MB-231 expresaron niveles bajos a indetectables de CB1 y CB2; por lo tanto, fueron resistentes a la muerte celular inducida por el THC-. Además, este estudio demostró que el THC creado un anfitrión-inmune comprometido, y ayudó en 4T1 el crecimiento del tumor y la metástasis en ratones C57BL / 6 ratones. La inmunosupresión fue mediada a través del receptor CB2, y un interruptor de citoquinas Th1 de citocinas de Th2 tales como IL-4 e IL-10 se produjo tras el tratamiento de THC. Los efectos apoptóticos de THC sobre las células de hepatocitos de ratón normales, BNL.CL.2, y demostraron que estas células son resistentes a la apoptosis inducida por el THC-así.En este estudio, los esplenocitos fueron utilizados como control positivo, y los investigadores mostraron que las dosis que inducen la muerte celular en esplenocitos fueron incapaces de causar cualquier cambio en la viabilidad celular en hepatocitos. Además, los investigadores recogieron los sobrenadantes de cultivos de esplenocitos activados con ConA (CS) y se ensayaron la capacidad de THC para proteger a los hepatocitos de la muerte celular inducida por CS. Ellos demostraron que el THC disminuyó el porcentaje de células apoptóticas en una manera dependiente de la dosis. Estos resultados están de acuerdo con un estudio que investigó el efecto de un agonista de CB2 de 2015 Este documento es solo para fines educativos y uso no comercial. Más información en www.medicalcannabiscostarica.org selección, HU-308, en el modelo de lesión por isquemia / reperfusión en ratones C57BL / 6, donde establecieron que HU-308 suprimido la apoptosis en hepatocitos mide por la actividad de la caspasa 3 y ensayo de fragmentación de ADN. Un estudio dirigido a los receptores cannabinoides para el tratamiento de melanoma en un modelo de ratón. Ellos mostraron que las células de melanoma expresan receptores CB1 y CB2, y que la activación del receptor por el THC y WIN-55 ,212-2 condujo a la inhibición del crecimiento celular de melanoma tanto in vitro como in vivo. Además, demostraron que el THC y WIN-55 ,212-2 causó la detención del ciclo celular en células de melanoma a través de la inhibición de Akt y hipofosforilación de la proteína supresora de tumores, el retinoblastoma (Rb). CONCLUSIÓN Los cannabinoides se han aprobado en algunos países para el tratamiento de la quimioterapia inducida por náuseas y vómitos, y los ensayos clínicos demuestran la eficacia de los cannabinoides ‘en la inhibición del dolor y la estimulación del apetito. Potencial terapéutico antiinflamatorio de los cannabinoides es también evidente a partir de los estudios discutidos en este artículo de revisión. A las concentraciones óptimas, los cannabinoides no inducen la apoptosis en células inmunes, el alivio de las respuestas inflamatorias y proteger al huésped de la inflamación aguda y crónica. El efecto acumulativo de los cannabinoides en todas las poblaciones de células del sistema inmune puede ser beneficioso, cuando hay una necesidad de supresión inmune. Por ejemplo, en pacientes con enfermedades autoinmunes tales como la esclerosis múltiple, la artritis y el lupus, o en aquellos con choque séptico, donde la enfermedad es causada por las células inmunes activadas, apuntando a las células inmunes a través de los agonistas de CB2 pueden desencadenar la apoptosis y actuar como anti-inflamatoria la terapia. CB2 seleccionar agonistas no son psicoactivo y porque CB2 se expresa principalmente en células inmunes, el uso de agonistas de CB2 podría proporcionar una nueva modalidad terapéutica contra las enfermedades autoinmunes e inflamatorias. Claramente, se necesita más investigación para validar estos estudios en humanos mediante ensayos clínicos. Sin embargo, en otros casos, como en los pacientes con cáncer de mama en el que los receptores cannabinoides no pueden ser expresados por las células cancerosas, los cannabinoides pueden empeorar la enfermedad, debido a que el sistema inmunológico se debilita, y las células de cáncer de mama son resistentes a la inducida por cannabinoides la apoptosis. Por lo tanto, es crítico para equilibrar los efectos inmunosupresores con las propiedades contra el cáncer, que requieren estudios de dosis-respuesta cuidado en estos resultados clínicos. En general, existe un papel bifásica para los cannabinoides, y depende de tres factores principales: (1) el tipo de cannabinoide, (2) la dosis de cannabinoides, y (3) el tipo de célula que el cannabinoide actúa en. El grado de expresión del receptor de cannabinoides puede jugar un papel en algunos casos; Sin embargo, el mecanismo independiente del receptor de acción es evidente para los cannabinoides en algunas poblaciones de células. Además de la utilización de los cannabinoides exógenos, en la 2015 Este documento es solo para fines educativos y uso no comercial. Más información en www.medicalcannabiscostarica.org manipulación in vivo de los endocannabinoides también pueden ofrecer nuevas oportunidades de tratamiento contra el cáncer y enfermedades autoinmunes. REFERENCIAS 1. Blazquez C, Carracedo A, Barrado L, Bienes PJ, Fernández-Luna JL, Velasco G, et al. Los receptores cannabinoides como nuevas dianas para el tratamiento del melanomaFaseb J.2006; 20 (14): 2633-2635.. 2. Di Filippo C, F Rossi, Rossi S, la activación del receptor D’Amico M. cannabinoides CB2 reduce ratón infarto de la lesión por isquemia-reperfusión: la participación de citocinas / quimiocinas y PMN J Leukoc Biol.2004; 75 (3): 453-459.. 3. Cabral GA, Mishkin EM. El delta-9-tetrahidrocannabinol inhibe la expresión de proteínas de los macrófagos en respuesta a los inmunomoduladores bacterianas J Toxicol Environ Health.1989; 26 (2): 175 – 182.. 4. Camacho IA, Hassuneh MR, Nagarkatti M, Nagarkatti PS. Mejora de la muerte celular inducida por activación como un mecanismo de 2, 3,7,8-tetraclorodibenzo-p- dioxinainmunotoxicidad (TCDD) inducida en las células T periféricas Toxicología 2001; 165 (1): 51-63… 5. Chen Y, Buck J. cannabinoides a proteger las células de la muerte celular oxidativo: un mechanism.J Pharmacol Exp Ther independiente del receptor 2000; 293 (3):. 807-812. 6. Condie R, Arenque A, Koh WS, Lee M, Kaminski NE. La inhibición de cannabinoides de la adenilato ciclasa de la transducción de señales mediada y 2 (IL-2) expresión en la línea murina de células T, el4.Il-2 J Biol Chem.1996 interleucina; 271 (22): 13.175 a 13.183.. 7. Croxford JL, Yamamura T. Los cannabinoides y el sistema inmune: potencial para el tratamiento de enfermedades inflamatorias J Neuroimmunol 2005; 166 (1 – 2):?. 3 – 18 de. 8. Derocq JM, Segui M, Marchand J, Le Fur G, Casellas P. Los cannabinoides aumentan el crecimiento de células B humanas a bajas concentraciones nanomolares FEBS Lett1995; 369 (2 – 3): 177-182… 9. Haz Y, McKallip RJ, Nagarkatti M, Nagarkatti PS. La activación a través de receptores de cannabinoides 1 y 2 sobre las células dendríticas activa NF-kappaB-dependiente de la apoptosis: nuevo papel para los cannabinoides endógenos y exógenos en la inmunorregulación J Immunol 2004; 173 (4): 2373-2382… 10. El-Gohary M, Eid MA. Efecto de la ingesta de cannabinoides (en forma de bhang) sobre el sistema inmune de los estudiantes de secundaria y universitarios Hum ExpToxicol.2004; 23 (3): 149-156.. 11. George KL, Saltman LH, Stein GS, Lian JB, Zurier RB. Ácido ajulémico, un ácido cannabinoide no psicoactivos, suprime la osteoclastogénesis en células precursoras mononucleares e induce la apoptosis en la célula madura Physiol cells.J-osteoclastos como 2008; 214 (3): 714720.. 2015 Este documento es solo para fines educativos y uso no comercial. Más información en www.medicalcannabiscostarica.org 12. Guzmán M. Cannabinoides: potencial anticancerígeno agents.Nat cáncer Rev 2003; 3 (10) 745 – 755.. 13. Guzmán M, Sánchez C, Galve-Roperh I. Los cannabinoides y el destino celular Pharmacol Ther 2002; 95 (2): 175 – 184… 14. Hampson AJ, Grimaldi M, Axelrod J, Wink D. cannabidiol y (-) Delta9-tetrahidrocannabinol son antioxidantes neuroprotectores Proc Natl Acad Sci USA.1998; 95 (14): 8268 a 8273.. 15. Hegde VL, S Hegde, Cravatt BF, Hofseth LJ, Nagarkatti M, Nagarkatti PS. La atenuación de la hepatitis autoinmune experimental por los cannabinoides exógenos y endógenos: la participación de las células T reguladoras Mol Pharmacol 2008; 74 (1): 20 – 33… 16. Hengartner MO. La bioquímica de la apoptosis Nature.2000; 407 (6805): 770-776.. 17. Herrera B, Carracedo A, Diez-Zaera M, Gómez del Pulgar T, Guzmán M, Velasco G. La apoptosis señales del receptor cannabinoide CB2 través de la activación de la ceramidadependiente de la vía intrínseca mitocondrial Exp. Cell Res.2006; 312 (11).: 2121-2131. 18. Igney FH, Krammer PH. La muerte y la lucha contra la muerte: la resistencia del tumor a la apoptosis de Nat Rev Cancer 2002; 2 (4):.. 277-288. 19. Síndrome de anorexia-caquexia Inui A. Cáncer: temas de actualidad en la investigación y la gestión de CA Cáncer J Clin.2002; 52 (2): 72-91.. 20. Jia W, Hegde VL, Singh NP, Sisco D, Grant S, Nagarkatti M, et al. La apoptosis inducida por Delta9-tetrahidrocannabinol en células de leucemia Jurkat T se regula por la translocación de Bad a mitocondrias Mol Cancer Res. 2006; 4 (8):.. 549-562. 21. Kamath AB, Nagarkatti PS, Nagarkatti M. La evidencia de la inducción de la apoptosis en timocitos por 2, 3,7,8-tetraclorodibenzo-p-dioxina in vivo (1997) Toxicol Appl Pharmacol 1997; 142 (2):. 367-377 . 22. Karst M, Salim K, S Burstein, Conrado I, Hoy L, Schneider U. Analgésico efecto del cannabinoide sintético ct-3 sobre el dolor neuropático crónico:. Un ensayo controlado aleatorio trial.J Am Med Assoc 2003; 290 (13): 1757 – 1762. 23. Klein TW, Newton CA, receptores de cannabinoides H. Friedman y la inmunidad Immunol Today.1998; 19 (8): 373-381.. 24. Klein TW, Línea B, Newton CA, Friedman H. El sistema cannabinoide y red de citoquinas Proc Soc. Exp. Biol. Med. 2000; 225 (1): 1 – 8… 25. Klein TW, Cabral GA. La supresión y la modulación de las células presentadoras de antígeno inmune inducida cannabinoides-J Neuroimmune Pharmacol 2006; 1 (1): 50 – 64años… 26. Klein TW, Newton C, Zhu W, Daaka Y, Friedman H. Delta 9-tetrahidrocannabinol, citoquinas, y la inmunidad a Legionella pneumophila Proc Soc Exp Biol Med.1995; 209 (3): 205-212.. 27. Kroemer G, Reed JC. De control mitocondrial de la célula death.Nat Med. 2000 ; 6 (5) 513 – 519. 2015 Este documento es solo para fines educativos y uso no comercial. Más información en www.medicalcannabiscostarica.org 28. Lee CY, Wey SP, Liao MH, Hsu WL, Wu HY, Jan TR. Un estudio comparativo sobre la apoptosis inducida por el cannabidiol-en timocitos murinos y el-4 células de timoma.Int. Immunopharmacol. 2008; 8 (5): 732-740. 29. Lee SF, Newton C, Widen R, H Friedman, Klein TW. Expresión diferencial de cannabinoide CB (2) mRNA del receptor de ratón subpoblaciones de células inmunes y después de la estimulación de células b. Eur J Pharmacol.2001; 423 (2 – 3): 235-241. 30. Lombard C, Nagarkatti M, Nagarkatti P. Cb2 agonista de los receptores de cannabinoides, JWH-015, desencadena la apoptosis en las células del sistema inmune: papel potencial de ligandos selectivos de CB2 como agentes inmunosupresores. Immunol.2007 Clin; 122 (3): 259-270. 31. Lombard C, Nagarkatti M, Nagarkatti PS. Orientación receptores cannabinoides para el tratamiento de la leucemia:. Papel de la diafonía entre las vías extrínsecas e intrínsecas en delta9-tetrahidrocannabinol (THC) de la apoptosis de las células Jurkat inducida Leuk Res. 2005; 29 (8): 915-922. 32. Supresión López-Cepero M, Friedman M, Klein T, H. Friedman Tetrahidrocannabinol inducida por los macrófagos de la difusión y la actividad fagocítica in vitro . J Biol Leukoc. 1986; 39 (6): 679-686. 33. Lu T, Newton C, Perkins I, H Friedman, Klein TW. Tratamiento Cannabinoid suprime la función de la célula polarizante t-helper de células dendríticas de ratones estimuladoscon Legionella pneumophila infección. J Pharmacol Exp Ther. 2006; 319 (1): 269276. 34. Maccarrone M, Lorenzon T, M Bari, Melino G, Finazzi-Agro A. La anandamida induce la apoptosis en las células humanas a través de receptores vaniloides. La evidencia de un papel protector de los receptores cannabinoides. J Biol Chem.2000; 275 (41): 31938-31945. 35. Mackie K. receptores cannabinoides como terapéutica targets.Annu Rev Pharmacol Toxicology. 2006; 46:101 -122. 36. McCoy KL, Gainey D, Cabral GA. Delta 9-tetrahidrocannabinol modula el procesamiento del antígeno por los macrófagos. J Pharmacol Exp Ther. 1995; 273 (3): 1216-23. 37. McKallip RJ, Jia W, Schlomer J, Warren JW, Nagarkatti PS, Nagarkatti M. apoptosis inducida por el cannabidiol en células de leucemia humana: Un nuevo papel del cannabidiol en la regulación de p22phox y expresión NOX4. . Mol Pharmacol 2006; 70 (3): 897-908. 38. McKallip RJ, Lombard C, Fisher M, Martin BR, Ryu S, Grant S, et al. Orientación receptores cannabinoides CB2 como una nueva terapia para tratar disease.Blood linfoblástica maligno. 2002a; 100 (2): 627-634. 39. McKallip RJ, Lombard C, Martin BR, Nagarkatti M, Nagarkatti PS. Delta ( 9)- tetrahidrocannabinol inducida por la apoptosis en el timo y el bazo como un mecanismo de inmunosupresión in vitro y in vivo . J Pharmacol Exp Ther. 2002b; 302 (2): 451-465. 2015 Este documento es solo para fines educativos y uso no comercial. Más información en www.medicalcannabiscostarica.org 40. McKallip RJ, Nagarkatti M, Nagarkatti PS. Delta-9-tetrahidrocannabinol mejora el crecimiento y la metástasis del cáncer de mama por la supresión de la respuesta inmune antitumoral. J. Immunol. 2005; 174 (6): 3281 a 3289. 41. Pollmann W, Fenenberg W. gestión actual asociada con la esclerosis múltiple. CNS Drugs.2008; 22 (4): 291-324. 42. Rachelefsky GS, Opelz G, Mickey MR, Lessin P, Kiuchi M, Silverstein MJ, et al. Humoral intacta y la inmunidad mediada por células en el consumo de marihuana crónica. J Allergy Clin Immunol. 1976; 58 (4): 483-490. 43. Rajesh M, Pan H, Mukhopadhyay P, B á tkai S, Osei-Hyiaman D, Hask ø G, Liaudet L, Gao B, Pacher P. J Biol Leukoc. 2007; 82 (6): 1382-1389. 44. Schwarz H, Blanco FJ, Lotz M. Anadamide, un agonista del receptor cannabinoide endógeno inhibe la proliferación e induce la apoptosis de linfocitos. . J Neuroimmunol1994; 55 (1): 107115. 45. Singh NP, Nagarkatti M, células Nagarkatti P. primarias T periféricas se vuelven susceptibles a 2 , 3,7,8-tetraclorodibenzo- p -dioxina la apoptosis mediada in vitro tras la activación y en la presencia de células dendríticas. Mol Pharmacol. 2008; 73 (6): 1722-1735. 46. Tashkin DP, Baldwin GC, Sarafian T, Dubinett S, Roth MD. Consecuencias respiratorias e inmunológicas de fumar marihuana. J Clin Pharmacol. 2002; 42 (11): 71S – 81S. 47. Tramer MR, Carroll D, Campbell FA, Reynolds DJ, Moore RA, McQuay HJ. Los cannabinoides para el control de la quimioterapia inducida por náuseas y vómitos: revisión sistemática cuantitativa. Br Med J.2001; 323 (7303): 16 – 21. 48. Varga K, Wagner JA, Bridgen DT, Kunos G. plaquetas y los cannabinoides endógenos derivados de macrófagos están implicados en la hipotensión inducida por endotoxina.Faseb J.1998 ; 12 (11): 1035-1044. 49. Wang Y, Liu Y, Ito Y, Hashiguchi T, Kitajima I, Yamakuchi M, et al. Medición simultánea de la anandamida y 2-araquidonoilglicerol por polimixina b-selectiva adsorción y análisis por cromatografía líquida de alto rendimiento subsiguiente: Aumento de los cannabinoides endógenos en el suero de pacientes con endotóxico shock.Anal Biochem.2001; 294 (1): 73-82. 50. Yebra M, Klein TW, Friedman H. Delta 9-tetrahidrocannabinol suprime concanavalina A inducida por aumento del calcio libre citoplasmático en timocitos de ratón. Vida Sci.1992; 51 (2): 151 – 160. 51. Zhu W, H Friedman, Klein TW. Delta9-tetrahidrocannabinol induce la apoptosis en los macrófagos y linfocitos: participación de Bcl-2 y la caspasa-1. . J Pharmacol Exp Ther1998; 286 (2): 1103-1109. 52. Zhu W, Igarashi T, H Friedman, Klein TW. Delta 9-tetrahidrocannabinol (THC) hace que la variable de la expresión de subunidades del receptor de IL2. . J Pharmacol Exp Ther 1995; 274 (2): 1001-1007. 2015 Este documento es solo para fines educativos y uso no comercial. Más información en www.medicalcannabiscostarica.org 53. Zhu W, Newton C, Daaka Y, Friedman H, Klein TW. Delta 9-tetrahidrocannabinol mejora la secreción de interleucina 1 a partir de macrófagos estimulados con endotoxina. . J Pharmacol Exp Ther 1994; 270 (3): 1334-39. 1. Zurier RB, Rossetti RG, Lane JH, Goldberg JM, Hunter SA, Burstein SH. Dimetilheptilo-THC-11 oico: un agente antiinflamatorio no psicoactivos con una estructura de plantilla de cannabinoide. Artritis Rheum.1998; 41 (1): 163-170. INFORMACIÓN MCCRID: ARKMCCR-00133 PUBMED ID: 19457575 PMCID: PMC3005548 Nombre Original: Cannabinoid-induced apoptosis in immune cells as a pathway to immunosuppression. 2015 Este documento es solo para fines educativos y uso no comercial. Más información en www.medicalcannabiscostarica.org