Inhibidores del factor de necrosis tumoral alfa en la enfermedad
Anuncio

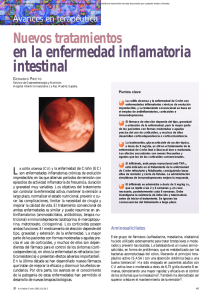
Documento descargado de http://www.elsevier.es el 20/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. REVISIÓN Inhibidores del factor de necrosis tumoral alfa en la enfermedad inflamatoria intestinal 74.659 Francesc Casellas i Jordà Servei de Digestiu. Hospital Universitari Vall d’Hebron. Barcelona. España. La enfermedad inflamatoria intestinal (EII) es un proceso inmunoinflamatorio crónico en respuesta a un estímulo aún no bien establecido que desencadena una cascada de activación de mediadores celulares, con la consiguiente aparición de lesión tisular. Uno de los mediadores proinflamatorios más importantes reconocidos en el desarrollo de la enfermedad es el factor de necrosis tumoral ␣ (TNF-␣). A medida que se ha ido conociendo la fisiopatología de la EII se ha avanzado en su terapéutica, hasta alcanzar en la actualidad su máximo exponente en el denominado tratamiento biológico. Un ejemplo de esta terapéutica es el uso de sustancias que antagonizan el TNF␣, como los anticuerpos monoclonales infliximab, adalimumab, natalizumab, etanercept u onercept, de los que el infliximab es el único aprobado para su uso en la EII. Diversos estudios han demostrado que la inhibición de TNF-␣ es eficaz en el tratamiento de la enfermedad de Crohn. El infliximab induce la remisión de los brotes de la enfermedad refractarios al tratamiento convencional y previene la recidiva a largo plazo. Ciertas complicaciones de la enfermedad de Crohn, como las fístulas enterocutáneas o perianales que no responden al tratamiento de primera línea, también responden al infliximab. Sin embargo, su eficacia en la colitis ulcerosa parece más limitada, por lo que aún no se recomienda su uso fuera de los ensayos clínicos. Por otro lado, el infliximab tiene también desventajas, como el desarrollo de anticuerpos antiinfliximab, que provocan una pérdida en la eficacia del tratamiento y la aparición de reacciones de hipersensibilidad. Otros efectos adversos frecuentes del infliximab son el desarrollo de fenómenos de autoinmunidad, como anticuerpos antinucleares o antiADN, y la reactivación de infecciones como la tuberculosis, lo que obliga a descartar lo más fidedignamente posible la tuberculosis antes de iniciar el tratamiento. Para reducir los efectos adversos por inmunogenicidad del infliximab se está ensayando con otros agentes humanizados o completamente humanos, como el adalimumab o el onercept, que aún están en fase de investigación. Mientras no se consiga identificar el estímulo que desencadena la EII, los tratamientos biológicos tienen un gran futuro, y de ellos el antagonismo selectivo del TNF-␣ es ya una realidad. Palabras clave: Factor de necrosis tumoral. Infliximab. Enfermedad de Crohn. Colitis ulcerosa. Tratamiento de la enfermedad inflamatoria intestinal. TNF inhibitors in inflamatory bowel disease Inflammatory bowel disease (IBD) is a chronic immunoinflammatory response to an stimulus that activates a chain of cellular mediators causing intestinal damage. One of the most well recognized proinflammatory mediators involved in the pathogenesis of IBD is tumor necrosis factor α (TNFα). The treatment of IBD has advanced in parallel to the improvement of the knowledge of its physiopathology, leading to the development of biological therapies. An example of this kind of treatment is the use of substances that antagonize TNFα, such as monoclonal antibodies infliximab, adalimumab, natalizumab, etanercept or onercept, with infliximab being the unique approved for use in IBD. Several studies have demonstrated that inhibition of TNFα is useful in the treatment of Crohn’s disease (CD). In CD, infliximab induces the remission of relapses which are refractory to the conventional treatment, Correspondencia: Dr. F. Casellas i Jordà. Servei de Digestiu. Hospital Universitari Vall d’Hebron. Pg. Vall d’Hebron, 119. 08035 Barcelona. España. Recibido el 28-4-2004; aceptado para su publicación el 3-6-2004. 45 prevents more relapses and induces a closure of enterocutaneous and perianal fistula that do not respond to first line treatment. However, infliximab is not useful in ulcerative colitis. Infliximab treatment has some drawbacks, such as the development of anti-infliximab antibodies, which cause a loss of efficacy of the treatment and hypersensitivity reactions. Other reported adverse effects of infliximab are the development of autoimmunity, such as that related with antinuclear or anti-DNA antibodies, or the reactivation of infections such as tuberculosis. In fact, a screening for tuberculosis is necessary before administration of infliximab. To reduce the adverse effects due to infliximab immunogenicity, several trials with humanized or completeley human agents, such as adalimumab or onercept, are under way. Until the precise stimulus that triggers IBD is identified, biological therapies have a great future and the selective antagonism of TNFα is already a reality. Key words: Tumor necrosis factor. Infliximab. Crohns’ disease. Ulcerative colitis. Treatment of inflammatory bowel disease. La enfermedad inflamatoria intestinal (EII) es una enfermedad inmunoinflamatoria crónica del intestino delgado y colon caracterizada por la aparición recidivante de síntomas digestivos y extradigestivos, evolucion heterogénea, complicaciones frecuentes, necesidad de tratamiento médico prolongado y, eventualmente, cirugía. A consecuencia de todo ello, la EII repercute desfavorablemente en la vida diaria familiar, laboral y social del individuo que la padece, afecta su percepción de salud y limita su calidad de vida1. Dada la importante repercusión de la enfermedad, es comprensible el notable esfuerzo de investigación que se está realizando para conseguir un tratamiento médico que controle la enfermedad de forma permanente. La EII se debe a una alteración del mecanismo inmunitario local intestinal relacionada con un infiltrado linfocitario constituido por células T y la hiperproducción de citocinas por las células T de la lámina propia. Un factor esencial en el desarrollo de la EII es la flora bacteriana intestinal2, pero se desconoce qué antígenos o bacterias son los responsables. Para que se desarrolle la EII, junto a las peculiaridades del contenido antigénico intraluminal intestinal, deben asociarse una susceptibilidad genética predisponente y una respuesta inmunitaria local característica que genere la lesión inflamatoria3. La susceptibilidad genética se relaciona con una asociación con la región de los genes de histocompatibilidad DR2, polimorfismos para ciertos mediadores de la inflamación como el antagonista del receptor de la interleucina 1 o el factor de necrosis tumoral alfa (TNF-α) y mutaciones del gen NOD2 en la región IBD1 del cromosoma 164. Las mutaciones del gen NOD2 aparecen al menos en un tercio de los pacientes con enfermedad de Crohn (EC)5 y se relacionan con la expresión anormal por parte de los monocitos y células epiteliales intestinales de una proteína del receptor citosólico ligado a los lipopolisacáridos de la memMed Clin (Barc) 2004;123(16):627-34 627 Documento descargado de http://www.elsevier.es el 20/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. CASELLAS I JORDÀ F. INHIBIDORES DEL FACTOR DE NECROSIS TUMORAL ALFA EN LA ENFERMEDAD INFLAMATORIA INTESTINAL TNF-α Receptor TNF-α FADD Caspasa 8 TRADD TRAF2 Apoptosis JNK NF-κβ Proteína AP1 Membrana celular Transcripción Anorexia Cerebro Resorción ósea Osteoclastos Endotelio Fiebre Catabolismo proteico Hipotálamo Músculo TNF-α Hígado Fibroblastos Reactantes de fase aguda Macrófagos/polimorfonucleares Moléculas de adhesión Permeabilidad Fibrogénesis de la matriz extracelular Reclutamiento Activación Apoptosis Infiltrado celular Remodelación tisular Inflamación, lesión tisular brana de bacterias entéricas, que da lugar a una función antibacteriana local alterada, disminución de la apoptosis y activación de la producción de TNF-α. Para el desarrollo de la EII, a los 2 factores citados debe sumarse una respuesta exagerada de las células T a las bacterias o antígenos entéricos6. El perfil de citocinas liberadas que van a provocar la lesión mucosa difiere entre la EC y la colitis ulcerosa (CU). Así, la EC se relaciona con una respuesta de los linfocitos T helper tipo 1, con mediación por el TNF-α, interferón gamma e interleucina 12, mientras que la CU tiene un patrón menos establecido, que parece relacionado con la mediación de las interleucinas 5 y 107. El tratamiento ideal de la EII sería el dirigido contra el factor etiológico responsable de la activación de la respuesta inmunoinflamatoria causante de la aparición y perpetuación del daño tisular. Sin embargo, debido a que se desconoce el desencadenante inicial de la enfermedad, el tratamiento se basa en la administración de fármacos inespecíficos que bloquean la respuesta inflamatoria intestinal. De acuerdo con la experiencia clínica, en general avalada por los resultados de la medicina basada en la evidencia, los fármacos que se utilizan en la inducción o el mantenimiento de la remisión de la enfermedad son inmunomoduladores del tipo de los glucocorticoides, derivados del ácido 5-aminosalicílico, azatioprina o metotrexato8-12. De todos modos, a pesar del variado arsenal terapéutico disponible, un número significativo de pacientes no responden al tratamiento, por lo que acaban en procedimientos de resección intestinal o del 628 Med Clin (Barc) 2004;123(16):627-34 Fig. 1. Esquema de la vía de la señal del factor de necrosis tumoral alfa (TNF-α) en la célula efectora. Una vez ligado el TNF-α al receptor de membrana, entra en la célula donde recluta proteínas citoplasmáticas al death domain (DD) a través del factor associated death domain (FADD) y del TNF associated death domain (TRADD). Por la vía del FADD se activa el sistema de las caspasas que conducirá a la apoptosis. Por su parte, por la vía del TRADD se activa el factor 2 asociado al TNF (TRAF2), que activa 2 importantes factores de transcripción: el factor nuclear κβ y la proteína activadora AP1 por la mediación de la cinasa c-jun-N-terminal (JNK). Fig. 2. Principales efectos del factor de necrosis tumoral alfa (TNF-α). La producción de TNF-α provoca la activación de diversos células y tejidos, con el consiguiente efecto proinflamatorio. colon. Por este motivo tiene gran interés la búsqueda de nuevos agentes terapéuticos. Debido al papel fundamental que desempeña el TNF-α en la patogenia de la EII, especialmente de la EC, un aspecto actual de gran interés es la obtención de agentes biológicos capaces de bloquearlo. Funciones del TNF-␣ y su relación con la enfermedad inflamatoria intestinal El TNF-α es un polipéptido sintetizado por monocitos, macrófagos y linfocitos T una vez que han sido estimulados por endotoxinas u otras citocinas como la interleucina 1 o el interferón. El TNF-α se sintetiza inicialmente como un precursor de 26 kD (pro-TNF-α) ligado a la membrana, de la que es liberado en su forma activa como TNF-α soluble gracias a la acción de la metaloproteinasa denominada enzima de conversión del TNF-α (TACE). El TNF-α se liga a 2 receptores específicos de la membrana celular (p55 y p75) y ejerce un potente efecto citotóxico y proinflamatorio (fig. 1). El efecto lesivo del TNF-α se relaciona con la activación de fosfolipasas, liberación de radicales libres de oxígeno, activación polimorfonuclear, estímulo de la síntesis de otras citocinas proinflamatorias (como las interleucinas 1, 6 y 8), activación de metaloproteinasas y del factor estimulador de colonias de granulocitos y macrófagos13,14. Los efectos del TNF-α pueden explicar numerosas alteraciones de la EII (fig. 2), como son la presencia de fiebre, resorción ósea, anemia, estado procoagulativo, incremento de 46 Documento descargado de http://www.elsevier.es el 20/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. CASELLAS I JORDÀ F. INHIBIDORES DEL FACTOR DE NECROSIS TUMORAL ALFA EN LA ENFERMEDAD INFLAMATORIA INTESTINAL la permeabilidad intestinal, inflamación y edema locales, infiltrado polimorfonuclear y granulomas15. Estos datos indican de forma indirecta la importancia de una producción excesiva del TNF-α en el desarrollo de la EII. De acuerdo con el modelo fisiopatológico citado, debería existir una relación causal entre la flora entérica y la producción local de TNF-α. Esta relación se ha confirmado mediante estudios que han demostrado que la mucosa del colon de los pacientes con EII reacciona liberando TNF-α al contacto con antígenos bacterianos16,17. Por todo ello es lógico que cuando se ha determinado la producción de TNF-α en la EII, aquélla se ha hallado anormalmente elevada. La presencia de células productoras de TNF-α está incrementada en la EII. Se localizan de forma predominante en la zona subepitelial en la CU y en todo el grosor de la lámina propia en la EC18. La medición in vitro en muestras de colon humano de la actividad de la enzima TACE, que libera el TNF-α soluble activo del TNF-α transmembrana, ha evidenciado que está significativamente aumentada en la CU19, lo que demuestra que en la EII los mecanismos enzimáticos capaces de liberar TNF-α activo están activados. Estudios in vitro mediante cultivos de mucosa de pacientes con CU y EC han demostrado también una hiperproducción de TNF-α en la fase activa de la enfermedad20,21. Estudios in vivo en pacientes con CU activa detectan que la liberación intracolónica de TNF-α, medida mediante técnica de perfusión de colon, es muy elevada y se reduce significativamente tras 4 semanas de tratamiento oral con ácido 5-aminosalicílico al disminuir la actividad de la enfermedad22. Del mismo modo, en suero y heces de pacientes con EC activa se detectan valores aumentados de TNF-α23,24. Estas evidencias in vivo e in vitro confirman el papel central del TNF-α en el desarrollo de la EII. La hipótesis de que el bloqueo del TNF-α disminuye la inflamación intestinal ha quedado verificada en modelos experimentales de inflamación crónica intestinal25, lo que ha estimulado su estudio en el paciente con EII. Antagonistas del TNF-␣ y enfermedad inflamatoria intestinal Se han ensayado varias moléculas en modelos animales de inflamación y posteriormente se han aplicado en el ser humano. Los inhibidores de la fosfodiesterasa 4 como el rolipram, el mesopram, la pentoxifilina o su análogo la oxpentifilina inhiben la producción de TNF-α in vitro e in vivo 26 mediante la inhibición de la transcripción del TNF-α y mejoran la inflamación en modelos experimentales de colitis27-29. Sin embargo, los inhibidores de la fosfodiesterasa no han conseguido un efecto terapéutico significativo en la EII30. La talidomida inhibe la producción de TNF-α monocitario estimulado con lipopolisacáridos31 a través de un aumento en la degradación del ARN mensajero del TNF-α32. Además, la talidomida induce la apoptosis de los monocitos, lo que favorece su efecto antiinflamatorio33. Existe poca experiencia en la aplicación de la talidomida en la EII, y se han publicado algunas experiencias no controladas. En la EC refractaria del joven, la talidomida indujo la remisión y la mantuvo a largo plazo en 4 de 5 pacientes que la recibieron34. En un estudio con 22 adultos con EC corticorrefractaria o fistulosa que recibieron 200-300 mg/día de talidomida durante 3 meses, se consiguió la remisión clínica o el cierre de las fístulas en 9, lo que indica que algunos pacientes con EC refractaria responden a este tratamiento35. Este efecto inductor de remisión de la EC corticorrefractaria puede conseguirse con dosis bajas de talidomida, ya que con 50-100 mg/día durante 3 meses se consigue la remisión en el 20% de los pacientes y la reducción de la dosis de glucocorticoides en casi la mitad de los pacientes in47 cluidos36. Sin embargo, los efectos adversos asociados al uso de la talidomida han limitado mucho su utilización. Se han identificado moléculas como el GI5402 o el TMI1 que inhiben la enzima TACE, necesaria para liberar el TNF-α soluble activo, y que reducen significativamente la actividad del TNF-α liberado por los monocitos estimulados con lipopolisacáridos37-38. El RO-327315, un derivado del ácido hidroxámico con una potente actividad inhibidora de la TACE, ha demostrado en estudios en humanos que, administrado por vía oral, bloquea la liberación de TNF-α estimulado con lipopolisacárido39. De todos modos no se dispone de estudios controlados que evalúen su eficacia en los pacientes con EII. La investigación y aplicación del tratamiento anti-TNF-α se centra básicamente en el desarrollo de anticuerpos monoclonales dirigidos contra el TNF-α. El infliximab o cA2 es un anticuerpo monoclonal tipo inmunoglobulina G1 quimérica (el 25% de origen murino y un 75% de origen humano) que neutraliza los efectos del TNF-α in vitro e in vivo por bloqueo tanto del TNF-α soluble como del TNF-α transmembrana40,41. En los pacientes con EC activa refractaria a los que se administra infliximab, se ha observado que el número de células mononucleares de la lámina propia que expresan TNF-α está significativamente disminuido42, y que se estimula la apoptosis de los linfocitos T activados del colon inflamado43. Esto indica que el infliximab podría bloquear la respuesta de los linfocitos T helper tipo 1 de la mucosa intestinal, lo que justificaría su uso en la EII, especialmente en la EC. El CDP571 es un anticuerpo monoclonal humanizado tipo inmunoglobulina G4 con cerca del 5% de origen murino. El CDP571 tiene una vida media similar a la del infliximab (13 frente a los 9,5 días del infliximab), pero tiene la ventaja de provocar mínima o nula inmunogenicidad44. El CDP870 es un anticuerpo monoclonal humanizado pegilado, ya que el anticuerpo está ligado a una molécula de polietilenglicol, que se fija a las fracciones soluble y de membrana del TNF-α. El adalimumab (D2E7), otro anticuerpo recombinante monoclonal específico para el TNF-α, de tipo inmunoglobulina G1, que bloquea los receptores p55 y p75, tiene la ventaja frente a los citados anteriormente de ser completamente humano45. La administración de una dosis única de adalimumab en pacientes con artritis reumatoide es bien tolerada e induce una rápida respuesta clínica, aparente a partir de las primeras 24 h de la infusión46. Existe, sin embargo, muy poca información sobre el efecto y la eficacia de estos nuevos anti-TNF-α en la EC, por lo que habrá que esperar los resultados de los estudios que se están llevando a cabo actualmente47. Con objeto de eliminar la proteína murina de los anticuerpos monoclonales anti-TNF-α, se han elaborado proteínas de fusión que contienen uno o más receptores solubles humanos ligados a la fracción constante de un anticuerpo humano. El etanercept es una proteína de fusión constituida por 2 cadenas idénticas del monómero p75 del receptor del TNF recombinante humano fusionadas a una inmunoglobulina humana G148. Por su parte, el onercept es una forma recombinante del receptor soluble p55 del TNF-α (proteína 1 ligada al TNF) que posee gran capacidad de neutralización del TNF-α in vitro 49 y de inhibición de la citotoxicidad, adherencia leucocitaria y liberación de citocinas inducidas por el TNF-α50. Estos nuevos preparados antagonizan el efecto del TNF-α con un buen perfil de seguridad51, lo que ha estimulado su aplicación en el tratamiento de la EII. Anti-TNF-␣ en la inducción de la remisión de la enfermedad de Crohn activa El inicio del uso del infliximab en el tratamiento de la EC se establece en 1993, en un paciente de 14 años de edad con Med Clin (Barc) 2004;123(16):627-34 629 Documento descargado de http://www.elsevier.es el 20/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. CASELLAS I JORDÀ F. INHIBIDORES DEL FACTOR DE NECROSIS TUMORAL ALFA EN LA ENFERMEDAD INFLAMATORIA INTESTINAL una enfermedad refractaria que recibió 2 dosis de 10 mg/kg con buena respuesta52. Posteriormente se han llevado a cabo diversos estudios para determinar la relación dosis/respuesta al infliximab. Van Dullemen et al53 compararon dosis únicas de 10 o 20 mg/kg en 10 pacientes con EC refractaria, sin observar diferencias en el efecto entre ambas dosis. McCabe et al54 presentaron en la reunión anual de la Asociación Americana de Gastroenterología los resultados de un estudio aleatorizado en 20 pacientes; compararon una dosis única de 1, 5, 10 o 20 mg/kg y descubrieron mejora clínica sintomática –descenso superior a 70 puntos del Crohn’s Disease Activity Index (CDAI)– a las 4 semanas en el 40, el 80, el 80 y el 80%, respectivamente. A la luz de estos resultados se realizó un estudio multinacional controlado y aleatorizado frente a placebo para comparar 5, 10 o 20 mg/kg en dosis única en 108 pacientes con EC refractaria55. A las 4 semanas de seguimiento, 27 de los 83 pacientes que recibieron infliximab estaban en remisión frente a sólo uno del grupo placebo (odds ratio de 8,1 con un intervalo de confianza del 95% de 1,2-56,9 y número necesario a tratar de 9). Se observó mejora clínica sintomática (descenso superior a 70 puntos del CDAI) en el 17% de los pacientes que recibieron placebo frente a un 82, un 50 y un 64% de los que recibieron 5, 10 y 20 mg/kg, respectivamente. La mejoría sintomática se acompañó de una mejor puntuación del cuestionario de calidad de vida Inflammatory Bowel Disease Questionnaire. En un subgrupo de 30 pacientes del mismo estudio se analizó la mejoría endoscópica a las 4 semanas de recibir placebo (n = 8) o las 3 dosis descritas de infliximab56. Los cambios endoscópicos son superponibles a los clínicos, en el sentido de que con placebo no se consigue ningún cambio en el índice de actividad endoscópica utilizado, mientras que en los 3 grupos tratados con 5, 10 o 20 mg/kg de infliximab el índice de actividad se redujo significativamente. Estos resultados han permitido concluir que una infusión única de infliximab a dosis de 5 mg/kg es eficaz en el tratamiento de inducción de la remisión de la EC activa refractaria al tratamiento convencional. Un ensayo clínico ha analizado la eficacia del CDP571 en la inducción de la remisión en la EC activa en 31 pacientes que, de forma aleatorizada, recibieron una dosis de 5 mg/kg de CDP571 o placebo y fueron seguidos durante 2 semanas57. Ninguno de los pacientes del grupo placebo mostró mejoría, mientras que entre los tratados mejoró la puntuación de los índices de actividad y se consiguió la remisión en el 28% de los pacientes. Otro ensayo clínico analizó la eficacia del CDP571 a más largo plazo58. En este estudio se comparó el CDP571, a dosis de 10-20 mg/kg, frente a placebo en 169 pacientes con EC activa moderadagrave que fueron seguidos durante 24 semanas. Los resultados fueron similares para ambas dosis del fármaco, que demostró ser más eficaz que el placebo en la inducción de remisión clínica (un 11 frente al 4% a las 24 semanas) y en el cierre de las fístulas (el 50 frente al 15%), aunque sin alcanzar valores estadísticamente significativos. Estos resultados deben matizarse además por el número de pacientes que no completaron el estudio y por el hecho de que la calidad de vida de los pacientes tratados no fue distinta de la de los que recibieron placebo. Una ventaja potencial del CDP571 es que es bien tolerado por los pacientes que han desarrollado hipersensibilidad al infliximab59. La utilidad del etanercept en la inducción de la remisión de la EC clínicamente activa moderada-grave se estudió en 43 pacientes que recibieron de forma aleatorizada 25 mg por vía subcutánea de etanercept o placebo 2 veces a la semana60. El análisis de los resultados a las 4 semanas puso de manifiesto que el tratamiento era bien tolerado pero su efi- 630 Med Clin (Barc) 2004;123(16):627-34 cacia no era superior a la del placebo (el 39 frente al 45% con placebo). Estos resultados desalentadores contradicen la evidencia favorable apuntada por estudios piloto previos en pacientes con EC activa refractaria a los glucocorticoides, en los que 25 mg subcutáneos 2 veces a la semana de etanercept durante 12 semanas mejoraron los síntomas, la colonoscopia y la calidad de vida de los pacientes61. El motivo de que el infliximab es más eficaz que el etanercept en el tratamiento de la EC puede guardar relación con el diferente efecto que tiene sobre los linfocitos. Así, en la EC tanto el infliximab como el etanercept tienen gran poder neutralizante del TNF-α soluble, pero el infliximab actúa sobre los linfocitos de la lámina propia estimulando su apoptosis y la activación de la caspasa-3, efecto que no induce el etanercept62. Un estudio piloto con onercept, a dosis de 11,7-50 mg 3 veces a la semana, también ha señalado su potencial utilidad en la EC activa al conseguir inducir la remisión en el 58% de los pacientes en 6 semanas y mantener la enfermedad inactiva durante 2-4 meses sin la aparición de anticuerpos contra el onercept63. Sin embargo, serán necesarios estudios controlados más amplios para definir con exactitud la utilidad de las proteínas de fusión en el tratamiento de la EC. Anti-TNF-␣ en el mantenimiento de la remisión a largo plazo de la enfermedad de Crohn Dadas las buenas experiencias en el tratamiento de la fase aguda de la EC con infliximab, se ha investigado si su efecto puede mantenerse mediante la administración periódica de retratamientos. Observaciones clínicas apuntan a que en pacientes en los que se ha inducido la remisión de la EC con infliximab el retratamiento periódico con el fármaco consigue un efecto duradero en el mantenimiento de la remisión64. Un estudio inicial, multinacional, controlado y aleatorizado comparó 4 dosis de 10 mg/kg de infliximab cada 2 meses con placebo en 73 pacientes con EC activa refractaria que habían respondido inicialmente a una dosis de infliximab65. Al finalizar el tratamiento, el 72% de los pacientes del grupo infliximab mantenían una mejoría clínica (descenso superior a 70 puntos del índice CDAI), que sólo se observó en el 44% de los que recibieron placebo. A las 44 semanas de seguimiento, el 52% de los pacientes tratados con infliximab estaban en remisión clínica (puntuación del CDAI inferior a 150), mientras que sólo el 20% de los que recibieron placebo estaba en remisión. En cuanto a la seguridad del tratamiento, éste se consideró seguro, aunque el 16% de los pacientes se retiraron del estudio por efectos adversos, el 8% desarrolló anticuerpos anti-ADN y el 15%, anticuerpos humanos antiquiméricos. En el año 2002 se publicaron los resultados de un importante estudio multinacional, el ACCENT-I (A Crohn’s Disease Clinical Trial Evaluating Infliximab in a New Long-term Treatment Regimen), en el que se evaluó prospectivamente la eficacia del tratamiento a largo plazo del infliximab en 573 pacientes con EC activa tratada con una dosis inicial de 5 mg/kg de infliximab y seguida de diferentes pautas terapéuticas durante 54 semanas66. A las 30 semanas de seguimiento, el 21% de los pacientes que recibían placebo estaba en remisión clínica (puntuación del CDAI inferior a 150 puntos), mientras que también lo estaban el 39 y el 45% de los que recibían 5 o 10 mg/kg de infliximab, respectivamente, cada 8 semanas. Estos resultados demuestran que el infliximab mantiene una respuesta clínica prolongada mejor que el placebo (odds ratio de 2,7 e intervalo de confianza del 95% de 1,6-4,6). A las 54 semanas de seguimiento el 48 Documento descargado de http://www.elsevier.es el 20/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. CASELLAS I JORDÀ F. INHIBIDORES DEL FACTOR DE NECROSIS TUMORAL ALFA EN LA ENFERMEDAD INFLAMATORIA INTESTINAL porcentaje de pacientes en remisión clínica mantenida con placebo era sólo del 9%, cifra significativamente inferior al 24 y el 32% de los que permanecían en remisión con 5 y 10 mg/kg, respectivamente. La proporción de respuestas valoradas por endoscopia fue similar; se consiguió una respuesta endoscópica mantenida en el 7% de los que recibieron placebo frente al 46 y el 53% de los tratados con 5 y 10 mg/kg, respectivamente. Un dato interesante del mismo estudio66 es que se trató a los pacientes que dejaron de responder con una dosis de infliximab 5 mg/kg más elevada de la que habían recibido hasta ese momento; de este modo se consiguió una tasa de respuesta clínica mantenida en torno al 65%. El tratamiento se consideró seguro. Presentaron infecciones graves un 3,8% de los pacientes, reacciones de hipersensibilidad un 2,4% y autoanticuerpos el 49%, aunque no se encontraron diferencias en la incidencia de efectos adversos entre los diferentes grupos. Si bien el desarrollo de fenómenos de autoinmunidad, como anticuerpos antinucleares, puede ser relativamente frecuente tras la administración de dosis repetidas de infliximab, su repercusión clínica parece poco relevante67. Las principales conclusiones que se pueden extraer de los citados estudios es que el infliximab a dosis repetidas cada 8 semanas es superior al placebo en el mantenimiento de la remisión de la EC y permite la retirada de los glucocorticoides. Una limitación de estos estudios con infliximab a largo plazo es que sólo incluyen a los pacientes con buena respuesta inicial al tratamiento. Por ello se ha extrapolado del estudio ACCENT-I la información a las 54 semanas de seguimiento en todos los pacientes, incluidos también los que no presentaron buena respuesta inicial68. Por tanto, los pacientes recibieron cada 8 semanas placebo o infliximab (5 o 10 mg/kg), y los que presentaron empeoramiento durante el seguimiento (descenso de la puntuación del CDAI superior a 70 puntos), infliximab a una dosis 5 mg/kg superior a la que recibían. La remisión clínica se mantuvo en el 32% de los que recibían placebo y en el 42% de los tratados con infliximab. La remisión endoscópica se mantuvo en el 18% de los seguidos con placebo y en el 42 y el 47% de los que recibieron 5 y 10 mg/kg de infliximab, respectivamente. De forma parecida, fue significativamente más frecuente una buena percepción de la calidad de vida (medida como una puntuación del Inflammatory Bowel Disease Questionnaire superior a 170 puntos) en los pacientes tratados con 10 mg/kg de infliximab que en los que recibían placebo. La necesidad de ingresos hospitalarios también se redujo con infliximab (el 23 y el 24% con 5 y 10 mg/kg de infliximab, respectivamente, frente al 38% en los tratados con placebo). Otros subanálisis del citado estudio ACCENT-I han pormenorizado el efecto sobre el empleo y la calidad de vida de los pacientes medida con el cuestionario específico Inflammatory Bowel Disease Questionnaire y el genérico SF-3669,70. Los resultados de estos estudios confirman una mejor situación laboral y una mejor puntuación de todas la dimensiones de la vida analizadas con ambos cuestionarios por los pacientes que han recibido infliximab, y que la puntuación es, para la mayoría de las dimensiones, mejor en los que han recibido 10 mg/kg que en los tratados con 5 mg/kg. Estos resultados confirman los del estudio ACCENT-I, aunque apuntan que la respuesta a largo plazo es más constatable con una dosis de 10 mg/kg de infliximab. al71 aleatorizaron a 94 pacientes con EC y fístulas abdominales o perianales para recibir placebo o 3 dosis a las semanas 0, 2 y 6 de 5 o 10 mg/kg de infliximab. Se observó respuesta clínica (definida como cese en la supuración de al menos la mitad de las fístulas durante 2 visitas consecutivas) en el 68% de los tratados con 5 mg/kg y en el 56% de los tratados con 10 mg/kg, dato que contrasta con el 26% de los que recibieron placebo. El cierre completo de las fístulas se consiguió en el 55% de los tratados con 5 mg/kg, el 38% de los tratados con 10 mg/kg y sólo el 13% de los que recibieron placebo. El tratamiento se consideró seguro, ya que la tasa de efectos adversos con infliximab fue similar a la del placebo, aunque el 13% de los pacientes desarrollaron anticuerpos anti-ADN. Estos resultados demuestran que 3 dosis de 5 mg/kg de infliximab son más eficaces que el placebo para conseguir el cierre de las fístulas cutáneas de la EC. El problema de esta pauta es que la duración de la respuesta es breve y similar para los 3 grupos de tratamiento, con reactivación de las fístulas al cabo de una mediana de 3 meses. Para mejorar el resultado a largo plazo se ha propuesto añadir al infliximab tratamiento con azatioprina o 6-mercaptopurina. En un estudio piloto con 16 pacientes con fístulas cutáneas o perianales refractarias al tratamiento se han asociado 3 dosis de infliximab a dichos inmunodepresores a largo plazo, y se ha conseguido el cierre de las fístulas durante 6 meses en el 75% de los pacientes72. Para determinar la eficacia y seguridad de dosis repetidas de infliximab en el cierre a largo plazo de las fístulas de la EC, se ha llevado a cabo el estudio ACCENT-II (A Crohn’s Disease Clinical Trial Evaluating Infliximab in a New Long-Term Treatment Regimen in Patients with Fistulizing Crohn’s Disease)73. En ese estudio multinacional, controlado y aleatorizado a doble ciego, participaron 306 pacientes con fístulas enterocutáneas o perianales por EC que recibieron 3 dosis de 5 mg/kg de infliximab las semanas 0, 2 y 6. Aquellos que respondieron al tratamiento inicial (correspondientes al 69% de los pacientes incluidos al inicio en que cerró al menos la mitad de las fístulas) se aleatorizaron para recibir placebo (n = 99) o 5 mg/kg de infliximab (n = 96) las semanas 14, 22, 30, 38 y 46. De los pacientes que recibieron placebo, a las 54 semanas de seguimiento sólo el 23% evidenció una mejoría de las fístulas y el 19%, un cierre completo. Este resultado contrasta con el de los pacientes que recibieron infliximab, que mejoraron las fístulas en el 46% y con un 36% de cierre completo. La buena respuesta en la evolución de las fístulas conseguida con el tratamiento se siguió de una mejora paralela de la actividad clínica medida con el CDAI y de la calidad de vida medida con el cuestionario específico Inflammatory Bowel Disease Questionnaire73. Del mismo estudio destaca que, en los pacientes que no fueron incluidos en el tratamiento de mantenimiento por mala respuesta inicial al infliximab, el retratamiento con infliximab no consiguió mejores resultados que el placebo. La seguridad del tratamiento también se consideró buena, puesto que no se apreciaron más efectos adversos que con el placebo, aunque 2 pacientes presentaron posteriormente neoplasias de recto y el 23% desarrolló anticuerpos anti-ADN. En consecuencia, dosis repetidas cada 8 semanas de infliximab son capaces de mantener el cierre de las fístulas debidas a EC en los pacientes que presentan buena respuesta al tratamiento inicial. Anti-TNF-␣ en el tratamiento de la enfermedad de Crohn fistulizante Anti-TNF-␣ en el tratamiento de la colitis ulcerosa Los agentes anti-TNF-α también se han ensayado en el tratamiento de complicaciones de la EC, especialmente para el cierre de las fístulas cutáneas. Con este objetivo, Present et 49 Los agentes anti-TNF-α también se han contemplado en el tratamiento de la CU refractaria al tratamiento convencional, aunque con menos éxito que el obtenido en la EC. A pesar de que las observaciones iniciales fueron muy alentadoras74, Med Clin (Barc) 2004;123(16):627-34 631 Documento descargado de http://www.elsevier.es el 20/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. CASELLAS I JORDÀ F. INHIBIDORES DEL FACTOR DE NECROSIS TUMORAL ALFA EN LA ENFERMEDAD INFLAMATORIA INTESTINAL los resultados de los estudios controlados no han confirmado las expectativas. Un estudio piloto multinacional, controlado y aleatorizado frente a placebo ha incluido a 11 pacientes con CU corticorrefractaria para determinar el efecto de 3 dosis diferentes de infliximab (5, 10 o 20 mg/kg) en una única infusión75. Ninguno de los 3 pacientes que recibió placebo había mejorado a las 2 semanas de seguimiento, y los 3 requirieron colectomía, mientras que 4 de los 8 que recibieron infliximab tuvieron buena respuesta clínica. El reducido número de pacientes incluidos, debido a la escasez de pacientes que cumplían los criterios exigidos, impide extraer conclusiones definitivas acerca de la potencial utilidad del infliximab en la CU. Por dicho motivo se ha realizado un ensayo clínico prospectivo en 43 pacientes con CU corticorrefractaria, a los que se aleatorizó para recibir placebo o 2 infusiones de 5 mg/kg de infliximab las semanas 0 y 2, y a quienes se evaluó en la semana 676. No se encontraron diferencias estadísticamente significativas entre los grupos infliximab y placebo, y tampoco en la evaluación clínica (índice sintomático de la colitis ulcerosa), endoscópica (índice de Baron) ni en la calidad de vida (medida con los cuestionarios Inflammatory Bowel Disease Questionnaire y EuroQol). Estos resultados contrastan con los descritos en algunos estudios observacionales. Así, por ejemplo, Su et al77 analizaron el resultado de la administración de diversas pautas de infliximab en 27 pacientes con CU activa, y consiguieron inducir la remisión en el 44%. Sin embargo, al analizar por separado a los pacientes que presentaban una colitis refractaria, sólo se consiguió respuesta clínica en el 33%. Bermejo et al78 describen a 7 pacientes con CU activa refractaria, de los que 6 mejoran clínica y endoscópicamente con una dosis única de 5 mg/kg de infliximab78. Con estos resultados aún no se puede apoyar la indicación terapéutica del infliximab en la CU activa refractaria hasta que se contrasten los resultados en ensayos terapéuticos controlados. En un estudio abierto, 15 pacientes con CU activa fueron tratados con una infusión única de 5 mg/kg de CDP571 para evaluar la respuesta a las 2 semanas79. El tratamiento mejoró la puntuación del índice de actividad clínica, la actividad endoscópica y las concentraciones plasmáticas de interleucina 6, aunque sin alcanzar significación estadística para ninguno de los parámetros analizados. En ocasiones no se puede distinguir entre una CU y una EC localizada exclusivamente en el colon. Si en esta situación la respuesta al tratamiento médico convencional no es buena, se plantea un dilema terapéutico. Un estudio observacional retrospectivo, en el que 20 pacientes con colitis indeterminada refractaria al tratamiento convencional o corticodependiente recibieron diversas pautas de infliximab, mostró una respuesta clínica completa en el 70% de los casos80. Esto indica que en una situación de incertidumbre diagnóstica ante un paciente con una colitis activa refractaria podría evaluarse la administración de infliximab. No se conoce con exactitud por qué unos pacientes con EC responden bien al infliximab y otros no, pero sería importante conocer qué factores influyen en dicha respuesta ya que permitiría perfilar mejor el candidato ideal al tratamiento. En la EC fistulosa parece ser que uno de los factores asociados a una mala respuesta es tener concentraciones séricas de TNF-α elevadas84. Por otra parte, se ha planteado que los pacientes con EC activa que mejor responden al infliximab son los jóvenes, con la enfermedad localizada en el colon, que reciben otros inmunodepresores y con polimorfismo FCGR3A-158 del receptor leucocitario mediador de citotoxicidad85-87. Existen situaciones que contraindican la administración de agentes anti-TNF-α, como la existencia o aparición de alergia a proteínas de origen murino, infecciones activas o existencia de abscesos, inmunodeficiencia congénita o adquirida, antecedente de neoplasia o enfermedades linfoproliferativas, enfermedades autoinmunitarias o positividad de anticuerpos anti-ADN, insuficiencia cardíaca congestiva grados III/IV, embarazo y lactancia. Por ello, antes de iniciar el tratamiento deben tomarse precauciones para descartar dichas situaciones. Debido a que el TNF-α es un factor importante en la muerte intracelular de patógenos como Mycobacterium tuberculosis, una medida obligada antes del inicio del tratamiento es la detección de una tuberculosis latente para evitar su reactivación al incio del tratamiento con infliximab88. Para ello, antes de iniciar el tratamiento, deben realizarse una anamnesis dirigida, radiografía de tórax y una prueba de la tuberculina89. La interpretación del derivado proteico purificado de la tuberculina en los pacientes con EII que van a recibir infliximab debe ser cautelosa debido a que el 71% de los pacientes no reaccionan con ningún antígeno control, lo que evidencia una elevada frecuencia de anergia en estos pacientes90. La eficacia del infliximab puede disminuir con el tiempo a consecuencia de la aparición de anticuerpos contra el fármaco. El 61% de los pacientes desarrollan anticuerpos contra el infliximab, que se asocian con un mayor riesgo de presentar reacciones durante la infusión y una disminución de la duración de la respuesta91. La administración concomitante de inmunodepresores consigue reducir los títulos de los anticuerpos contra el infliximab y aumentar las concentraciones de infliximab91,92. Los pacientes con EII que reciben tratamiento anti-TNF-α están expuestos a presentar reacciones adversas93, que en un 6% de los casos pueden ser graves94. Por ello es preciso someterlos a un seguimiento específico para detectar la aparición de reactivación de enfermedades granulomatosas, linfomas, lupus inducido por fármacos, convulsiones, pancitopenia, enfermedades desmielinizantes o deterioro de la función cardíaca en pacientes con cardiopatía previa, que puede llegar a ser mortal95. Conclusiones Aplicación práctica, recomendaciones al inicio del tratamiento con anti-TNF-␣ Evidentemente, en primer lugar, antes de iniciar el tratamiento con anti-TNF-α, debe existir una indicación demostrada. La evidencia obtenida de los ensayos clínicos controlados induce a pensar que el infliximab y el CDP571 están indicados en la inducción de la remisión de la EC activa refractaria81 y el infliximab en su mantenimiento y cierre de las fístulas, cuando no se consigue la respuesta adecuada con los inmunomoduladores clásicos82,83. La indicación de otros anticuerpos humanizados o humanos en el tratamiento de la EII está aún por determinar. 632 Med Clin (Barc) 2004;123(16):627-34 El tratamiento convencional de la EII tiene limitaciones, como una eficacia incompleta, efectos adversos y otras. Por ello, la investigación en el tratamiento de la EII sigue en continuo avance y ha alcanzado su máximo exponente actual en el tratamiento biológico. El desarrollo de anticuerpos dirigidos contra el TNF-α ha conseguido mejorar de forma significativa la inflamación intestinal tanto en modelos experimentales de colitis como en la EII humana. El infliximab es un anticuerpo quimérico contra el TNF-α que, en diversos ensayos clínicos, ha demostrado ser eficaz en el tratamiento de los brotes de EC refractarios, en el mantenimiento de la remisión y en el cierre de las fístulas gracias a su efecto 50 Documento descargado de http://www.elsevier.es el 20/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. CASELLAS I JORDÀ F. INHIBIDORES DEL FACTOR DE NECROSIS TUMORAL ALFA EN LA ENFERMEDAD INFLAMATORIA INTESTINAL anti-TNF-α, así como en la estimulación de la apoptosis linfocitaria. La administración de infliximab puede dar lugar a efectos secundarios relacionados con su efecto biológico, entre los que destacan infecciones como la tuberculosis, o con su potencial inmunogénico. Para evitar la sensibilización al infliximab, causante de pérdida de eficacia y reacciones de hipersensibilidad, se están desarrollando otros anticuerpos anti-TNF-α, humanizados o completamente humanos, agentes inhibidores de la TACE o proteínas de fusión de receptores solubles humanos. Queda en este campo un futuro prometedor en el tratamiento de la EII mediante la inhibición selectiva del TNF-α sin la aparición de los efectos indeseables de los fármacos de los que disponemos en la actualidad. REFERENCIAS BIBLIOGRÁFICAS 1. Casellas F, López Vivancos J. Evaluación de la calidad de vida en las enfermedades digestivas. Gastroenterol Hepatol 2004;27:58-68. 2. Guarner F, Malagelada JR. Gut flora in health and disease. Lancet 2003;361:512-9. 3. Shanahan F. Inflammatory bowel disease: immunodiagnostics, immunotherapeutics and ecotherapeutics. Gastroenterology 2001;120:622-35. 4. Ogura Y, Bonen DK, Inohara N, Nicolae DL, Chen FF, Ramos R, et al. A frameshift mutation in NOD2 associated with susceptibility to Crohn’s disease. Nature 2001;411:603-6. 5. Mendoza JL, Murillo LS, Fernández L, Pena AS, Lana R, Urcelay E, et al. Prevalence of mutations of the NOD2/CARD15 gene and relation to phenotype in Spanish patients with Crohn disease. Scand J Gastroenterol 2003;38:1235-40. 6. Farrell RJ, Peppercorn MA. Ulcerative colitis. Lancet 2002;359:331-40. 7. Melgar S, Yeung MM, Bas A, Forsberg G, Suhr O, Oberg A, et al. Overexpression of interleukin 10 in mucosal T cells of patients with active ulcerative colitis. Clin Exp Immunol 2003;134:127-37. 8. Sutherland L, Roth D, Beck P, May G, Makiyama K. Oral 5-aminosalicylic acid for inducing remission in ulcerative colitis. En: The Cochrane Library, Issue 4. Oxford: Update Software, 2001. 9. Sandborn W, Sutherland L, Pearson D, May G, Modigliani R, Prantera C. Azathioprine or 6-mercaptopurine for inducing remission of Crohn’s disease. En: The Cochrane Library, Issue 4. Oxford: Update Software, 2001. 10. Pearson D, May GR, Fixck G, Sutherland L. Azathioprine for maintaining remission of Crohn’s disease. En: The Cochrane Library, Issue 4. Oxford: Update Software, 2001. 11. Alfadhli AAF, McDonald JWD, Feagan BG. Methotrexate for induction of remission in refractory Crohn’s disease. En: The Cochrane Library, Issue 4. Oxford: Update Software, 2004. 12. Sandborn WJ. Evidence-based treatment algorithm for mild to moderate Crohn’s disease. Am J Gastroenterol 2003;98(Suppl 12):1-5. 13. Shalaby MR, Aggarwal BB, Rinderknect E, Svedersky LP, Finkle BS, Palladino MA. Activation of human polymorphonuclear neutrofil functions by interferon gamma and tumor necrosis factor. J Immunol 1985;135: 2069-73. 14. Moser R, Schleiffenbaum B, Groscurth P, Fehr J. Interleukin 1 and tumor necrosis factor stimulates human vascular endothelial cells to promote neutrophil passage. J Clin Invest 1989;83:444-55. 15. Van Deventer SJH. Tumor necrosis factor and Crohn’s disease. Gut 1997;40:443-8. 16. Borruel N, Casellas F, Antolín M, Llopis M, Carol M, Espín E, et al. Effects of nonpathogenic bacteria on cytokine secretion by human intestinal mucosa. Am J Gastroenterol 2003;98:865-70. 17. Dionne S, Laberge S, Deslandres C, Seidman EG. Modulation of cytokine release from colonic explants by bacterial antigens in inflammatory bowel disease. Clin Exp Immunol 2003;133:108-14. 18. Murch SH, Braegger CP, Walker-Smith JA, MacDonald TT. Location of tumour necrosis factor alpha by immunohistochemistry in chronic inflammatory bowel disease. Gut 1993;34:1705-9. 19. Brynskov J, Foegh P, Pedersen G, Ellervik C, Kirkegaard T, Bingham A, et al. Tumour necrosis factor alpha converting enzyme (TACE) activity in the colonic mucosa of patients with inflammatory bowel disease. Gut 2002;51:37-43. 20. Reimund JM, Wittersheim C, Dumont S, Muller CD, Baumann R, Poindron P, et al. Mucosal inflammatory cytokine production by intestinal biopsies in patients with ulcerative colitis and Crohn’s disease. J Clin Immunol 1996;16:144-50. 21. Borruel N, Carol M, Casellas F, Antolín M, De Lara F, Espín E, et al. Increased mucosal tumour necrosis factor α production in Crohn’s disease can be downregulated ex vivo by probiotic bacteria. Gut 2002;51:659-64. 22. Casellas F, Papo M, Guarner F, Antolín M, Armengol JR, Malagelada JR. Intraluminal colonic release of immunoreactive tumour necrosis factor in chronic ulcerative colitis. Clin Sci 1994;87:453-8. 51 23. Braegger CO, Nichols S, Murch SH, Stephens S, McDonald TT. Tumor necrosis factor alpha in stool as a marker of intestinal inflammation. Lancet 1992;339:89-91. 24. Murch SH, Lamkin VA, Savage MO, Walker-Smith JA, MacDonald TT. Serum concentrations of release tumor necrosis factor-alpha in childhood chronic inflammatory bowel disease. Gut 1991;32:913-7. 25. Videla S, García-Lafuente A, Antolín M, Vilaseca J, Guarner F, Crespo E, et al. Antitumor necrosis factor therapy in rat chronic granulomatous colitis: critical dose-timing effects on outcome. J Pharmacol Exp Ther 1998;287:854-9. 26. Neuner P, Klosner G, Schauer E, Pourmojib M, Macheiner W, Grunwald C, et al. Pentoxifylline in vivo down-regulates the release of IL-1 beta, IL6, IL-8 and tumour necrosis factor-alpha by human peripheral blood mononuclear cells. Immunology 1994;83:262-7. 27. Hartmann G, Bidlingmaier C, Siegmund B, Albrich S, Schulze J, Tschoep K, et al. Phosphodiesterase inhibitors prevent NSAID enteropathy independently of effects on TNF-alpha release. Am J Physiol 1999;277: G847-G54. 28. Armstrong AM, Foulkes R, Jennings G, Gannon C, Kirk SJ, Gardiner KR. Tumour necrosis factor inhibitors reduce the acute-phase response in hapten-induced colitis. Br J Surg 2001;88:235-40. 29. Loher F, Schmall K, Freytag P, Landauer N, Hallwachs R, Bauer C, et al. The specific type-4 phosphodiesterase inhibitor mesopram alleviates experimental colitis in mice. J Pharmacol Exp Ther 2003;305:549-56. 30. Bauditz J, Haemling J, Ortner M, Lochs H, Raedler A, Schreiber S. Treatment with tumour necrosis factor inhibitor oxpentifylline does not improve corticosteroid dependent chronic active Crohn’s disease. Gut 1997;40:470-4. 31. Sampaio EP, Sarno EN, Galilly R, Cohn ZA, Kaplan G. Thalidomide selectively inhibits tumor necrosis factor alpha production by stimulated human monocytes. J Exp Med 1991;173:699-703. 32. Moreira AL, Sampaio EP, Zmuidzinas A. Thalidomide exerts its inhibitory action on tumor necrosis factor alpha by enhancing mRNA degradation. J Exp Med 1993;177:1675-80. 33. Gockel HR, Lugering A, Heidemann J, Schmidt M, Domschke W, Kucharzik T, et al. Thalidomide induces apoptosis in human monocytes by using a cytochrome c-dependent pathway. J Immunol 2004;172:5103-9. 34. Facchini S, Candusso M, Martelossi S, Liubich M, Panfili E, Ventura A. Efficacy of long-term treatment with thalidomide in children and young adults with Crohn disease: preliminary results. J Pediatr Gastroenterol Nutr 2001;32:178-81. 35. Ehrenpreis ED, Kane SV, Cohen LB, Cohen RD, Hanauer SB. Thalidomide therapy for patients with refractory Crohn’s disease: an open-label trial. Gastroenterology 1999;117:1271-7. 36. Vasiliauskas EA, Kam LY, Abreu-Martin MT, Hassard PV, Papadakis KA, Yang H, et al. An open-label pilot study of low-dose thalidomide in chronically active, steroid-dependent Crohn’s disease. Gastroenterology 1999;117:1278-87. 37. Dekkers PE, Lauw FN, Ten Hove T, Te Velde AA, Lumley P, Becherer D, et al. The effect of a metalloproteinase inhibitor (GI5402) on tumor necrosis factor-α (TNFα) and TNF-α receptors during human endotoxemia. Blood 1999;94:2252-8. 38. Zhang Y, Xu J, Levin J, Hegen M, Li G, Robertshaw H, et al. Identification and characterization of 4-[[4-(2-butynyloxy)phenyl]sulfonyl]-N-hydroxy-2,2-dimethyl-(3S) thiomorpholinecarboxamide (TMI-1), a novel dual tumor necrosis factor-α converting enzyme/matrix metalloprotease inhibitor for the treatment of rheumatoid arthritis. J Pharmacol Exp Ther 2004;309:348-55. 39. Beck G, Bottomley G, Bradshaw D, Brewster M, Broadhurst M, Devos R, et al. (E)-2(R)-[1(S)-(hydroxycarbamoyl)-4-phenyl-3-butenyl]-2’-isobutyl2’-(methanesulfonyl)-4-methylvalerohydrazide (Ro 32-7315), a selective and orally active inhibitor of tumor necrosis factor α convertase. J Pharmacol Exp Ther 2002;302:390-6. 40. Scallon BJ, Moore MA, Trinh H, Knight DM, Ghrayeb J. Chimeric anti TNF-alpha monoclonal antibody Ca2 binds recombinant trasmembrane TNF-alpha and activates immune effector functions. Cytokine 1995;7: 251-9. 41. Siegel SA, Shealy DJ, Nakada MT, Le J, Woulfe S, Probert L. The mouse/human chimeric monoclonal antibody cA2 neutralizes in vitro and protects transgenic mice from cachexia and TNF-lethality in vivo. Cytokine 1995;7:15-25. 42. Plevy SE, Landers CJ, Prehn J, Carramanzana NM, Deem RL, Shealy D, et al. A role for TNF-alpha and mucosal T helper-1 cytokines in the pathogenesis of Crohn’s disease. J Immunol 1997;159:6276-82. 43. Ten Hove T, Van Montfrans C, Peppelenbosch MP, Van Deventer SJH. Infliximab treatment induces apoptosis of lamina propria T lymphocytes in Crohn’s disease. Gut 2002;50:206-11. 44. Stephens S, Emtage S, Vetterlein O, Chaplin L, Bebbington C, Nesbitt A, et al. Comprehensive pharmacokinetics of a humanized antibody and analysis of residual anti-idiotypic responses. Immunology 1995;85:668-74. 45. Jespers LS, Roberts A, Mahler SM, Winter G, Hoogenboom HR. Guiding the selection of human antibodies from phage display repertoires to a single epitope of an antigen. Biotechnology (NY) 1994;12:899-903. 46. Den Broeder A, Van de Putte L, Rau R, Schattenkirchner M, Van Riel P, Sander O, et al. A single dose, placebo controlled study of the fully human anti-tumor necrosis factor-alpha antibody adalimumab (D2E7) in patients with rheumatoid arthritis. J Rheumatol 2002;29:2288-98. Med Clin (Barc) 2004;123(16):627-34 633 Documento descargado de http://www.elsevier.es el 20/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. CASELLAS I JORDÀ F. INHIBIDORES DEL FACTOR DE NECROSIS TUMORAL ALFA EN LA ENFERMEDAD INFLAMATORIA INTESTINAL 47. Rose-John S, Schooltink H. CDP-870. Celltech/Pfizer. Curr Opin Investig Drugs 2003;4:588-92. 48. Mohler KM, Torrance DS, Smith CA, Goodwin RG, Stremler KE, Fung VP, et al. Soluble tumor necrosis factor (TNF) receptors are effective therapeutic agents in lethal endotoxemia and function simultaneously as both TNF carriers and TNF antagonists. J Immunol 1993;151: 1548-61. 49. Terlizzese M, Simoni P, Antonetti F. In vitro comparison of inhibiting ability of soluble TNF receptor p75 (TBP II) vs. soluble TNF receptor p55 (TBP I) against TNF-alpha and TNF-beta. J Interferon Cytokine Res 1996;16:1047-53. 50. Lou J, Ythier A, Burger D, Lou J, Ythier A, Burger D, et al. Modulation of soluble and membrane-bound TNF-induced phenotypic and functional changes of human brain microvascular endothelial cells by recombinant TNF binding protein I. J Neuroimmunol 1997;77:107-15. 51. Trinchard-Lugan I, Ho-Nguyen Q, Bilham WM, Buraglio M, Ythier A, Munafo A. Safety, pharmacokinetics and pharmacodynamics of recombinant human tumour necrosis factor-binding protein-1 (Onercept) injected by intravenous, intramuscular and subcutaneous routes into healthy volunteers. Eur Cytokine Netw 2001;12:391-8. 52. Derx B, Taminiau J, Radema S. Tumor necrosis factor antibody treatment in Crohn’s disease. Lancet 1993;342:173-4. 53. Van Dullemen HM, Van Deventer SJH, Hommes DW, Bijl HA, Jansen J, Tytgat GN, et al. Treatment of Crohn’s disease with antitumor necrosis factor chimeric monoclonal antibody (cA2). Gastroenterology 1995;109: 129-35. 54. McCabe RP, Woody J, Van Deventer SJH. A multicenter trial of cA2 antiTNF chimeric monoclonal antibody in patients with Crohn’s disease. Gastroenterology 1996;110(Suppl 4):A962. 55. Targan SR, Hanauer SB, Van Deventer SJH, Mayer L, Present DH, Braaknan T. A short-term study of chimeric monoclonal antibody cA2 to tumor necrosis factor α for Crohn’s disease. N Engl J Med 1997;337: 1029-35. 56. D’Haens G, Van Deventer S, Van Hogezand R, Chalmers D, Kothe C, Baert F, et al. Endoscpic and histological healing with infliximab anti-tumor necrosis factor antibodies in Crohn’s disease: a European multicenter trial. Gastroenterology 1999;116:1029-34. 57. Stack WA, Mann SD, Roy AJ, Heath P, Sopwith M, Freeman J, et al. Randomised controlled trial of CDP571 antibody to tumour necrosis factor-alpha in Crohn’s disease. Lancet 1997;349:521-4. 58. Sandborn WJ, Feagan BG, Hanauer SB, Present DH, Sutherland LR, Kamm MA, et al. CDP571 Crohn’s Disease Study Group. An engineered human antibody to TNF (CDP571) for active Crohn’s disease: a randomized double-blind placebo-controlled trial. Gastroenterology 2001;120: 1330-8. 59. Hanauer S, Present D, Targan SR. CDP571, a humanized monoclonal antibody to TNF-α, is well tolerated in Crohn’s disease patients with previous hypersensitivity to infliximab. Gastroenterology 2003;124:A517. 60. Sandborn WJ, Hanauer SB, Katz S, Safdi M, Wolf DG, Baerg RD, et al. Etanercept for active Crohn’s disease: a randomized, double-blind, placebo-controlled trial. Gastroenterology 2001;121:1088-94. 61. D’Haens G, Swijsen C, Noman M, Lemmens L, Ceuppens J, Agbahiwe H, et al. Etanercept in the treatment of active refractory Crohn’s disease: a single-center pilot trial. Am J Gastroenterol 2001;96:2564-8. 62. Van den Brande JM, Braat H, Van den Brink GR, Versteeg HH, Bauer CA, Hoedemaeker I, et al. Infliximab but not etanercept induces apoptosis in lamina propria T-lymphocytes from patients with Crohn’s disease. Gastroenterology 2003;124:1774-85. 63. Rutgeerts P, Lemmens L, Van Assche G, Noman M, Borghini-Fuhrer I, Goedkoop R. Treatment of active Crohn’s disease with onercept (recombinant human soluble p55 tumour necrosis factor receptor): Results of a randomized, open-label, pilot study. Aliment Pharmacol Ther 2003;17: 185-92. 64. Mendoza JL, García-Paredes J, Cruz Santamaría DM, Lana R, Ramírez Fernández E, Rodríguez Asteaga E, et al. Tratamiento con infliximab y factores predictivos de respuesta en la enfermedad de Crohn. Rev Esp Enferm Dig 2002;94:269-79. 65. Rutgeerts P, D’Haens G, Targan S, Vasiliauskas E, Hanauer SB, Present DH, et al. Efficacy and safety of retreatment with anti-tumor necrosis factor antibody (infliximab) to maintain remission in Crohn’s disease. Gastroenterology 1999;117:761-9. 66. Hanauer SB, Feagan BG, Lichtenstein GR, Mayer LF, Schreiber S, Colombel JF, et al. ACCENT I Study Group. Maintenance infliximab for Crohn’s disease: the ACCENT I randomised trial. Lancet 2002;359: 1541-9. 67. García Planella E, Doménech E, Esteve Comas M, Bernal I, Cabré E, Boix J, et al. Development of antinuclear antibodies and its clinical impact in patients with Crohn’s disease treated with chimeric monoclonal anti-TNFα antibodies (infliximab). Eur J Gastroenterol Hepatol 2003;15: 351-4. 68. Rutgeerts P, Feagan BG, Lichtenstein GR, Mayer LF, Schreiber S, Colombel JF, et al. Comparison of scheduled and episodic treatment strategies of infliximab in Crohn’s disease. Gastroenterology 2004;126:402-13. 634 Med Clin (Barc) 2004;123(16):627-34 69. Feagan BG, Yan S, Bala M, Bao W, Lichtenstein GR. The effects of infliximab maintenance therapy on health-related quality of life. Am J Gastroenterol 2003;98:2232-8. 70. Lichtenstein GR, Yan S, Bala M, Hanauer S. Remission in patients with Crohn’s disease is associated with improvement in employment and quality of life and a decrease in hospitalizations and surgeries. Am J Gastroenterol 2004;99:91-6. 71. Present DH, Rutgeerts P, Targan S, Hanauer SB, Mayer L, Van Hogezand RA, et al. Infliximab for the treatment of fistulas in patients with Crohn’s disease. N Engl J Med 1999;340:1398-405. 72. Ochsenkülhn T, Göke B, Sackman M. Combining infliximab with 6-mercaptopurine/azathioprine for fistula therapy in Crohn’s disease. Am J Gastroenterol 2002;97:2022-5. 73. Sands BE, Anderson FH, Bernstein CN, Chey WY, Feagan BG, Fedorak RN, et al. Infliximab maintenance therapy for fistulizing Crohn’s disease. N Engl J Med 2004;350:876-85. 74. Chey WY, Hussain A, Ryan C, Potter GD, Shah A. Infliximab for refractory ulcerative colitis. Am J Gastroenterol 2001;96:2373-81. 75. Sands BE, Tremaine WJ, Sandborn WJ, Rutgeerts PJ, Hanauer SB, Mayer L, et al. Infliximab in the treatment of severe, steroid-refractory ulcerative colitis: a pilot study. Inflamm Bowel Dis 2001;7:83-8. 76. Probert CS, Hearing SD, Schreiber S, Kuhbacher T, Ghosh S, Arnott ID, et al. Infliximab in moderately severe glucocorticoid resistant ulcerative colitis: a randomised controlled trial. Gut 2003;52:998-1002. 77. Su C, Salzberg BA, Lewis JD, Deren JJ, Kornbluth A, Katzka DA, et al. Efficacy of anti-tumor necrosis factor therapy in patients with ulcerative colitis. Am J Gastroenterol 2002;97:2577-84. 78. Bermejo F, López-Sanromán A, Hinojosa J, Castro L, Jurado C, GómezBelda AB. Infliximab induce respuesta clínica, endoscópica e histológica en la colitis ulcerosa refractaria. Rev Esp Enferm Dig 2004;96:94-101. 79. Evans RC, Clarke L, Heath P, Stephens S, Morris AI, Rhodes JM. Treatment of ulcerative colitis with an engineered human anti-TNFalpha antibody CDP571. Aliment Pharmacol Ther 1997;11:1031-5. 80. Papadakis KA, Treyzon L, Abreu MT, Fleshner PR, Targan SR, Vasiliauskas EA. Infliximab in the treatment of medically refractory indeterminate colitis. Aliment Pharmacol Ther 2003;18:741-7. 81. Akobeng AK, Zachos M. Tumor necrosis factor-alpha antibody for induction of remission in Crohn’s disease (Cochrane Review). En: The Cochrane Library, Issue 1. Oxford: Update Software, 2004. 82. Laine L, Hanauer SB. Considerations in the management of steroid-dependent Crohn’s disease. Gastroenterology 2003;125:906-10. 83. Sandborn WJ, Hanauer SB. Infliximab in the treatment of Crohn’s disease: a user’s guide for clinicians. Am J Gastroenterol 2002;97:2962-72. 84. Martínez-Parra J, López-Larrea C, González S, Fuentes D, Diéguez A, Deschamps EM, et al. High serum tumor necrosis factor alfa levels are associated with lack of response to infliximab in fistulizing Crohn’s disease. Am J Gastroenterol 2002;97:2350-6. 85. Vermeire S, Louis E, Carbonez A, Van Assche G, Noman M, Belaiche J, et al. Belgian Group of Infliximab Expanded Access Program in Crohn’s Disease. Demographic and clinical parameters influencing the shortterm outcome of anti-tumor necrosis factor (infliximab) treatment in Crohn’s disease. Am J Gastroenterol 2002;97:2357-63. 86. Parsi A, Achkar JP, Richardson S, Katz J, Hammel JP, Lashner BA, et al. Predictors of response to infliximab in patients with Crohn’s disease. Gastroenterology 2002;123:707-13. 87. Louis E, El Ghoul Z, Vermeire S, Dall’Ozzo S, Rutgeerts P, Paintaud G, et al. Association between polymorphism in IgG Fc receptor IIIa coding gene and biological response to infliximab in Crohn’s disease. Aliment Pharmacol Ther 2004;19:511-9. 88. Keane J, Gershon S, Wise RP, Mirabile-Levens E, Kasznica J, Schwieterman WD, et al. Tuberculosis associated with infliximab, a tumor necrosis factor alpha-neutralizing agent. N Engl J Med 2001;345:1098-104. 89. Obrador A, López San Román A, Muñoz P, Fortún J, Gassull MA. Guía de consenso sobre tuberculosis y tratamiento de la enfermedad inflamatoria intestinal con infliximab. Gastroenterol Hepatol 2003;26:29-33. 90. Mow WS, Abreu-Martín MT, Papadakis KA, Pitchon HE, Targan SR, Vasiliauskas EA. High incidence of anergy in inflammatory bowel disease patients limits the usefulness of PPD screening before infliximab therapy. Clin Gastroenterol Hepatol 2004;2:309-13. 91. Baert F, Noman M, Vermeire S, Assche GV, D’Haens G, Carbonez A, et al. Influence of immunogenicity on the long-term efficacy of infliximab in Crohn’s disease. N Engl J Med 2003;348:601-8. 92. Farrell RJ, Alsahli M, Jeen YT, Falchuk KR, Peppercorn MA, Michetti P. Intravenous hydrocortisone premedication reduces antibodies to infliximab in Crohn’s disease: a randomized controlled trial. Gastroenterology 2003;124:917-24. 93. Navarro F, Hanauer SB. Treatment of inflammatory bowel disease: safety and tolerability issues. Am J Gastroenterology 2003;98:S18-S23. 94. Colombel JF, Loftus EV, Tremaine WJ, Egan LI, Harmsen WS, Schleck CK, et al. The safety profile of infliximab in patients with Crohn’s disease: the Mayo clinic experience in 500 patients. Gastroenterology 2004;126:19-31. 95. Khanna D, McMahon M, Furst DE. Safety of tumour necrosis factor-alpha antagonists. Drug Saf 2004;27:307-24. 52